白菜渣汁混合高温厌氧发酵产沼气及微生物群落结构研究
2021-12-04李睿帆陈玉保王菊华庄诗韵张文杰胡良栋
李睿帆,陈玉保,王菊华,庄诗韵,张文杰,胡良栋
白菜渣汁混合高温厌氧发酵产沼气及微生物群落结构研究
李睿帆,陈玉保*,王菊华,庄诗韵,张文杰,胡良栋
(云南师范大学能源与环境科学学院,昆明 650500)
为了探究蔬菜渣和蔬菜汁混合后对其厌氧发酵产沼气潜力的影响,并为混合蔬菜渣汁厌氧发酵工程的应用提供合理性的分析与建议。采用批量式的发酵方式,选取白菜渣汁混合物为反应原料,在高温(55±1)℃下,底物质量分数为3%、白菜渣粒径为0.85 mm,其中白菜渣加水的实验组3(白菜渣68.34 g,水331.66 mL接种物的量为120 mL)TS降解率、VS降解率、第2个日产气高峰、最高CH4含量和累积总产气量分别为56.13%、61.06%、525 mL、66.19%和3 390 mL,发酵前后pH值分别为7.2和7.6均在产甲烷菌的正常pH范围,结果均优于其他实验组的对应指标。利用100 L的发酵罐对其进行连续搅拌厌氧发酵产沼气的小试放大实验并分析生物群落结构,通过高通量测序发现在纲水平上,古菌主要以甲烷杆菌纲、甲烷微菌纲为主;在属水平上,嗜热弯曲甲烷热杆菌属是反应器中最主要的产甲烷菌(占总菌量的55%~81%),甲烷八叠球菌属是第二主导的产甲烷菌属(占总菌量的16%~42%)。在连续搅拌过程中,甲烷主要由甲烷八叠球菌属利用CO2和H2通过还原CO2产甲烷途径和乙酸产甲烷途径产生,即甲烷八叠球菌属对连续搅拌实验组的甲烷产生起主导作用。
高温;厌氧发酵;白菜渣汁;沼气;微生物群落结构
随着我国农村产业结构的调整和城镇居民生活水平的不断提高,蔬菜作物的种植在农业中的比重不断增大,中国的蔬菜生产和消费跃居世界第一,目前蔬菜已经成为我国种植业中的第二大农作物。据“2019年中国蔬菜产业大会”报道[1],2018年我国蔬菜种植面积已突破3亿亩,产量已达7亿t以上。但大量质量不佳的蔬菜和净菜加工处理时产生的叶、根、茎和果实等都会最终成为固体废弃物,造成资源浪费环境污染[2]。蔬菜废物不仅在生产过程中产生,在配送链中也会大量产生[3]。在收获、运输、储存、销售和加工过程中,超过30%的蔬菜以蔬菜废物的形式流失[4-5]。据估算,我国的各类蔬菜废物产量每年可达6亿t以上,生物质资源利用率却未能达到30%[6]。由于蔬菜废物具有高含水量(>80%)、高有机物含量(>95%干燥基),对垃圾填埋场和焚烧系统产生严重的负面影响,残留的生物降解导致渗滤液的产生和温室气体的排放[7]。目前,国内外处理蔬菜废物的方法主要有直接还田法、堆肥法、饲料法、填埋焚烧法和厌氧发酵处理技术等。相比其他方法,厌氧发酵技术能将蔬菜废物转化成沼气,沼气具有清洁、安全和优质的优点,可用于农业生产作为燃料供能还可用于发电和供热等[8]。此外,厌氧发酵可将原料的质量体积减少大约50 %,沼气、沼渣作为副产物可直接用作土壤改良剂[9-10]或用作高质量堆肥制备的原料[11-13],实现资源的最大化利用,甚至可以减少或去除病原体[14]。刘芳等[15]利用各类蔬菜废物与牛粪在中温(35 ℃)条件下用2.5 L的发酵瓶进行厌氧发酵实验,结果发现蔬菜废物单独发酵时甘蓝菜的平均CH4含量最高;CH4含量可通过添加牛粪的方式得以提高。国外,Ghosh等[16]报道了城市生活垃圾与污泥共发酵提高了沼气产量和CH4含量。Wang 等[17]观察到,共发酵过程中,果蔬废物的比例增加5 %,CH4的产量增加22.4 %。Masebinu等[18]利用两相半连续厌氧发酵法研究果蔬废物最佳配比,结果发现果蔬废物在2.2∶2.8的比例下厌氧发酵工艺运行非常稳定,平均CH4含量达57.58 %。董晓莹等[19]利用两相厌氧发酵反应器研究了蔬菜废物产沼气情况,结果发现酸化相乙酸浓度可达66.58 %,甲烷相的甲烷产量可达0.36 m3·kg-1(VS),工艺运行稳定。
目前多数实验采用多种果蔬废物为原料进行沼气潜力分析,但以某一种蔬菜废物渣汁的混合物为原料的研究目前鲜有报道。为了实现蔬菜废物的充分利用以及对蔬菜废物厌氧发酵产沼气有更深的了解,本研究利用白菜废物渣汁的混合物为原料,在高温条件下研究蔬菜渣汁混合,以及利用静置12 h后的上层白菜废汁和水补充发酵料液体积对蔬菜废物厌氧发酵产沼气并通过小试放大及微生物群落结构研究确定最佳工艺参数在工程应用上的可行性,为蔬菜废物厌氧发酵工业和市场化应用提供理论基础。
1 材料与方法
1.1 原料与预处理
实验原料取自周边菜市场的白菜废物,白菜废物经过粉碎后,用滤布将白菜汁挤出,白菜渣的含水率控制为90.02 %,白菜渣粒径为20目,放置在–20 ℃冰箱备用。白菜汁静置12 h,将上层白菜汁和下层白菜汁分离,分别置于4 ℃冰箱备用。本实验的底物质量分数控制为3 %,白菜渣和下层白菜汁按质量比为1∶1混合。接种物取自云南大学长期正常稳定运行的污水处理站活性污泥,并自行驯化6个月的活性污泥为接种物。白菜渣汁混合废物和接种物的理化性质见表1。

表1 白菜渣汁混合废物和接种物的理化性质
1.2 实验装置
实验装置为实验室自主研发的厌氧发酵装置,批量式沼气发酵实验装置如图1所示。发酵温度为55 ℃,厌氧发酵在发酵瓶中进行,通过排水集气法,将产生的沼气通过导气管进入集气瓶,由于压强的增大,集气瓶中被压至量筒内,读取量筒内水的体积即为产生沼气的体积。其小试放大实验选用课题组自行设计的100 L发酵罐进行,装置见图2。发酵罐采用卧式放置,与水平面成30°。气体采用下进上出的方式,沼气从上端排出至气体流量计,以此记录每天的产气量,后进入储气囊储存。实验开始前皆采用压强法对装置进行密封性检验。
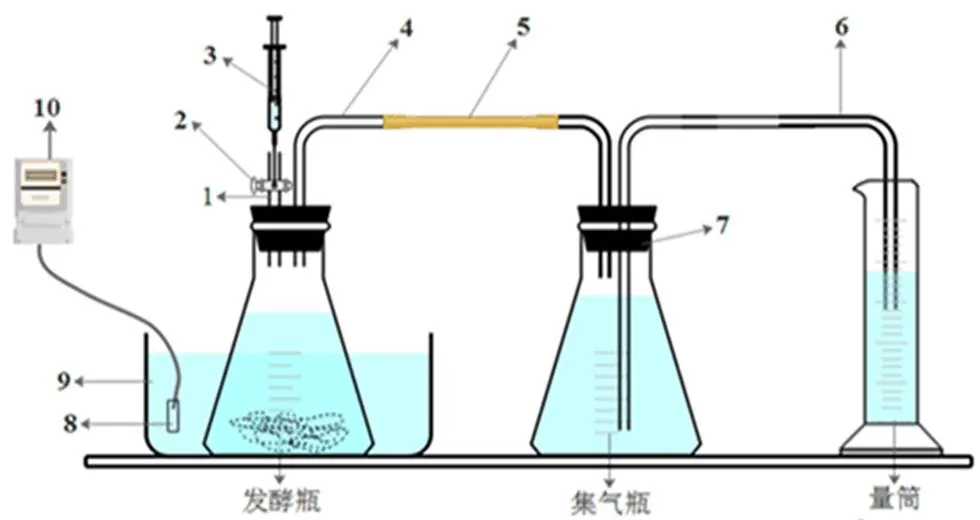
1.出气管;2.开关;3.取样器;4.导气管;5.橡皮管;6.导水管;7.橡胶塞;8.加热器;9.水槽;10.温控仪。
Figure 1 Batch constant temperature anaerobic fermentation device
1.3 实验设计
白菜渣汁混合厌氧发酵实验设计:每组实验设计3个平行实验,每组实验的接种量均为发酵料液的30 %,即120 mL接种物。设计实验组1,2以渣汁混合为原料,是否加入上层汁液为变量,设计实验组3,4,以白菜渣为原料,是否加入上层汁液为变量,设计实验组5、6以下层白菜汁为原料,是否加入上层汁液为变量,实验探究以白菜废物为原料在高温条件下蔬菜渣汁混合的最佳比例及上层白菜汁是否能代替水进行沼气发酵实验为目的。具体实验设计如表2。
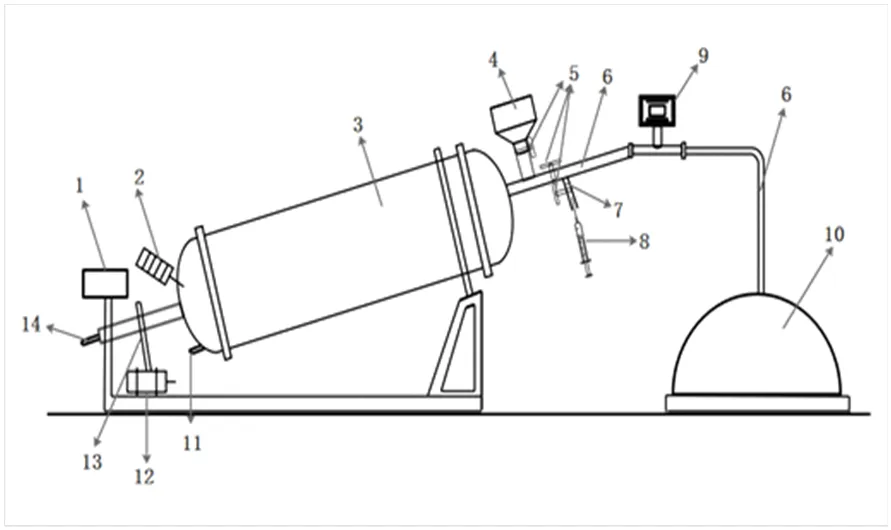
1.显示器;2.加热器;3.发酵罐;4.进料口;5.开关阀;6.出气管;7.取气口;8.取气器;9.气体流量计;10.储气囊;11.出料口;12.电动机;13.搅拌链条;14.进气管。
Figure 2 Simulated engineering anaerobic fermentation experiment device diagram
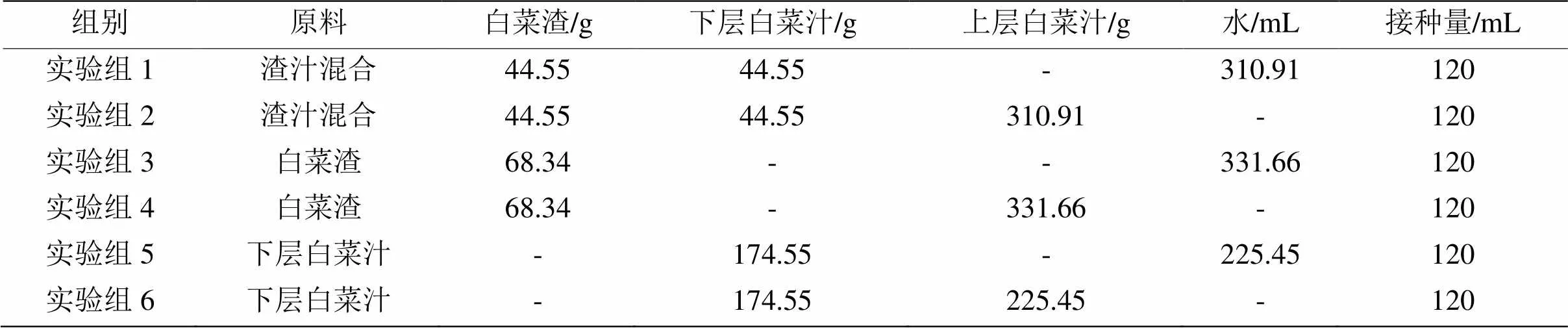
表2 白菜渣汁混合厌氧发酵实验设计
通过对比实验,选择最好的实验条件利用100 L的发酵罐进行蔬菜废物厌氧发酵产沼气的小试放大实验研究,搅拌方式设计为连续搅拌(每天24 h搅拌)下,取不同发酵阶段的样品,经离心后于-80 ℃冰箱内保存,后送至上海美吉生物医药科技有限公司进行高通量测序。
1.4 测定项目及方法
总固体含量(TS)测定采用烘干法,在真空干燥箱中(105±1)℃的条件下烘4~6 h。挥发性固体含量(VS)测定烘干法,将TS测定后的样品在马弗炉(550±1)℃的条件下烘2 h。日产气量采用排水集气法进出测定,100 L发酵罐实验产气量通过湿式气体流量计测定。CH4含量采用福立GC9790Ⅱ气相色谱仪测定,色谱仪配备TDX-01型不锈钢填充柱。色谱条件:柱箱温度105 ℃;检测器温度140 ℃;进样器温度110 ℃;载气为氮气,流速为30 mL·min-1。每2 d取一次气体样品进行CH4含量测定。
2 结果与分析
2.1 白菜渣汁混合各实验组发酵TS、VS降解率分析
白菜渣汁混合厌氧发酵产沼气的各实验组TS、VS降解率及发酵前后的pH变化如表3和图3所示。
由图3和表3可知,加入上层白菜汁的实验组(实验组2、4、6)TS、VS降解率和pH均明显小于未加入上层白菜汁的实验组(实验组1、3、5),可以得出上层白菜汁偏酸,发酵体系提前酸化,发酵反应器处于酸化状态导致发酵失衡,不利于厌氧发酵的降解和利用。未加入上层白菜汁的实验组1、3、5中,实验组3的TS和VS降解率较高,且其pH值在产甲烷菌的最佳pH的范围内,表明白菜渣单独发酵更有利于厌氧发酵的进行。实验结果表明用上层白菜汁代替水混合料液不利于蔬菜废物厌氧发酵的降解和利用,所以在生产运用中,建议用水补充发酵系统内料液的体积。用水补充发酵料液以及含水率较低的蔬菜渣较适用于蔬菜废弃物厌氧发酵产沼气的工程应用,含水率越低,产沼气性越好。
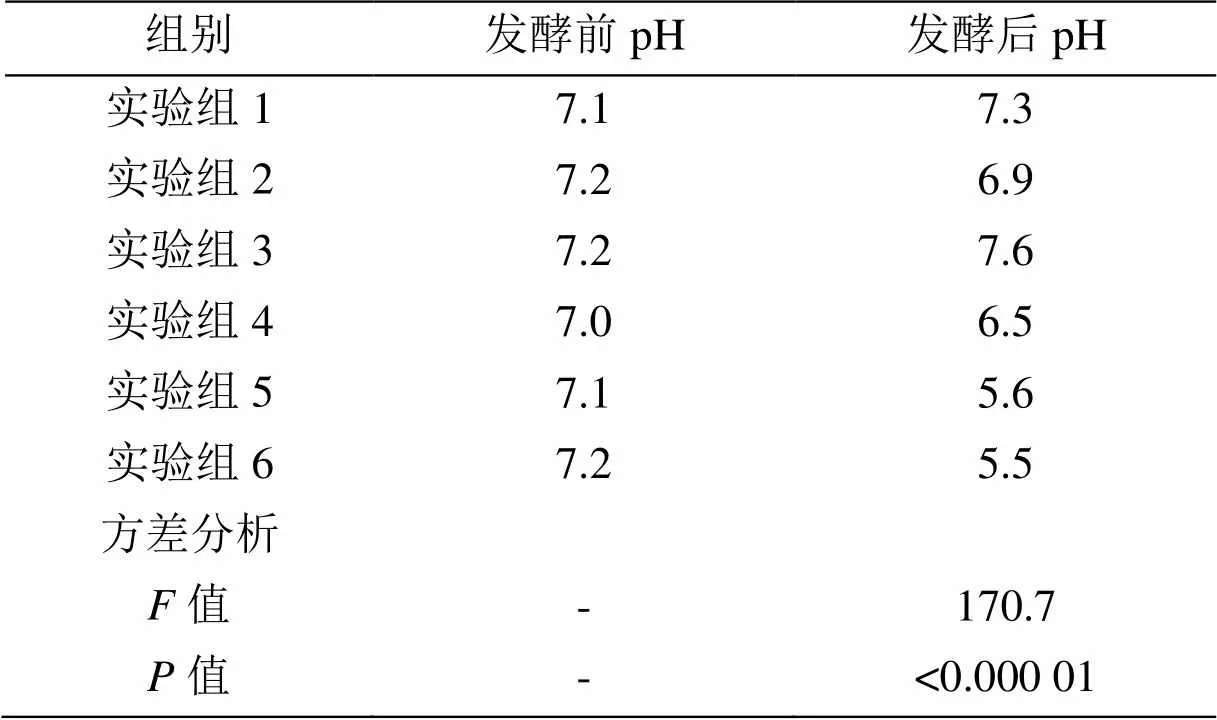
表3 白菜渣汁混合厌氧发酵前后pH变化
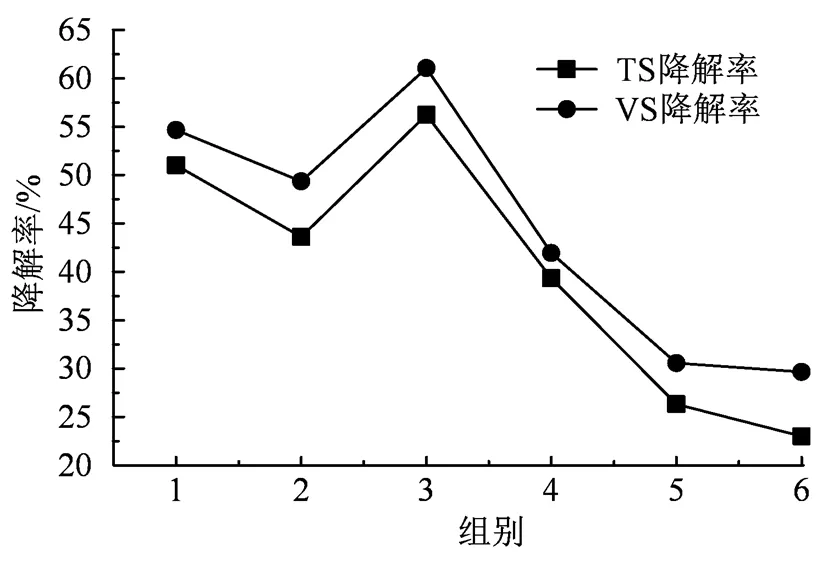
图3 白菜渣汁混合厌氧发酵前后降解率
Figure 3 Degradation rate of cabbage residue juice before and after mixed anaerobic fermentation
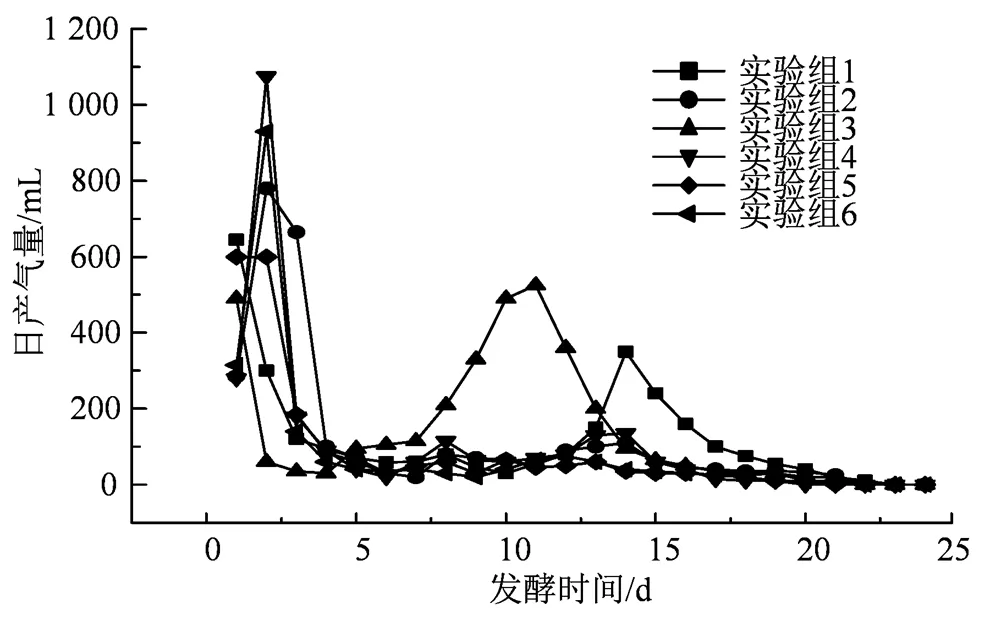
图4 白菜渣汁混合发酵每日产气量变化曲线
Figure 4 Change curve of gas yield per day in mixed fermentation of cabbage residue juice
2.2 白菜渣汁混合厌氧发酵的每日产气量
白菜渣汁混合厌氧发酵产沼气的每日产气量变化曲线如图4所示。
由图4可知,各实验组在发酵开始的第1天就开始迅速产生沼气,猜测是由于适应性较好的细菌群落相对丰富,从而缩短了代谢周期。由于实验组3的白菜渣易获得可溶性有机物,所以与其他实验组相比,实验启动的天数最少。在实验组1和实验组3中皆有两个日产气高峰,不同的是实验组3达第2个日产气高峰的时间较实验组1提前,且日产气高峰值比实验组1高。而实验组2、4、5、6在第5天后的日产气量基本维持在100 mL以下,未出现第2个产气高峰,推测出现该现象的原因有两个,一是静置12 h后的上层白菜汁的pH值较低,使发酵反应器酸化从而未能正常过渡到产甲烷阶段,二是静置12 h后的下层白菜汁中可供微生物利用的有机物较少。实验组2、4、5、6的日产气高峰值分别为780 mL、1 075 mL、600 mL和900 mL;实验组1和实验组3的第一日产气量高峰值分别为645 mL、490 mL,第2个日产气高峰值分别为325 mL和525 mL,可以看出,白菜渣汁混合发酵不如蔬菜渣单独发酵的产沼气效果好,这也说明,在用蔬菜废物进行厌氧发酵产沼气时,含水率越低越有利于提高沼气的产量。

图5 白菜渣汁混合厌氧发酵产沼气的累积总产气量变化曲线
Figure 5 Change curve of cumulative total gas yield of biogas produced by mixed anaerobic fermentation of cabbage residue juice

表4 微生物取样时间和样品编号
2.3 白菜渣汁混合厌氧发酵的累积总产气量
白菜渣汁混合厌氧发酵产沼气的累积总产气量变化曲线如图5所示。
由图5可知,在实验结束时,实验组1、2、4、5和6的累积总产气量分别为2 839 mL、2 790 mL、2 535 mL、2 080 mL和2 056 mL。而实验组3的累积总产气量为3 390 mL分别是其他实验组的1.19、1.22、1.34、1.63和1.65倍。从图中可以看出实验组2、4、5和6在发酵的前5天累积总产气量上升的迅速,说明累积总产气量加速期在发酵开始后的5 d,对比实验组1和实验组3的累计总产气量加速期分别集中在第13~17天和第9~14天,由沼气3阶段理论可知实验组1和实验组3分别在此时期处在产甲烷阶段,产甲烷菌活性较高,所以产气量增快。结合表4,图3—图5可以看出,实验组3的条件更适合蔬菜废物厌氧发酵产沼气的进行,能够提高累积总产气量。

图6 Rank-Abundance曲线和稀释曲线
Figure 6 Curve of Rank-Abundance and dilution
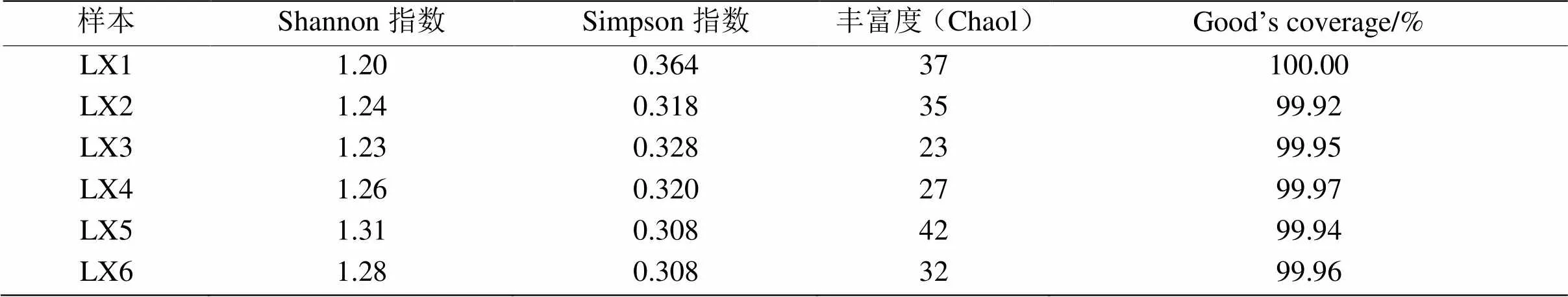
表5 Alpha多样性(OTU水平)
2.4 白菜渣汁在连续搅拌下高温厌氧发酵微生物群落结构研究
从白菜渣汁混合厌氧发酵产沼气的实验研究中得到底物质量分数为3%,原料粒径为20目的白菜渣具有较好的沼气潜力(即使用实验组3的条件),故利用100 L的发酵罐进行蔬菜废物厌氧发酵产沼气的小试放大实验研究,搅拌方式设计为连续搅拌(每天24 h搅拌)的条件下,取不同发酵阶段的样品,经离心后于-80 ℃冰箱内保存,后送至上海美吉生物医药科技有限公司进行高通量测序。具体取样时间和样品编号见表4。
2.4.1 OTU及稀释曲线分析 各实验组的Rank-Abundance曲线和稀释曲线如图6所示。
在Rank-Abundance曲线中横坐标代表OTU水平下的物种数目排序等级,纵坐标表示OTU水平下物种的数目相对百分含量,样本曲线的延伸终点横坐标位置为样本的物种数量。曲线下降平滑代表样本的物种多样性越高,曲线快速且陡然下降代表样本中优势菌群所占比例较高,多样性较低。由图6(a)可知LX1—LX6的曲线均是先快速陡然下降后趋于平滑下降的规律,这说明各实验组先呈现较高比例的优势菌群,后微生物多样性逐渐升高。这说明菌群在发酵过程中大量出现并成为优势菌群,随着反应的进行和原料的消耗优势菌群达到高峰后逐渐衰落。由于在厌氧发酵中原料被微生物利用存在明显的顺序性。通常水溶性物质会首先被利用,此时水解和利用糖类的微生物会不断生长,随着原料被分解代谢为乙酸,氢气和二氧化碳等基质,水解和利用糖类的微生物下降,而利用该基质的产甲烷菌会逐渐代替水解菌成为优势菌群,就呈现出如图先快速陡然下降后趋于平滑下降的规律。从图6(b)可知横坐标代表随机抽取的测序数据量;纵坐标代表观测到的物种数量(如Sobs)或多样性指数(如Shannon指数),LX1—LX6的稀释曲线斜率和置信区间逐渐下降,即稀释曲线逐渐趋于平缓,说明本次的测序数据量足够。
2.4.2 Alpha多样性分析 各实验组的Alpha多样性结果如表5所示。由表5可知,不同发酵阶段产甲烷菌群落的Alpha多样性差异较大,这反映了发酵过程中构建的生态反应器对其环境条件变化的响应。随着发酵时间的增长,产甲烷菌群落的丰富度(Chaol)从一开始的明显下降到后来的增加,这可能是由于氨氮和有机酸的积累在发酵前期抑制了部分水解类微生物的生长,导致整个微生物结构的丰富度相对较低,后期由于有机酸(主要是乙酸)的积累,有利于乙酸营养性产甲烷菌的生长致使其丰富度提高。从Shannon指数和Simpson指数可以看出样本的物种多样性。Shannon指数高物种分布均匀,多样性更高。各样品的Good,s coverage均达到99%以上,说明测序的深度几乎已经能反应样品中所有原核微生物群落信息。
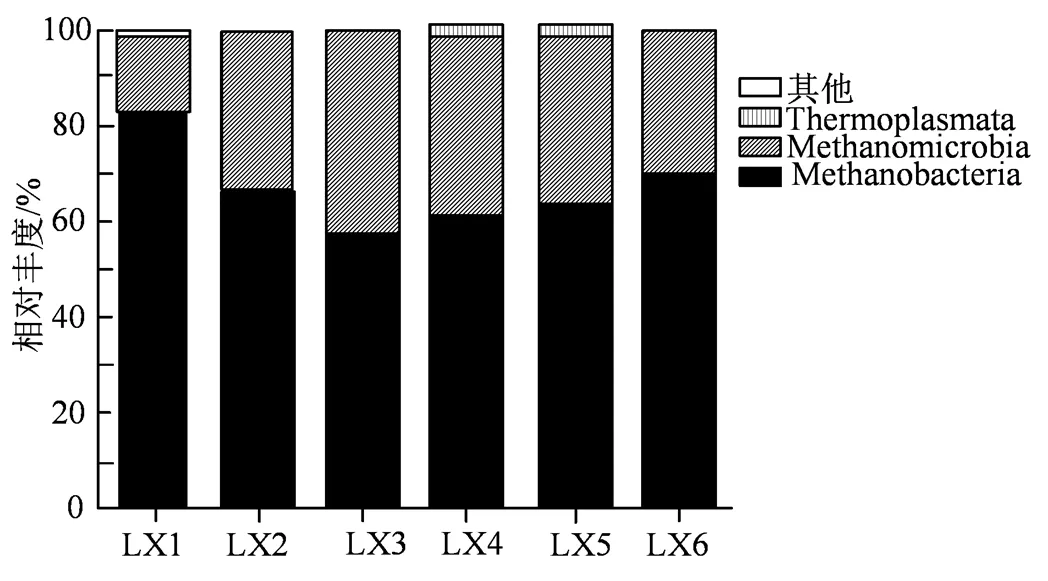
图7 纲水平物种相对丰度
Figure 7 Relative abundance at class level
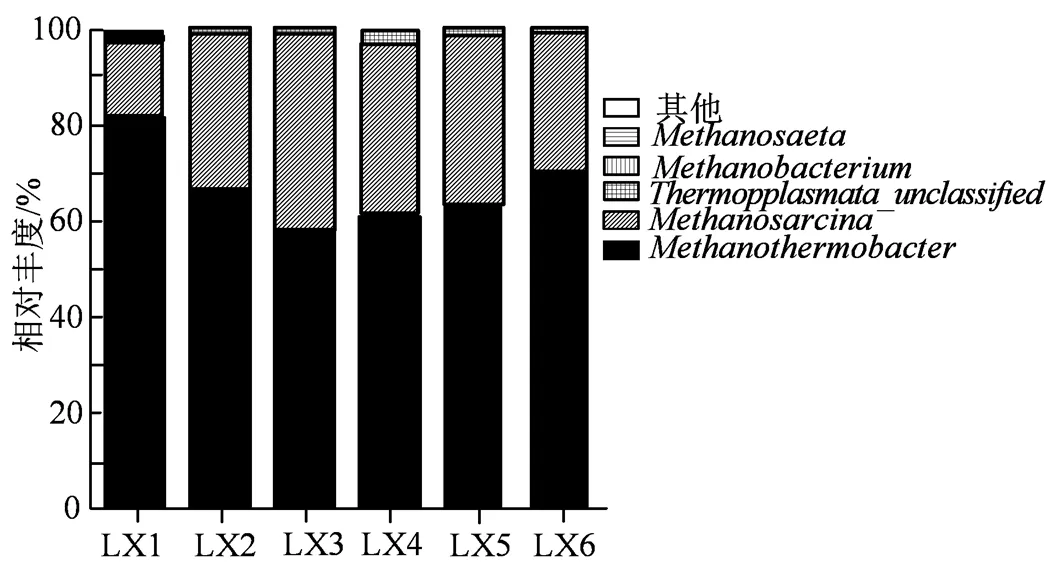
图8 属水平物种相对丰度
Figure 8 Relative abundance at genus level
2.4.3 产甲烷菌群落组成分析 各实验组微生物群落在纲和属水平的分类如图7和图8所示。
由图7可知,Illumina测序在整个连续搅拌发酵周期样品中检测到3个纲:甲烷菌纲(Methanobacteria)、甲烷微菌纲(Methanomicrobia)、热原体纲(Thermoplasmata)。古菌群落结构表明,古菌主要以甲烷菌纲(Methanobacteria)和甲烷微菌纲(Methanomicrobia)为主,其相对丰度在不同发酵阶段样品间存在差异。由图8所示,为了进一步研究不同发酵阶段微生物群落结构对甲烷含量的影响,对属水平上微生物群落结构分布及组成进行了分析。其中,嗜热弯曲甲烷热杆菌属()是反应器中最主要的产甲烷菌,占总菌量的55%~81%。其是严格厌氧嗜热型产甲烷古菌,主要生存于40~70℃的高温产甲烷环境中,可以利用H2/CO2或甲酸盐生长,最适生长pH值为6.0~8.0[20]。嗜热弯曲甲烷热杆菌属除了具有将CO2转化为CH4的能力,其中的一些菌种还可以将乙酸作为生长因子[21]。因此,乙酸的存在促进了嗜热弯曲甲烷热杆菌属的增长。甲烷八叠球菌属()是反应器中第二主导的产甲烷菌属,占总菌量的16%~42%,作为一种具有多种代谢功能的甲烷源甲烷八叠球菌属()可通过3种代谢途径产生CH4[22],如利用CO2和H2通过产氢途径或利用乙酸盐作为底物通过产酸途径生产CH4;此外,其还可以通过产甲烷途径代谢甲醇等甲基化单碳化合物生产CH4[23]。在连续搅拌发酵过程中,甲烷八叠球菌属()相对丰度呈现先增加后降低的趋势。此外,在水解和酸化过程中产生了大量的CO2和H2,甲烷主要由甲烷八叠球菌属()通过氢还原CO2产甲烷途径和乙酸产甲烷途径产生合成。这说明甲烷八叠球菌属()对连续发酵过程中甲烷的产量起主导作用。甲烷杆菌属()在整个发酵周期中普遍存在,但它们的相对丰度较低,仅占0.1%到1.07%。甲烷鬃毛菌属()是所有样品中含量最少的古菌(0%~0.64%),这与Garcia等[24]的报道一致。据报道,在厌氧发酵过程中,多达70%的甲烷形成是由甲烷八叠球菌属()引起的,而甲烷八叠球菌属()和甲烷鬃毛菌属()争夺同一底物(乙酸)[25-26]。因此,其在发酵过程中逐渐消失。
3 讨论与结论
在多数发展中国家每年产生蔬菜废物占其废物总量的30%,尤其在韩国,白菜的年总产量约为300万t,其中30%的白菜也被作为废物丢弃[27],故对白菜废物发酵的处理研究就具有重要意义。通过研究白菜渣汁混合以及用水和静置12 h后的上层白菜汁补充厌氧发酵料液对厌氧发酵产沼气的影响,分析产沼气性能,对其进行小试放大实验并对其微生物菌落结构进行了研究分析,研究发现含水率为90.02%的白菜渣、含水率为93.05%的白菜渣汁混合物、含水率为96.04%的下层白菜汁为原料进行厌氧发酵产沼气的实验研究发现,含水率较低(90.02%)的白菜渣厌氧发酵TS降解率(56.23%)、VS降解率(61.06%)、日产气量(525 mL)、甲烷含量(66.19%)、累积总产气量(3 390 mL)均高于含水率较高的实验组,且含水率越低,产沼气性能越好,故在沼气发酵过程中,前处理中物料的脱水,降低原材料的含水率,用烘干或加干物料的方法,以降低沼气原料处理成本和机械化水平。选用水补充厌氧发酵料液的产沼气特性优于用静置12 h后的上层白菜汁补充的实验组。且含水率较低(90.02%)的白菜渣及用水补充厌氧发酵料液的实验组发酵前后pH值分别为7.2和7.6,均在产甲烷菌的正常pH范围内。所以用水补充发酵料液以及含水率较低的白菜渣较适用于蔬菜废物厌氧发酵产沼气的工程应用。而后将其进行小试放大实验,在连续搅拌的条件下,分别取第2、5、8、14、18、24天的样品进行微生物菌落结构研究,在高通量测序发现,在纲水平上,古菌主要以甲烷菌纲和甲烷微菌纲为主;在属水平上,嗜热弯曲甲烷热杆菌属是反应器中最主要的产甲烷菌,占总菌量的55%~81%;甲烷八叠球菌属是反应器中第二主导的产甲烷菌属,占总菌量的16%~42%[28],在连续搅拌的过程中,甲烷主要由甲烷八叠球菌利用CO2和H2通过还原CO2产甲烷途径和乙酸产甲烷途径产生,即甲烷八叠球菌属对连续发酵过程中甲烷的产量起主导作用。
[1] 李佩珊, 马善婷. 中国蔬菜种植面积目前已突破3亿亩[J]. 中国食品, 2019, 775(15): 153.
[2] 黄鼎曦, 陆文静, 王洪涛. 农业蔬菜废物处理方法研究进展和探讨[J]. 环境污染治理技术与设备, 2002(11): 38-42.
[3] NANDA S, ISEN J, DALAI A K, et al. Gasification of fruit wastes and agro-food residues in supercritical water[J]. Energy Convers Manag , 2016, 110(15): 296-306.
[4] LI D, CHEN L, LIU X, et al. Instability mechanisms and early warning indicators for mesophilic anaerobic digestion of vegetable waste[J]. Bioresour Technol, 2017, 245(pt a): 90-97.
[5] ZEYNALI R, KHOJASTEHPOUR M, EBRAHIMI-NIK M. Effect of ultrasonic pre-treatment on biogas yield and specific energy in anaerobic digestion of fruit and vegetable wholesale market wastes[J]. Sustain Environ Res , 2017, 27(6): 259-264.
[6] 常瑞雪. 蔬菜废弃物超高温堆肥工艺构建及其过程中的氮素损失研究[D]. 北京: 中国农业大学, 2017.
[7] CHENG H F, HU Y. Municipal solid waste (MSW) as a renewable source of energy: Current and future practices in China[J]. Bioresour Technol, 2010, 101(11): 3816-3824.
[8] 张无敌, 宋洪川, 夏朝凤, 等. 论沼气及其综合利用与现代农业相结合[J]. 生态科学, 1998, 17(2):116-119.
[9] TAMBONE F, SCAGLIA B, D'IMPORZANO G, et al. Assessing amendment and fertilizing properties of digestates from anaerobic digestion through a comparative study with digested sludge and compost[J]. Chemosphere, 2010, 81(5): 577-583.
[10] ABUBAKER J, RISBERG K, PELL M. Biogas residues as fertilisers - Effects on wheat growth and soil microbial activities[J]. Appl Energy, 2012, 99: 126-134.
[11] TEGLIA C, TREMIER A, MARTEL J L. Characterization of solid digestates: part 2, assessment of the quality and suitability for composting of six digested products[J]. Waste Biomass Valorization, 2011, 2(2): 113-126.
[12] HOLM-NIELSEN J B, AL SEADI T, OLESKOWICZ- POPIEL P. The future of anaerobic digestion and biogas utilization[J]. Bioresour Technol, 2009, 100(22): 5478-5484.
[13] YAZDANI R, BARLAZ M A, AUGENSTEIN D, et al. Performance evaluation of an anaerobic/aerobic landfill-based digester using yard waste for energy and compost production[J]. Waste Manag, 2012, 32(5): 912-919.
[14] SAHLSTRÖM L. A review of survival of pathogenic bacteria in organic waste used in biogas plants[J]. Bioresour Technol , 2003, 87(2): 161-166.
[15] 刘芳, 邱凌, 李自林, 等. 蔬菜废弃物厌氧发酵产气特性[J]. 西北农业学报, 2013, 22(10): 162-170.
[16] GHOSH P, KUMAR M, KAPOOR R, et al. Enhanced biogas production from municipal solid waste via co-digestion with sewage sludge and metabolic pathway analysis[J]. Bioresour Technol, 2020, 296: 122275.
[17] WANG X M, LI Z F, BAI X, et al. Study on improving anaerobic co-digestion of cow manure and corn straw by fruit and vegetable waste: Methane production and microbial community in CSTR process[J]. Bioresour Technol , 2018, 249: 290-297.
[18] MASEBINU S O, AKINLABI E T, MUZENDA E, et al. Experimental and feasibility assessment of biogas production by anaerobic digestion of fruit and vegetable waste from Joburg Market[J]. Waste Manag, 2018, 75: 236-250.
[19] 董晓莹, 闫昌国, 王演, 等. 半连续两相厌氧发酵工艺处理蔬菜废弃物产沼气研究[J]. 太阳能学报, 2015, 36(4): 988-993.
[20] KOSAKA T, TOH H, TOYODA A. Complete genome sequence of a thermophilic hydrogenotrophic methanogen,sp. strain CaT2[J]. Genome Announc, 2013, 1(4): 672-685.
[21] CHENG L, DAI L R, LI X, et al. Isolation and characterization ofcrinale sp. nov., a novel hydrogenotrophic methanogen from the shengli oil field[J]. Appl Environ Microbiol, 2011, 77(15): 5212-5219.
[22] GALAGAN J E. The genome of M. acetivorans reveals extensive metabolic and physiological diversity[J]. Genome Res , 2002, 12(4): 532-542.
[23] ROJAS-SOSSA J P, MURILLO-ROOS M, URIBE L, et al. Effects of coffee processing residues on anaerobic microorganisms and corresponding digestion performance[J]. Bioresour Technol, 2017, 245(pt a): 714-723.
[24] GARCIA J L, PATEL B K C, OLLIVIER B. Taxonomic, phylogenetic, and ecological diversity of methanogenic Archaea[J]. Anaerobe, 2000, 6(4): 205-226.
[25] ZINDER S H. Physiological ecology of methanogens[M]// Methanogenesis. Boston, MA: Springer US, 1993: 128-206.
[26] YU Y, KIM J, HWANG S. Use of real-time PCR for group-specific quantification of aceticlastic methanogens in anaerobic processes: population dynamics and community structures[J]. Biotechnol Bioeng, 2006, 93(3): 424-433.
[27] CHOI M H, PARK Y H. Production of yeast biomass using waste Chinese cabbage[J]. Biomass Bioenergy, 2003, 25(2): 221-226.
[28] 王菊华. 蔬菜废物高温厌氧发酵产沼气及微生物群落结构研究[D]. 昆明: 云南师范大学, 2020.
Study on biogas production and microbial community structure by mixed thermophilic anaerobic fermentation of cabbage residue juice
LI Ruifan, CHEN Yubao, WANG JUhua, ZHUANG Shiyun, ZHANG Wenjie, HU Liangdong
(School of Energy and Environmental Science, Yunnan Normal University, Kunming 650500)
In order to explore the effect of mixed vegetable residue and vegetable juice on the potential of biogas production by anaerobic fermentation and to provide reasonable analysis and suggestions for the application of anaerobic fermentation engineering of mixed vegetable residue and juice. In this paper, the batch fermentation method was adopted which the mixture of Chinese cabbage residue and juice was selected as the reaction raw material. The mass fraction of substrate was 3% and the particle size of Chinese cabbage residue was 0.85 mm at high temperature (55±1) ℃. Among them, the TS degradation rate, VS degradation rate, the second daily gas production peak, the highest CH4content and the cumulative total gas production in the experimental group 3 (the amount of 331.66 mL inoculum with 68.34 g water of cabbage residue was 120 mL) were 56.13%, 61.06%, 525 mL, 66.19% and 3 390 mL, respectively, and the pH values before and after fermentation were 7.2 and 7.6, respectively, which were all in the normal pH range of methanogens and the results were better than those of other experimental groups. A small scale-up experiment of continuous stirring anaerobic fermentation to produce biogas was carried out in a 100 L fermentor and the biological community structure was analyzed. It was found that at the class level, the archaea were mainly methanobacteria and methanogens. At the genus level, Campylobacter thermophilus is the main methanogenic bacteria in the reactor (55%-81% of the total bacteria), and methanosarcina is the second dominant methanogenic bacteria (16%-42% of the total bacteria). In the process of continuous stirring, methane is mainly produced by methanosarcina using CO2and H2through the reduction of CO2methanogenic pathway and acetic acid methanogenic pathway, that is,
thermophilic condition; anaerobic fermentation; cabbage residue juice; biogas; microbial community structure
S216.4
A
1672-352X (2021)05-0822-07
methanosarcina plays a leading role in methane production in the continuous stirring experimental group.
10.13610/j.cnki.1672-352x.20211105.007
2021-11-9 8:45:09
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20211105.1128.014.html
2020-09-18
国家自然科学基金项目(21266032),国家国际科技合作专项(2015DFA60120),云南省基础研究计划重点项目(2019FA004)和云南省烟草化学重点实验室项目(2019539200340163)共同资助。
李睿帆,硕士研究生。E-mail:1131906019@qq.com
通信作者:陈玉保,博士,副教授,博士生导师。E-mail:c20072007@163.com
