2017—2019年CD (SD)大鼠240个SNP位点遗传检测结果分析
2021-12-04龙烟朦郑天威张巧稚苗向南尹良宏
龙烟朦 郑天威 张巧稚 苗向南 田 军 尹良宏 韩 雪
(北京维通利华实验动物技术有限公司,北京 100107)
CD(SD)大鼠(以下简称CD大鼠)作为常用封闭群品系之一,广泛用于毒理学[1-2]、老龄化研究[3]、肿瘤学[4-5]等领域研究数十年。动物实验的可重复性与数据的准确性取决于实验动物的遗传质量是否得到保证。然而随着时间的推移及地理上的隔离,在动物的繁育与饲养过程中,遗传漂变、近交繁殖等会导致动物种群基因,甚至表型(如:对化学药物的敏感性[6])发生变化,从而造成种群内遗传多样性流失,种群间产生较大的遗传差异[7]。为了解决上述问题并确保CD大鼠种群繁育稳定,1992年美国Charles River Laboratories(CRL)的专家们与群体遗传学家、营养学家、病理学家和药理学家共同商讨国际遗传学标准(International Genetics Standardization,IGS)种群管理方案,应用于全球不同国家各个设施CD大鼠种群,以保证各地生产群的基因分布(等位基因谱)更接近一致。同时,定期对核心群及全球各设施动物进行遗传监测,通过比较不同群体间的遗传差异来确保动物的遗传质量[8-9]。单核苷酸多态性(SNP)作为第三代遗传标记,因其具有携带信息量大、操作简单、敏感度高、结果可重复性强等优点而广泛用于生态学研究,现已用于大、小鼠的遗传质量检测[10-11]。维通利华一直按照IGS方案对CD大鼠进行管理以保证该封闭群的杂合度,并已连续三年参与CRL对全球多设施CD大鼠种群的遗传检测。本研究旨在对2017—2019年三次检测结果进行分析,对维通利华的CD大鼠种群内的遗传多样性及与美国基础群遗传分化程度进行评估。
1 材料和方法
1.1 样品的采集与处理
送检样本采集于SPF级CD大鼠,来自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。2017—2019年在各送检种群中,随机选取8只25 d龄以上的大鼠,雌雄各4只,采集耳样。其中,2017年送检1个种群(种群编码:CN01),2018年送检4个种群(种群编码:CN-1801、CN-1802、 CN-1803和CN-1804),2019年送检6个种群(种群编码:CN-1901、CN-1902、CN-1903、CN-1904、CN-1905和CN-1906),三年累计共检测11个种群,88个样品。使用75%乙醇对刀片进行消毒后,在每只个体耳朵外缘用刀片切取2~5 mm样品。样品放置在无菌8连管中,进行标记编号。采样结束后,将样品放置于-20 ℃暂存,后送至美国Charles River RADS实验室。使用QIAGEN柱式提取法提取耳样中的DNA。
1.2 基因型分型
在基因芯片(Taqman Open Array, ThermoFisher)上通过终点荧光PCR对240个SNP位点进行基因分型。每个位点上的两个等位基因由一对互补的寡核苷酸Taqman荧光探针并标记,其一使用荧光染色剂VIC,另一使用FAM标记。之后,用Quant Studio 12 K Flex 实时荧光PCR仪测量VIC和FAM信号,并分析这些反应。使用TaqMan Genotyper软件(V1.3, ThermoFisher)收集SNP分型为纯合子(VV或FF)或杂合子(VF)的数量。NC代表该基因型未被收集,通常是由于扩增量太少造成。
1.3 数据分析
对2018—2019年维通利华群体SNP基因型进行卡方检验(χ2),验证群体是否处于哈迪-温伯格平衡。使用GenA1Ex 6.5 群体遗传学分析软件对SNP基因分型结果进行处理和分析,并计算出位点多态性(P)、观测杂合度(Ho)、期望杂合度(HE)、近交系数(F)和遗传分化系数(FST)[12-13],通过比较以上指标来评估维通利华CD大鼠种群的遗传杂合度以及与美国CD大鼠基础种群间的遗传差异。
2 结果
除去若干SNP纯合位点和1个SNP位点偏离哈迪-温伯格平衡,维通利华2018—2019年送检的群体在其余分别有效的188和184个SNP位点均符合哈迪-温伯格平衡(HWE-P<0.05)。
2.1 2017年检测结果
2017年送检中国屏障房间、美国Wilmington基础群(US-FNDTN)等共7个亚群52只CD大鼠耳样。如表1所示:240个SNP位点中,除15个与X染色体相关的位点及5个无法精确测定而被剔除的位点,剩余220个SNP,检出率在99.8%~100%。维通利华送检亚群CN-1701,SNP位点回收率分别为:雄性100%,雌性99.8%。P为73.6%,Ho为0.29,HE为0.28,F为-0.02。中国各亚群与美国基础群(US-FNDTN)的遗传分化系数(FST)为0.056。
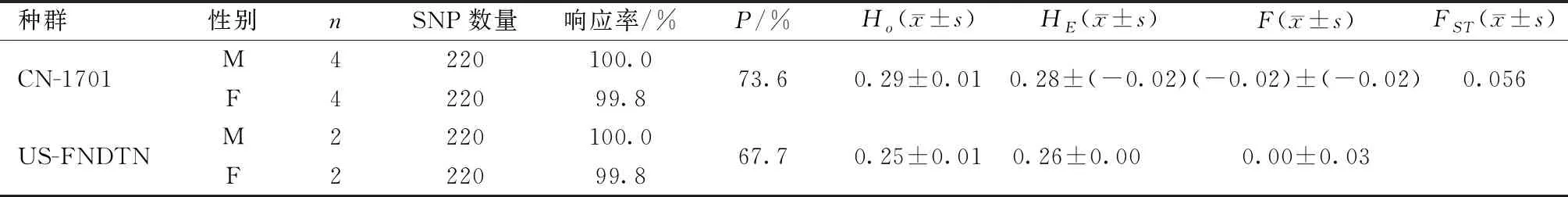
表1 2017年Crl: CD大鼠240个SNP位点检测结果
2.2 2018年检测结果
2018年送检中国的屏障亚群、美国Wilmington基础群(US-FNDTN)等共15个亚群144只CD大鼠耳样,其中送检4个亚群(CN-1801、CN-1802、CN-1803和CN-1804),如表2所示:240个SNP位点中,除15个与X染色体相关的位点和5个无法精确测定而被剔除的位点,剩余220个SNP位点,回收率达到99.8%~100%。US-FNDTN种群有84%表现多样性,维通利华亚群的P在73.3%~79.6%。F为0.11,中国送检群的F范围在-0.08~0。中国各亚群与美国基础群的FST在 0.027~0.039。
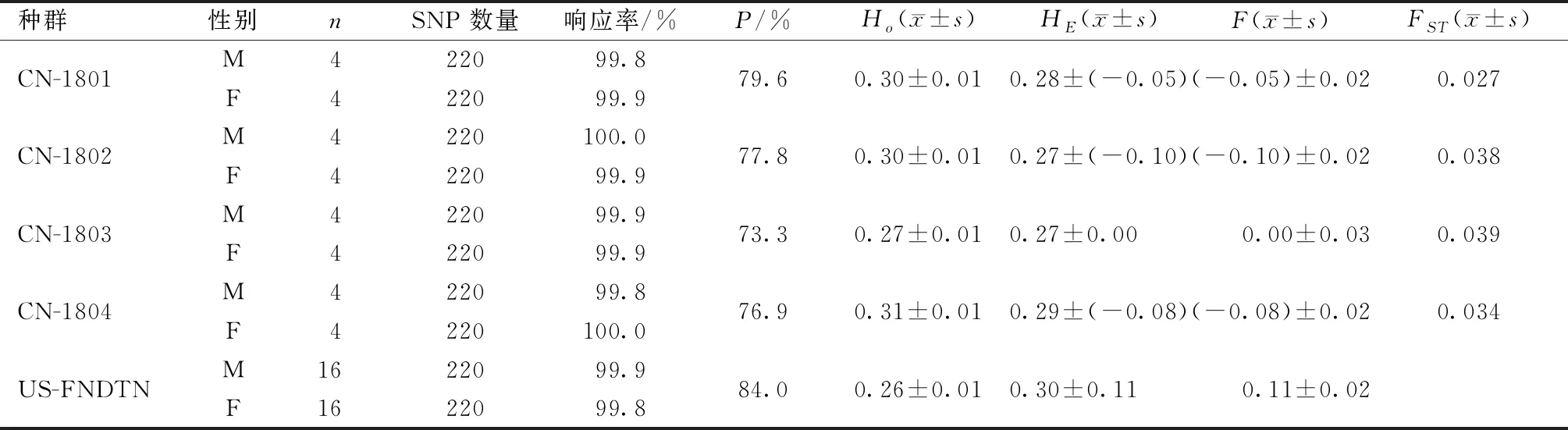
表2 2018年Crl: CD大鼠240个SNP位点检测结果
2.3 2019年检测结果
2019年送检中国亚群、美国Wilmington基础群(US-FNDTN)等共21个种群196只CD大鼠耳样,其中维通利华送检6个亚群(CN-1901、CN-1902、CN-1903、 CN-1904、CN-1905和CN-1906)。如表3所示:240个SNP位点,除15个与X染色体相关的位点和5个不能准确测量的位点之外,剩余220个位点,收集率99.1%~100%。美国基础群的P为84.5%,中国种群的P为71.5%~75.9%。美国基础群的F为0.12,中国亚群的在-0.14~0.03。中国各亚群与美国基础群的FST在0.029~0.046。
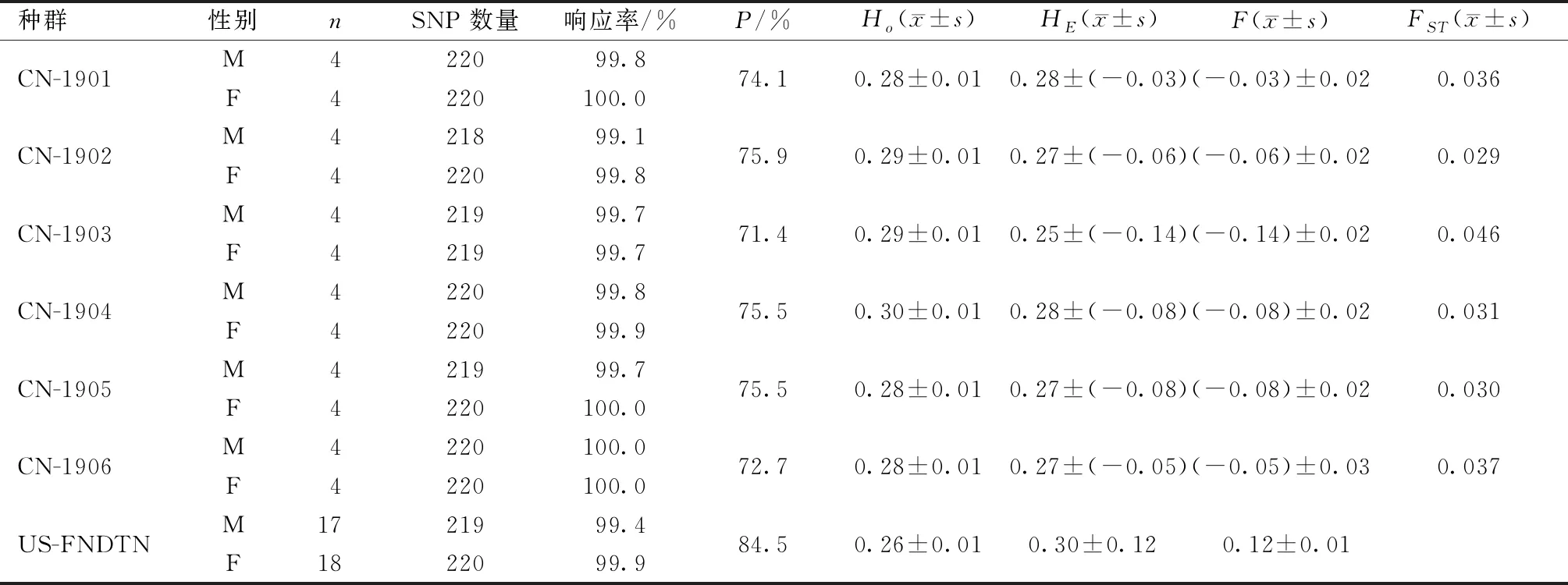
表3 2019年Crl: CD大鼠240个SNP位点检测结果
3 讨论
P是位点表现为多态性的比例,是评估种群内基因多样性的指标。数值越高,说明杂合度越高,种群内遗传变异程度越大。2017—2019年维通利华送检种群的P平均值为73.6%,76.9%和74.2%。数据显示CRL各种群内具有高度的基因多样性并保持稳定。

根据Wright等[15]报道FST可以反映种群间遗传分化程度,FST<0.05表示种群间分化程度很小,FST在0.05~0.15表示种群间存在中度遗传分化差异,FST>0.25则分化程度很大。由结果可知, 2017—2019年维通利华种群与美国基础群的FST在0.05上下波动,有5%左右的遗传变异是种群间差异导致,95%源自种群内部的遗传多样性,遗传分化程度呈低至中等。这说明定期从基础群引种及更新种群,有利于持续保持与基础群,以及其他种群的遗传分化程度符合要求。
作为封闭群动物,CD大鼠种群的遗传变异和杂合度逐渐减小主要是因为:(1)遗传的瓶颈效应:种群的初始有效数量受限,导致基因多样性匮乏。加速近亲繁殖[9],并导致近交衰退,有害等位基因的纯合度增加,个体适应性越来越差;(2)抽样误差:对于后备种鼠的选择标准不统一[7],甚至饲养人员的经常变动或经验不足也会加大遗传差异[16],进一步放大瓶颈效应[9];(3)近亲繁殖,放大遗传漂变和基因突变的积累效应[17],加速基因多样性的流失。
维通利华沿用CRL对封闭群动物使用的IGS标准,采取多种管理措施来限制近交繁殖和控制种群遗传差异,并定期检测种群多态性,对群体间相似性和群体内的异质性做出分析和评估,并调整种群管理和生产的细节[9],以减少对动物遗传质量的影响。
上述连续三年的送检结果表明:通过严格执行IGS标准对维通利华CD大鼠种群进行管理,种群符合随机交配繁殖,种群内遗传多样性丰富且保持稳定,与CRL美国基础群呈小~中等程度的遗传分化,其良好的遗传质量有助于动物实验结果的可靠性和可重复性。定期送检与美国核心群CD大鼠种群进行对比,对于评估种群稳定有重要意义。从结果来看,近三年主要关注中国种群与美国核心群的对比,本地同一群体不同年份的比较未涉及,后续将会对同一群体进行更多比对工作,进行针对性的研究。
