超声辅助复合酶法提取莓茶多糖的工艺优化
2021-12-04王晓慧姚茂君陈怡君朱露怡黄湘宇
王晓慧 - 姚茂君 - 陈怡君 - 朱露怡 - 黄湘宇 -
(1. 吉首大学林产化工湖南省重点实验室,湖南 张家界 427000;2. 吉首大学食品科学研究所,湖南 吉首 416000)
莓茶,又名藤茶、龙须茶、白茶等,为葡萄科蛇葡萄属植物显齿蛇葡萄[Ampelopsisgrossedentata(Hand.-Mazz.)W.T.Wamg]的茎叶。其富含多糖、多酚和黄酮等多种活性成分[1],具有清热解毒、利湿消肿、平肝降压等作用[2]。
植物多糖一般分布于细胞壁(或细胞)内,传统的提取技术主要集中于热水提取[3]、超声波辅助提取[4]、微波辅助提取[5]、酶法提取[6]、超临界萃取[7]等。其中,热水提取所需温度高且效率低,高温通常容易导致多糖结构发生改变;单纯的超声辅助提取能有效提高提取效率,但提取时间长易造成多糖降解[8];酶法提取虽兼具反应条件温和、得率高、节约时间等特点,且能较好地保留多糖生理活性[9],但是酶的价格昂贵,单纯采用酶法进行提取成本较高。采用超声波辅助复合酶提取多糖不但可以提高提取效率还可以节约成本,提高得率,该方法已被应用于甘草酸[10]、大蒜多糖[11]和金钱草多糖[12]的提取,但尚未见采用超声辅助复合酶对莓茶多糖进行提取的报道。
研究拟以莓茶为原料,采用超声波辅助复合酶法提取莓茶多糖,通过单因素试验研究各因素对提取莓茶多糖的影响,利用Plackett-Bueman(PB)试验、最陡爬坡试验和Box-Behnken试验优化莓茶多糖的提取工艺条件,以期为莓茶多糖的开发和利用提供理论依据。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
莓茶:产地湖南省永顺县,干燥粉碎成粉末后,过60目筛备用;
纤维素酶、果胶酶:≥15 000 U/g,国药集团化学试剂有限公司;
葡萄糖、无水乙醇、浓硫酸、柠檬酸、柠檬酸钠、苯酚、石油醚(60~90 ℃):分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
鼓风干燥箱:GZX-9246MBE型,上海博讯实业有限公司医疗设备厂;
紫外可见—分光光度计:UV-2450型,日本岛津公司;
多用途恒温超声波提取机:TF-650CT型,上海拓纷机械设备有限公司;
电子天平:FA224型,上海舜宇恒平科学仪器有限公司。
1.2 方法
1.2.1 预处理 取干燥的莓茶用超微粉碎机进行粉碎,过60目筛于50 ℃干燥至恒重。依次用石油醚、95%的乙醇进行洗涤,以去除色素及小分子杂质。再于50 ℃烘箱中干燥至恒重,过60目筛后,于干燥器中保存备用。
1.2.2 莓茶多糖的提取 称取2.0 g莓茶粉,以柠檬酸和柠檬酸钠缓冲液为提取溶剂,先进行超声波处理再进行酶解(经预试验,确定酶解温度为50 ℃,酶解时间为2 h,m果胶酶∶m纤维素酶为1∶1),依据试验所需提取条件设定相应的超声波和酶解参数进行提取。提取结束后,于5 000 r/min 离心15 min,取上清液进行抽滤。浓缩至原体积的1/5,加入无水乙醇至乙醇量为80%,4 ℃下静置8 h,于5 000 r/min离心10 min,取其沉淀复溶,于50 ℃烘箱中挥发掉乙醇后于1 000 mL容量瓶中定容,测定莓茶多糖含量并计算其得率。
1.2.3 莓茶多糖含量的测定及其得率计算 采用硫酸—苯酚法测量莓茶提取液中多糖的含量。标准曲线绘制:精确称取葡萄糖20 mg,用蒸馏水溶解后定容于200 mL容量瓶中,配制质量浓度为0.1 mg/mL葡萄糖标准母液,再将其稀释成0.01,0.02,0.04,0.06,0.08 mg/mL的葡萄糖标准溶液,取上述6个质量浓度标准溶液各1 mL于试管中,分别加入1 mL 5%的苯酚溶液,摇匀,迅速加入浓硫酸5 mL,摇匀,5 min后置于25 ℃的水浴锅中静置20 min 后于OD490 nm处测定其吸光度值,以蒸馏水为空白组,葡萄糖标准质量浓度C(μg/mL)为横坐标,吸光度值A为纵坐标。计算回归方程为A=0.009 47C-0.005 71,R2=0.998。用移液枪移取1.0 mL定容后的莓茶多糖液样品,测定吸光度A,用蒸馏水作为空白对照组,平行测定3次。多糖得率按式(1)计算:
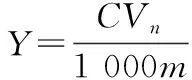
(1)
式中:
Y——多糖得率,%;
C——待测样品液中莓茶多糖质量浓度,mg/mL;
V——待测样品液体积,mL;
n——样品浓度稀释倍数;
m——莓茶多糖粉质量,g。
1.2.4 超声辅助复合酶提取单因素试验
(1) 超声波时间对莓茶多糖得率的影响:取2.0 g莓茶粉,溶解于pH为5.0的缓冲液中进行超声处理,超声波功率为104 W,超声波温度为50 ℃,添加复合酶质量1.00%,超声波时间分别设置为20,30,40,50,60 min进行提取。
(2) 超声波温度对莓茶多糖得率的影响:取2.0 g莓茶粉,溶解于pH为5.0的缓冲液中进行超声处理,超声波功率为104 W,超声波时间为40 min,添加复合酶1.00%。超声波温度分别设置为30,40,50,60,70 ℃进行提取。
(3) 酶解pH对莓茶多糖得率的影响:取2.0 g莓茶粉,溶解于pH分别为2,3,4,5,6的缓冲液中进行超声处理,超声波温度为50 ℃,添加复合酶1.00%,超声波时间为40 min,超声波功率为104 W进行提取。
(4) 超声波功率对莓茶多糖得率的影响:取2.0 g莓茶粉,溶解于pH为5.0的缓冲液中进行超声处理,超声波温度为50 ℃,添加复合酶1.00%,超声波时间为40 min,超声波功率分别设置为78,91,104,117,130 W(超声波提取机总功率为650 W,78,91,104,117,130 W分别对应其12%,14%,16%,18%,20%的输出功率)进行提取。
(5) 复合酶添加量对莓茶多糖得率的影响:取2.0 g莓茶粉,溶解于pH为5.0的缓冲液中进行超声处理,超声波温度为50 ℃,超声波时间为40 min,超声波功率104 W,复合酶添加量0.10%,0.50%,1.00%,1.50%,1.90% 进行提取。
1.2.5 Plackett-Burman试验和最陡爬坡试验 在单因素试验基础上,利用Plackett-Burman试验,每个因素选取高(+1)、低(-1)2个水平,考察超声波温度、酶解pH、超声波时间、复合酶添加量、超声波功率5个因素对莓茶多糖提取得率的影响,筛选出影响显著的关键因素,得到一次拟合方程,进行爬坡方向和步长设计来确定各重要因素最佳中心点。
1.2.6 响应面优化试验 根据1.2.5的试验结果得出的显著性关键因素进行Box-Behnken设计,建立相应的数学回归模型,最后绘制等高线图和响应面图。
1.2.7 不同方法提取效果的比较
(1) 热水提取:参照1.2.2的方法在80 ℃的恒温水浴锅中进行提取,时间为2.5 h,不做超声提取和酶处理。
(2) 超声波提取:参照1.2.2的方法,超声提取后于水浴锅中放置2 h,不做复合酶处理。
(3) 复合酶提取:参照1.2.2的方法,在50 ℃恒温水浴锅中放置30 min后,酶解2 h,不做超声提取。
(4) 超声复合酶提取:参照1.2.2的方法,选取响应面优化试验得到的最佳条件进行试验。
1.3 数据处理
所有结果均以3次试验的平均值表示,数据分析用Design-Expert 8.0.6、Origin 9.0、Excel 2003软件进行试验设计及统计分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 超声波时间对莓茶多糖得率的影响 由图1可知,随着超声波时间延长,莓茶多糖得率随之上升,超声时间的延长能使莓茶与溶剂充分混合,超声波处理40 min 时莓茶多糖得率达到(5.94±0.06)%,之后莓茶多糖得率开始下降,可能是由于超声波处理时间过长导致莓茶多糖分子结构被破坏,得率下降[13]。
2.1.2 超声波温度对莓茶多糖得率的影响 由图2可知,随着超声波温度的上升多糖得率上升,当超声波温度为50 ℃时莓茶多糖得率达到(5.94±0.06)%,之后莓茶多糖得率开始下降,可能与超声波的空化效应和细胞壁的扩散作用有关。随着超声波温度的升高,表面张力和黏度降低,液体的蒸汽压力增加,溶质形成空化气泡,当超声波功率较低时,产生空化效应来加速细胞的破裂,随着温度的升高,空化形成的气泡的表面张力降低,蒸汽压强增加,细胞不易破坏,因此莓茶多糖得率开始下降[14]。

图1 超声波时间对莓茶多糖得率的影响
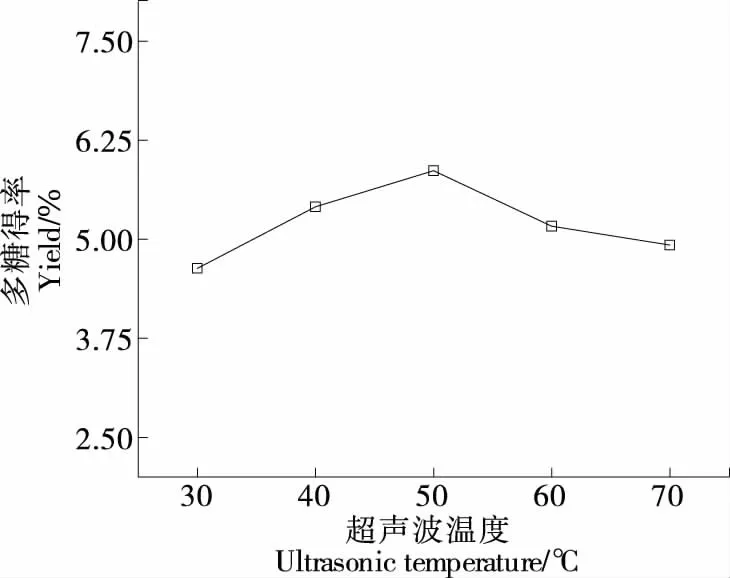
图2 超声波温度对莓茶多糖得率的影响
2.1.3 酶解pH对莓茶多糖得率的影响 由图3可知,随着酶解pH的增大莓茶多糖得率上升,当酶解pH为4时莓茶多糖得率达最大值(6.37±0.14)%,随后多糖得率开始下降。这可能是pH值会影响酶活性中心上必需基团的解离程度,从而影响酶分子与底物的结合与催化,最适的pH能够将酶分子与底物充分结合,进而使酶解反应达到最大[15]。
2.1.4 超声波功率对莓茶多糖得率的影响 由图4可知,莓茶多糖得率随着超声波功率的增大,先增加后下降,超声波功率为104 W时达到最大值(6.56±0.11)%,主要原因是对莓茶进行超声处理时,会产生空洞效应和振动作用,一开始植物细胞壁破碎,加快了莓茶多糖的溶出,但随着功率的增大,超声波空化效应增强并产生气泡,气泡中生成的自由基与莓茶多糖发生反应,使莓茶多糖被降解,得率下降[16]。
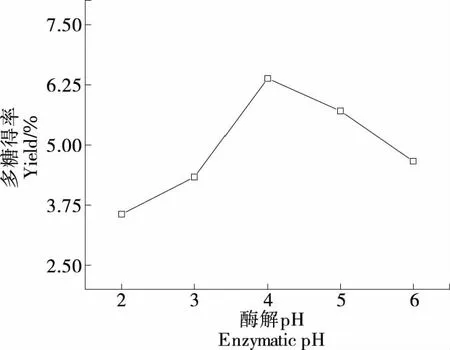
图3 酶解pH对莓茶多糖得率的影响
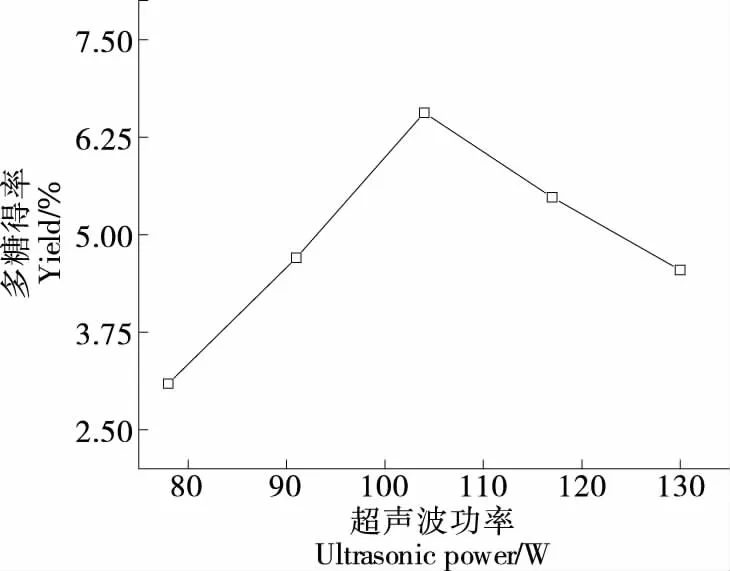
图4 超声波功率对莓茶多糖得率的影响
2.1.5 复合酶添加量对莓茶多糖得率的影响 由图5可知,随着复合酶添加量增加,莓茶多糖得率先增加,当复合酶添加量达到1.0%时莓茶多糖得率达到最大值(7.09±0.16)%,之后随着复合酶的添加,莓茶多糖得率开始下降。这可能是由于复合酶的增加加大了与底物接触的机会,释放出更多的多糖,当复合酶继续增加,两种酶之间出现竞争,抑制了酶的催化作用,导致莓茶多糖得率下降。
2.2 Plackett-Burman试验
在单因素试验基础上,利用Plackett-Burman试验设计考察超声波时间、超声波温度、酶解pH、超声波功率、复合酶添加量5个因素对莓茶多糖得率的影响,以这5个因素进行显著因素筛选,见表1。
各因素的效应评价及Plackett-Burman试验结果见表2、表3。
根据表2得到影响莓茶多糖得率的一次回归方程:
Y=4.88-0.046A1+0.062A2+0.36A3-0.20A4+0.19A5。
(2)
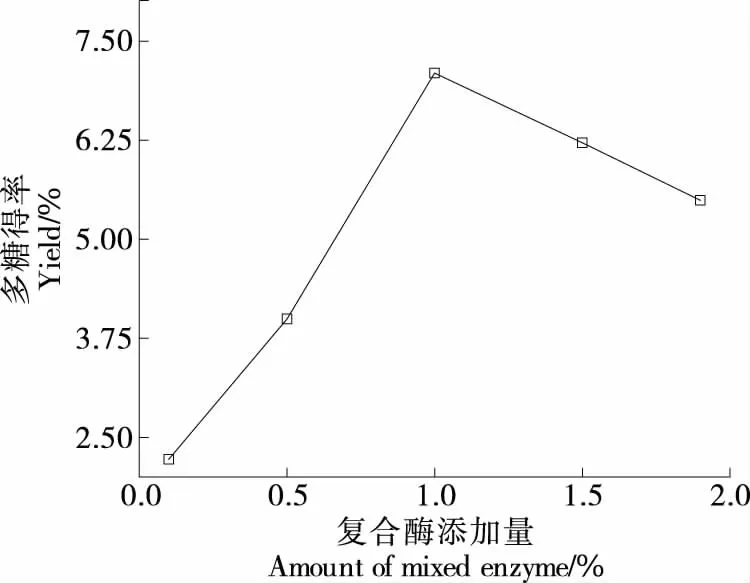
图5 复合酶添加量对莓茶多糖得率的影响
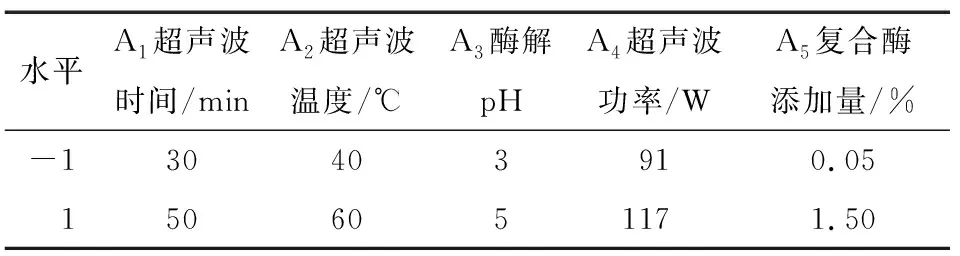
表1 Plackett-Burman试验因素及水平取值
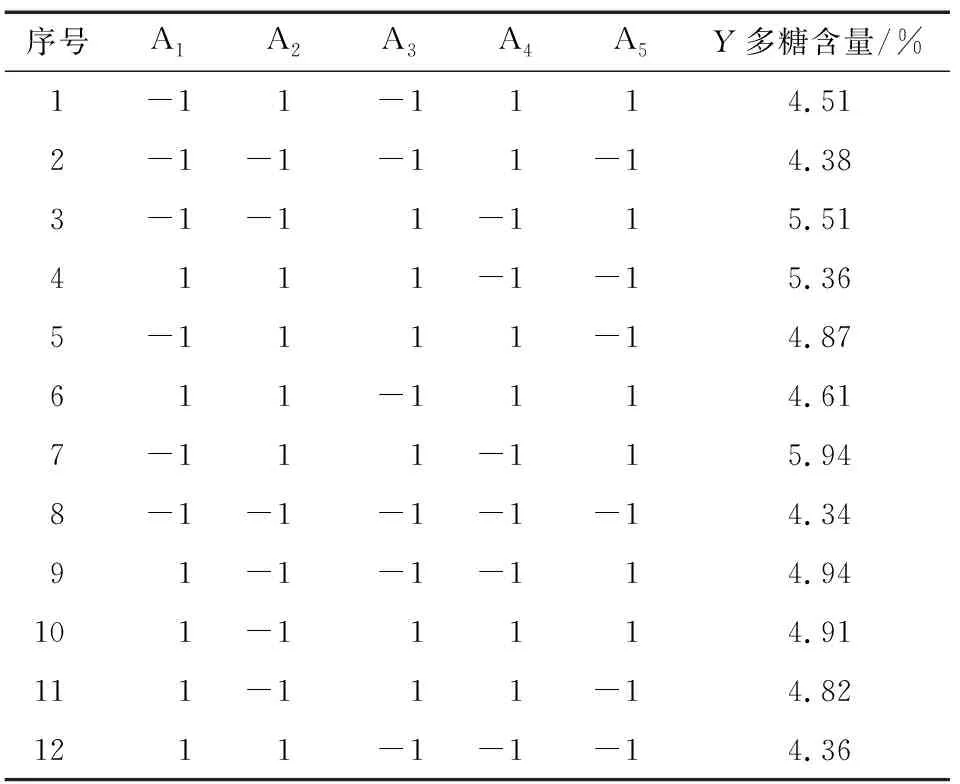
表2 Plackett-Burman 试验结果
2.3 最陡爬坡试验确定最佳中心点
根据超声波功率、复合酶添加量和酶解pH的系数设计爬坡方向和步长,其中超声波功率、复合酶添加量为正效应,取其高水平;酶解pH为负效应,取其低水平。
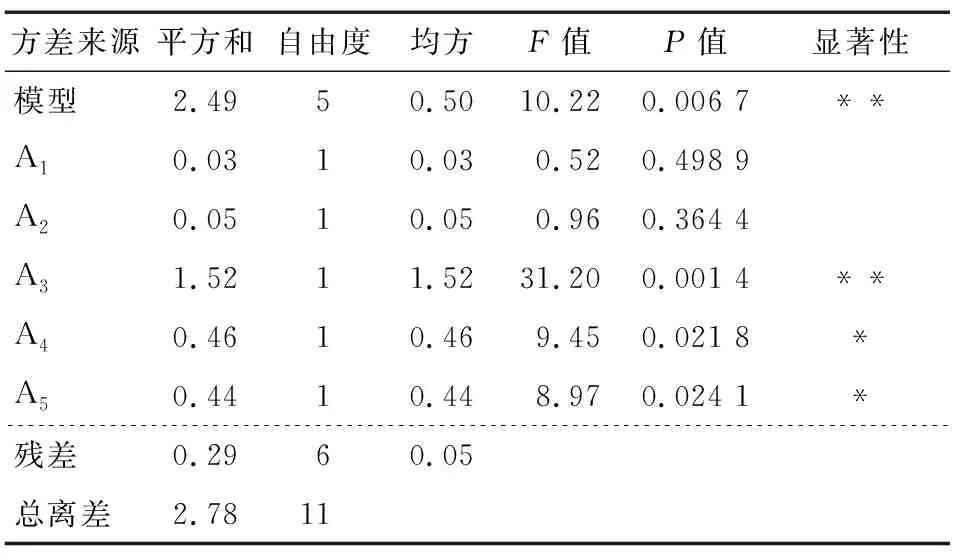
表3 Plackett-Burman试验方差分析†
由表4可知,在第3组处莓茶多糖得率达到最高,即第3组附近存在最优点,因此以酶解pH为4、超声波功率为104 W、复合酶添加量为1%为响应面的试验中心点进行优化。
2.4 Box-Behnken响应面优化分析
以酶解pH、超声波功率、复合酶添加量为自变量,莓茶多糖得率为响应值进行优化,莓茶多糖提取工艺响应面试验因素水平及结果分别见表5、表6。
通过多元回归方程拟合和方差分析得到方程:
(3)
表4 最陡爬坡试验结果
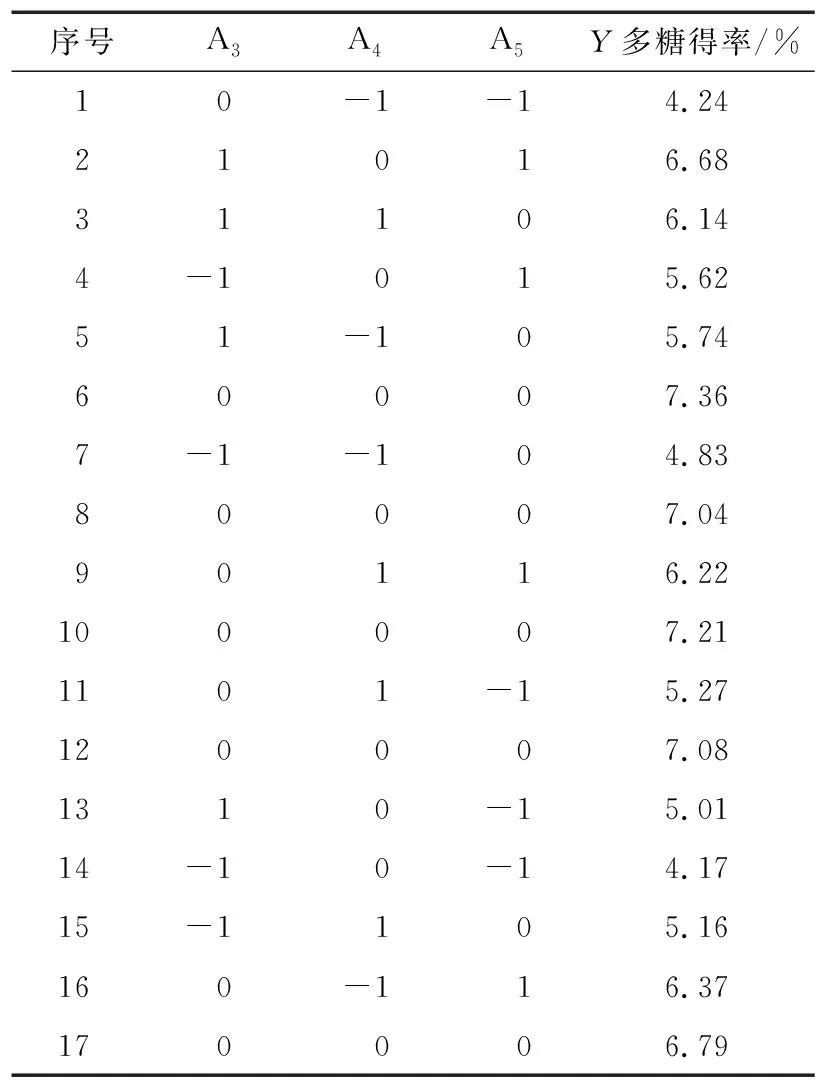
表5 Box-Behnken响应面试验结果
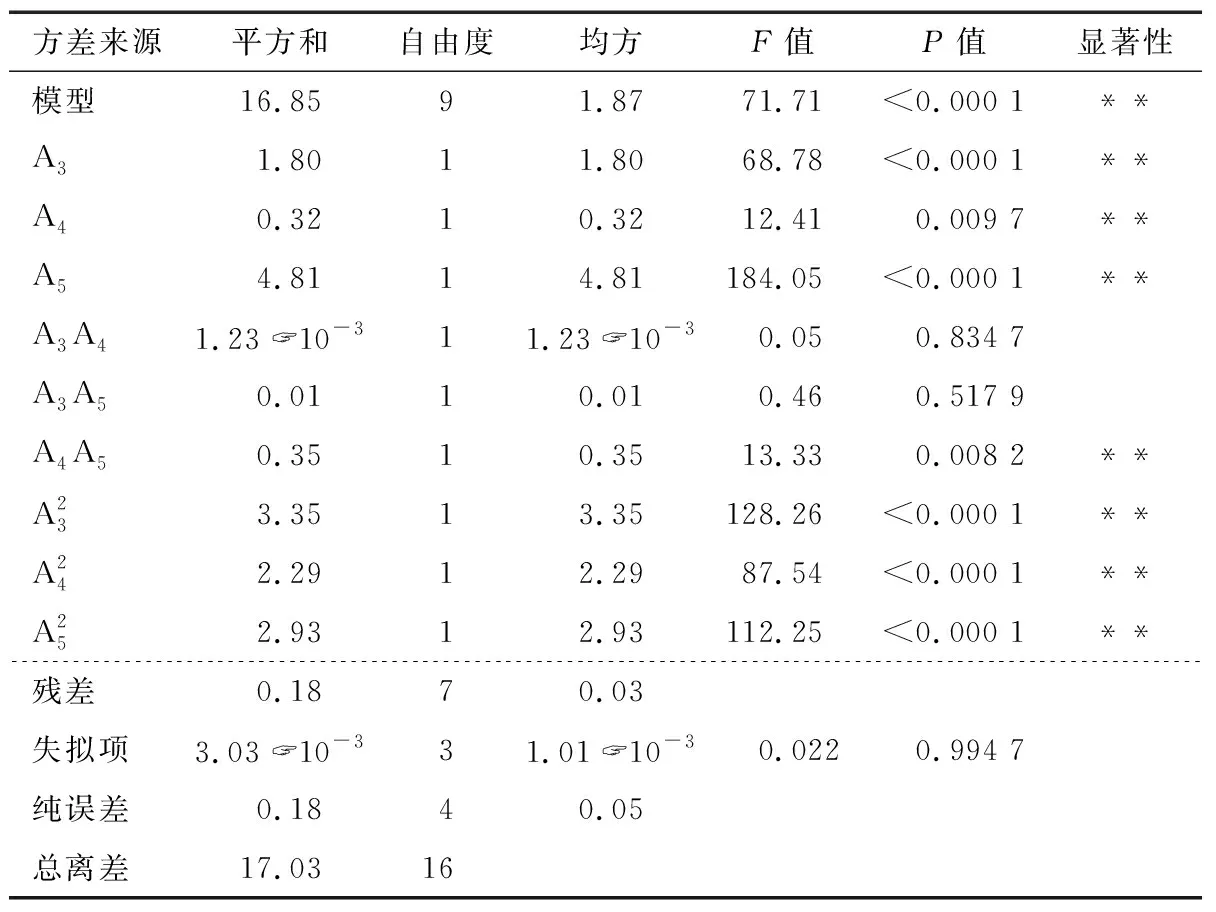
表6 回归模型方差分析及结果†
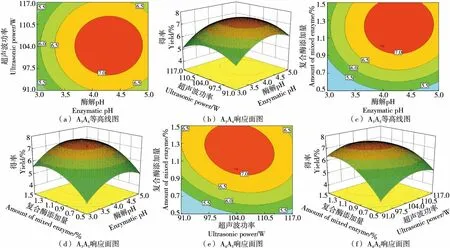
图6 两因素间交互作用响应面图Figure 6 Response surface plots of interaction between two factors
图6(a)和图6(b)显示复合酶添加量为0水平时,随着酶解pH值从3增加到5,超声波功率从91 W增加到117 W,莓茶多糖得率先上升后下降。图6(c)和图6(d)显示超声波功率为0水平时,莓茶多糖随酶解pH和复合酶添加量的增加呈先增加后降低的趋势。图6(e)和图6(f) 显示莓茶多糖含量随复合酶添加量和超声波功率的增加也呈先增加后降低的趋势。
对模型进行优化分析得出的最佳工艺为酶解pH 4.28,超声波功率104.59 W,复合酶添加量1.23%。为满足实际操作的可行性,对其最佳工艺条件进行修正,设定酶解pH 4.30,超声波功率104 W,复合酶添加量1.20%。通过3次平行实验验证其最佳工艺的准确性,测得莓茶多糖得率(7.22±0.06)%,与模型预测值(7.25%)基本吻合,说明该回归方程能够真实可靠地反映各因素对莓茶多糖得率的影响。
2.5 不同提取方法的比较
如图7所示,与热水提取、超声波提取和复合酶提取相比,超声辅助复合酶提取多糖得率提高了106.83%,86.35%,54.46%,4种方法之间存在显著性差异。超声波的机械作用和空化效应可有效地破坏原材料的细胞壁并加速分子运动,而复合酶可以使莓茶细胞壁降解加速且作用条件温和,将超声处理与复合酶结合,能够使得莓茶中的多糖更充分地释放出来,从而提高了提取效率。
3 结论
试验最终得到的超声辅助复合酶提取莓茶多糖的最佳工艺为:酶解pH 4.30,超声波功率104 W,复合酶添加量1.20%,超声波时间40 min,超声波温度50 ℃。超声辅助复合酶提取莓茶多糖工艺可以显著提高莓茶多糖得率,其得率为(7.22±0.06)%。与热水提取、超声波提取和酶法提取相比,超声波处理与复合酶结合能够较大程度地将多糖提取出来,提高提取效率。试验从多糖得率角度对莓茶多糖的超声辅助复合酶法提取工艺进行了优化,但未能对比其不同工艺提取出来的多糖结构和生理活性的差异,后续将对此进行深入研究。
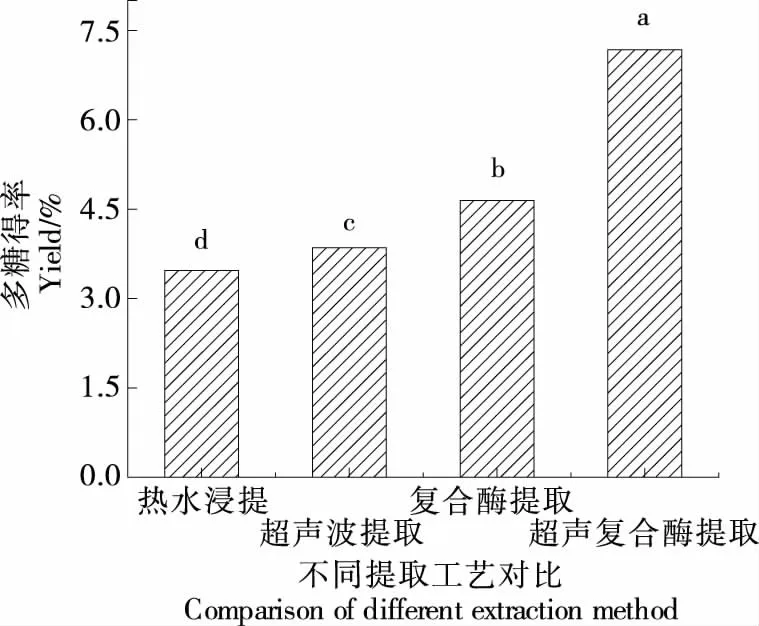
字母不同表示有显著性差异(P<0.05)图7 不同提取方法莓茶多糖得率比较
