芸豆/大豆复合发酵液代谢组分及功能性研究
2021-12-04李志芳佐兆杭
李志芳 - 佐兆杭 - 王 颖,2,3,4 ,2,3,4 张 裕 王 迪
(1. 黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2. 国家杂粮工程技术研究中心,黑龙江 大庆 163319;3. 粮食副产物加工与利用教育部工程研究中心,黑龙江 大庆 163319;4. 黑龙江省农产品加工与质量安全重点实验室,黑龙江 大庆 163319)
芸豆又名四季豆[1],在中国种植广泛,已成为栽培面积仅次于黄豆的豆类农作物[2]。芸豆中含有多种活性物质,如其特有的α-淀粉酶抑制剂可有效改善胰岛素抵抗并增强机体抗氧化能力[3-5];芸豆抗性淀粉可增加饱腹感为身体供能,减慢血糖上升速度,同时具有预防肠癌的作用[6-7]。大豆作为主粮之一,除能提供基本的营养元素外,还含有大豆异黄酮、潜在活性肽、多酚等多种功能性物质[8-10],综合价值较为全面。
豆类植物含有丰富的营养物质及多种功能性成分,经发酵后的植物原液含有丰富的次级代谢物、维生素、矿物质以及多种功效酶类、抗氧化物质、有机酸、香气成分等[11-12],能够满足消费者一次摄入补充多种营养的品质需求。目前市场上的发酵产品主要以果蔬类、小麦、大豆、米胚芽等植物原料为主,在原料的选择上存在单一性,以杂豆复配主粮形式制备的复合植物发酵液尚未有成形的研究成果,从膳食多样性的角度来说,复配形式的组合发酵是一种新的思路。试验拟将芸豆、大豆按比例进行共同发酵,主要研究复合植物发酵液在发酵过程中代谢产物及抗氧化活性的变化规律,初步探究复合发酵的优势所在,以期为豆基植物类发酵产品的开发提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
紫花芸豆:黑龙江垦区;
大豆、白砂糖:市售;
安琪牌活性干酵母:湖北安琪酵母股份有限公司;
植物乳杆菌(Lactobacillusplantarum):东北农业大学菌库;
嗜酸乳杆菌(Lactobacillusacidophilus):中国工业微生物菌种保藏中心;
耐高温α-淀粉酶(20 000 U/mL)、糖化酶(10 000 U/mL):上海源叶生物科技有限公司;
ABTS自由基测试试剂盒:南京建成生物工程研究所;
磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、福林酚(10%)、无水乙醇、碳酸钠、葡萄糖、氯化铁、3,5-二硝基水杨酸、亚硝酸钠、硝酸铝等:分析纯,辽宁泉瑞试剂有限公司。
1.1.2 主要仪器设备
料理机:JYL-Y912型,九阳股份有限公司;
pH计:S220型,瑞典波通仪器公司;
台式高速离心机:TG16-WS型,常州金胜仪器制造有限公司;
超净工作台:BCV-6S1型,浙江赛德仪器设备有限公司;
电热恒温培养箱:DRP-9082型,上海培因实验仪器有限公司;
紫外分光光度计:V-5100B型,上海元析仪器有限公司;
高温压力蒸汽灭菌器:YXQ-30SII型,济南捷岛分析仪器有限公司。
1.2 试验方法
1.2.1 工艺流程及操作要点
芸豆、大豆去皮清洗→打浆→液化→糖化→离心→灭菌→接种→发酵→后发酵
↑
酵母菌、乳酸菌
(1) 菌种活化:取体积分数为10%的液态保藏的植物乳杆菌和嗜酸乳杆菌菌液于MRS液体培养基中,37 ℃恒温培养24 h;活性干酵母于10倍体积蒸馏水中溶解,30~35 ℃水浴活化30 min。
(2) 清汁的发酵:芸豆、大豆清洗后去皮,按料液比(m芸豆和大豆∶V蒸馏水)1∶3 (g/mL)打浆。控制酶解条件:α-淀粉酶添加量200 μL/100 mL、pH 6.0、酶解温度97 ℃、时间20 min;糖化酶加酶量200 μL/100 mL、pH 4.5、温度60 ℃、时间30 min。浆液于10 000 r/min离心15 min。调清汁pH至5.0、装瓶量30 mL、糖添加量8%,灭菌。冷却后接种酵母菌,32 ℃恒温振荡24 h进行预发酵,按V植物乳杆菌∶V嗜酸乳杆菌为1∶1(共同发酵)接种植物乳杆菌和嗜酸乳杆菌,恒温发酵24 h。4 ℃后发酵并保藏备用。
1.2.2 pH值测定 使用精密pH计。
1.2.3 总酸含量测定 参照GB/T 12456—2008。
1.2.4 还原糖含量测定 采用3, 5-二硝基水杨酸比色法。
1.2.5 可溶性固形物含量测定 使用手持折光仪。
1.2.6 总酚含量测定 采用Folin-Ciocalteus法[13]。
1.2.7 黄酮含量测定 采用NaNO2-Al(NO3)3比色法[14]。
1.2.8 发酵过程中还原力测定 参照文献[15]。
1.2.9 发酵过程中ABTS自由基清除率测定 使用ABTS自由基试剂盒。
1.3 数据处理与统计分析
试验均进行3次重复操作,所有数据用x±s表示。采用Origin 8.0等软件对数据进行处理与分析。
2 结果与分析
2.1 pH值和总酸含量变化
由图1可知,发酵液pH随发酵时间的延长而不断降低,总酸含量则有所上升。发酵8~32 h,pH由3.83降至3.58,下降较明显,说明该阶段菌种产酸速率较快,至发酵结束pH稳定在3.55左右,总酸含量可达0.43 mg/mL。复合发酵过程中pH值和总酸的变化趋势与李璐等[16]的研究结果一致,可能是因为酵母菌在发酵初始阶段大量增殖,在氧气充足的情况下可通过糖酵解和三羧酸循环途径将发酵液中的糖类物质氧化成CO2和水,而当氧气缺乏时,酵母菌会利用葡萄糖大量合成乙醇及CO2,CO2溶于水产生弱酸性的碳酸使发酵液pH下降。此外,微生物消耗原料中的碳水化合物等营养物质并在相关酶的作用下可发酵产生乳酸、柠檬酸等有机酸,尤其当乳酸菌大量增殖成为优势菌种时可水解蛋白质形成游离氨基酸,能够进一步增加产酸量同时降低环境pH。发酵后期,由于代谢产物、pH值等因素抑制,菌种发酵逐步进入稳定期,此时pH值及总酸含量趋于稳定。
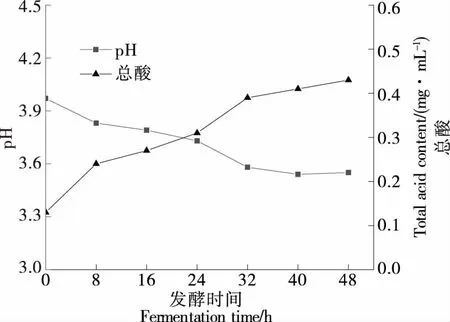
图1 发酵过程中pH值、总酸含量变化Figure 1 Changes in pH value and total acid contentduring fermentation
2.2 可溶性固形物含量变化
由图2可知,发酵过程中可溶性固形物含量随发酵时间的延长持续下降并趋于稳定,经48 h发酵后,发酵液中可溶性固形物含量由10.01%降低至5.73%。可溶性糖可为微生物生长繁殖提供稳定的碳源,由于清汁在液化及糖化阶段积累了丰富的可溶性糖使发酵初始阶段营养物质充足,微生物生长建立了优势菌群,生长繁殖快,因此可溶性固形物的利用速率快,前期可溶性固形物下降趋势较为明显[17-18]。发酵后期微生物生长状态趋于稳定,对可溶性糖的利用也随之趋于平缓。这与邢金金等[19]探究不同菌种发酵对酵蜜桃酵素可溶性固形物含量的变化趋势一致。
2.3 还原糖含量变化
经绘制葡萄糖标曲为y=2.422 1x-0.147 4,R2=0.996 1,换算得还原糖含量如图3所示。由图3可知,还原糖含量在发酵过程中呈先下降后保持波动平衡的状态。发酵初始阶段,酵母菌大量消化葡萄糖、果糖等还原糖用于自身生长繁殖,使基质中的还原糖含量迅速下降。接种乳酸菌后,发酵液中的葡萄糖、果糖等游离糖有利于其自身的增殖代谢,乳酸菌会分泌β-半乳糖苷酶等水解酶分解生成乳糖、葡萄糖和半乳糖,加上菌种发酵产生的淀粉酶能够将淀粉水解成还原糖[20],两者共同作用使发酵液中还原糖含量有所上升,但也存在糖酵解过程使葡萄糖分解转化为乳酸致使还原糖含量下降[21],因此后期发酵处于上下波动状态,还原糖含量维持在8.25 mg/mL附近。
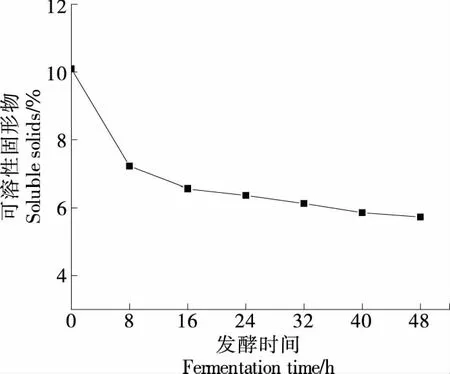
图2 可溶性固形物含量的变化Figure 2 Changes in soluble solids content
2.4 总酚含量变化
经绘制没食子酸(0~250 μg/mL)标曲回归方程为y=0.004 8x-0.015 7(R2=0.997 3)。由图4可知,总酚含量在发酵过程中先迅速上升,后稳定在430 mg/mL左右,与杨小幸等[22]研究苹果酵素天然发酵过程中总酚含量变化趋势相符。分析变化原因可能是:首先从原料角度分析,多酚含量与种皮颜色有一定的关联,王何柱等[23]研究表明:7种芸豆的总酚含量为0.91~4.96 mg/g,深色芸豆的总酚含量明显高于浅色芸豆;其次体系内酚类物质的释放与微生物作用相关,乳酸菌在发酵过程中,内源酶系作用会使豆类植物细胞中的结合态酚类物质游离出来[24],使其含量上升;此外发酵环境中的高糖浓度会升高体系渗透压,有利于酚类物质的溶出。发酵后期酚类含量略微下降,可能是部分生存能力较强的微生物逐渐适应总酚浓度较高的发酵液环境,利用酚类物质合成其他次级代谢产物从而导致总酚类物质含量略微下降[25-26]。
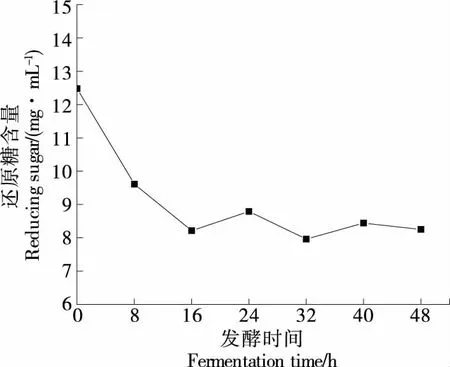
图3 还原糖含量变化Figure 3 Changes inreducing sugar content
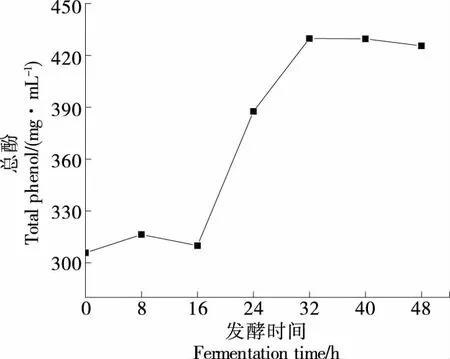
图4 总酚含量变化Figure 4 Changes in total phenol content
2.5 黄酮类物质含量变化
由图5可知,发酵过程中黄酮类物质呈先持续升高后趋于稳定的趋势,在发酵16~32 h增长最为迅速,分析可能存在的原因有:① 微生物发酵过程中,与不溶性纤维结合的黄酮类化合物被释放出来,使黄酮类物质含量有所上升。同时乳酸菌产生的β-葡萄糖苷酶可以将黄酮苷转化为黄酮苷元,导致黄酮苷元含量增加,此状态下的异黄酮更容易被吸收利用。有研究[27-28]表明,发酵后的豆制品中苷元形式的异黄酮含量显著增加,而糖苷型异黄酮则明显下降,说明发酵作用有利于增强大豆异黄酮的可吸收性及功能利用率。② 酵母菌在厌氧条件下生成乙醇,有利于黄酮类物质的溶解。③ 酵母菌及乳酸菌代谢产生的酶系作用能够将部分碳源物质转变为可以发生显色反应的邻苯二酚结构[29],使发酵液黄酮含量显著上升。
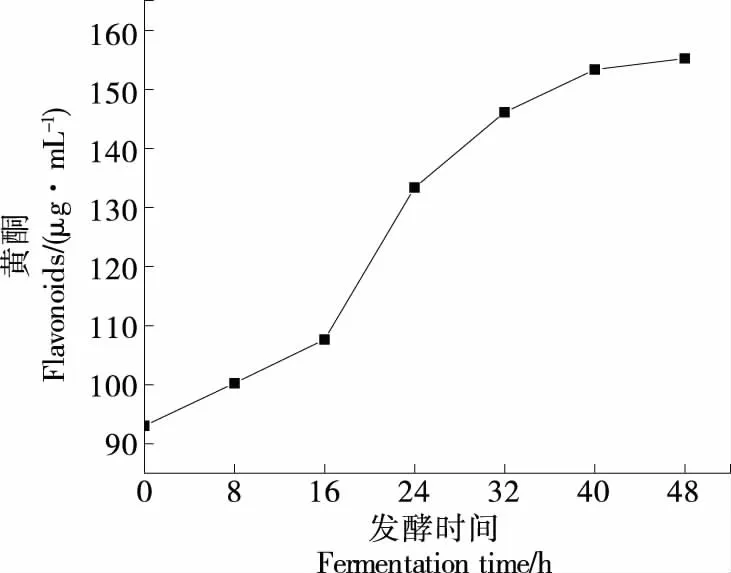
图5 黄酮类物质含量变化Figure 5 Changes in flavonoids content
2.6 还原力变化
由图6可知,还原力随发酵时间的延长不断上升,至发酵结束还原力可达0.608,相较于未接种益生菌时,其还原力提升了2倍左右,与范昊安等[30]在研究苹果梨酵素发酵过程中的还原力变化趋势相一致。这可能是除酵母菌的细胞壁多糖具有一定的抗氧化能力外,乳酸菌的自身代谢产物及其菌体表面同样有抗氧化物质存在[31],并且这两种菌均可通过产生NADH氧化酶、超氧化物歧化酶(SOD)、GSH-Px等过氧化酶类物质清除体内活性氧[32]。
2.7 ABTS自由基清除能力变化
由图7可知,发酵16~32 h时ABTS自由基清除能力显著提高,至发酵结束时ABTS清除能力可达3.404 mmol/L,相比发酵前提升了85.6%。这可能是随发酵时间的延长,代谢产生的小分子酚酸类物质增多,而酚羟基具有供氢体活性,在氧化过程中可以作为主要的还原部位与自由基反应,使其自身形成的自由基得以稳定,从而阻断自由基链的反应,以此来增强体系抗氧化物能力。
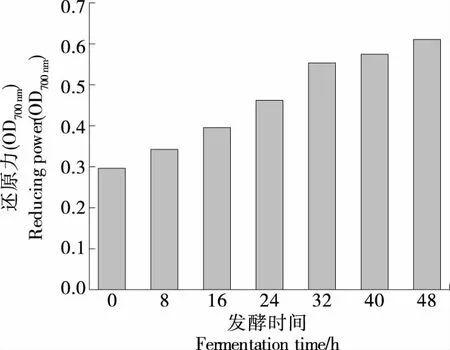
图6 发酵过程中还原力的变化Figure 6 Changes in reducing power duringfermentation
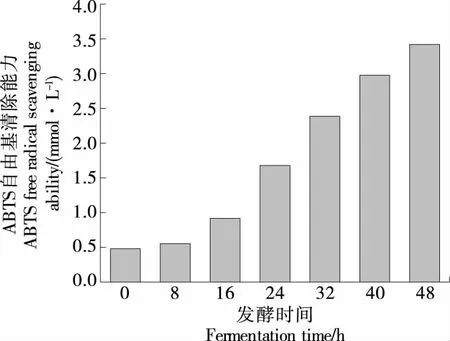
图7 发酵过程中ABTS自由基清除能力的变化Figure 7 Changes of ABTS free radical scavengingability during fermentation
3 结论
试验探究了芸豆、大豆复合发酵液发酵过程中代谢产物及抗氧化活性的变化情况,结果表明,各理化指标随发酵时间的延长存在一定的规律性:pH值呈持续下降的趋势,总酸含量变化趋势与之相反;发酵过程中还原糖含量先小幅度上升后处于动态稳定,发酵48 h时可溶性固形物稳定至5.73%;总酚和黄酮类物质含量总体呈上升趋势,至发酵结束趋于稳定;发酵过程中还原力及ABTS自由基清除能力逐步增强并于发酵结束时达到最大值。以上规律可清晰地反映复合发酵过程中相关理化指标变化趋势及功能性物质的累积情况,说明酵母菌及乳酸菌的协同发酵作用有利于芸豆及大豆中活性物质的释放,并可有效提升发酵液的抗氧化能力。由于时间及条件的限制,对复合发酵液其他功能的挖掘还存在一定的局限。复合发酵液的菌群调节作用能够抑制肠道致病菌的定植并重塑肠道微生物物种构成,可在一定程度上防止脂肪及糖代谢异常诱发的2型糖尿病,其降糖机理的深度探究对扩大产品受益人群具有一定的价值,而更多的功能性开发还需要不断的深入研究。
