肝细胞衰老表达与细粒棘球蚴感染肝纤维化研究
2021-12-04廖原邢稚坤王二强许军英贺飞明刘颖颖吴向未陈雪玲
廖原,邢稚坤,王二强,许军英,贺飞明,刘颖颖,吴向未,陈雪玲*
(1 石河子大学医学院,新疆 石河子 832002;2 石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832008)
棘球蚴病(echinococcosis),又称包虫病(hydatid disease),是由棘球蚴绦虫的幼虫(原头蚴)引起的一种人兽共患病[1],主要由细粒棘球蚴绦虫引起的囊型包虫病和由多房棘球蚴绦虫引起的泡型包虫病,通常寄生在肝脏和肺部[2]。由棘球蚴引起的棘球蚴病是我国西北高原地区最主要的传染病之一[3]。
囊型棘球蚴病可引起炎性病变和纤维化[4]。肝纤维化是机体对慢性肝损伤的一种修复反应,它有可能发展成肝硬化,如果不加以预防,它可能会导致肝癌和肝衰竭,肝星状细胞(HSCs)的激活是肝纤维化的核心事件[5]。因此预防和治疗肝脏纤维化至关重要,探究肝纤维化相关机制为今后的纤维化治疗提供理论基础。
衰老肝细胞也能介导肝星状细胞的活化[6],细胞衰老意味着细胞周期进入稳定停滞状态,衰老细胞虽然具有代谢能力,但无法继续增殖,其通过分泌炎性因子等方式促进细胞外基质蛋白过度分泌,参与多种纤维化疾病的发生发展。细胞衰老并不是单一的标志,主要是多种标志的结合,如形态学变化,细胞周期抑制剂的表达,衰老相关的半乳糖苷酶活性变化等。细胞衰老是由于溶酶体活性的改变而引起的,与细胞衰老的标志物β-半乳糖苷酶(SA-β-Gal)的表达有关。当一个器官的细胞衰老时,整个机体都会受到影响。这可能通过衰老相关分泌表型(SASP)引起[7]。据报道,衰老的肝细胞也表达p53(TRP53)[8]。因此本研究通过检测细粒棘球蚴感染肝细胞衰老标记p53和β-半乳糖苷酶的变化,探讨肝细胞衰老在细粒棘球蚴感染肝纤维化过程中的作用。
1 资料与方法
1.1 资料
收集4例囊型肝包虫病患者病灶及3例血管瘤患者手术中病灶远端切除的肝脏组织标本,分别作为包虫病组和对照组,标本均来源于新疆石河子大学医学院第一附属医院住院手术患者,本研究过程均遵循伦理委员会关于人体实验的相关伦理学标准,且已取得患者知情同意,批件号2019-126-01。
1.2 实验动物
6~8周龄雌性C57BL/6小鼠30只,体重18~22 g,购买自新疆医科大学动物实验中心,研究期间光照周期12 h,温度(27±2)℃,所有小鼠正常饮食和活动,本实验已通过石河子大学医学院第一附属医院实验动物伦理福利审查。
1.3 动物模型的建立
病羊肝脏购买于新疆昌吉屠宰场。用75%乙醇消毒后,用50 mL注射器提取囊泡中含头节的囊液,待囊液自然沉淀后去除上清液,剩余的沉淀物用含有1%青霉素和链霉素的PBS清洗,洗好的头节中加入完全培养基,充分混匀,在37 ℃和5%CO2的培养箱中连续培养。用伊红染色后在显微镜下鉴定原头节活性,活性≥90%的头节用于造模。将小鼠随机分为正常对照组(n=15)和细粒棘球蚴感染组(n=15),感染组小鼠麻醉后直接开腹肝穿刺,于最大肝叶直接注射5000只头节,关腹缝合。对照组小鼠做开腹手术,肝被膜下注射0.1 mLPBS,关腹缝合。两组小鼠均普通饮食喂养。
1.4 实验试剂和仪器
RPMI-1640、1×PBS购自美国Gibco公司;胎牛血清购自以色列BI公司;青链霉素混合液、HE染色试剂盒、天狼猩红染色试剂盒、β-半乳糖苷酶染色试剂盒购自上海Solarbio公司;小鼠单克隆抗体p53购自美国Abcam公司;通用型试剂盒(PV-6000)、DAB显色试剂盒购自北京Zsbio公司。二氧化碳细胞培养箱购自美国Thermo Fisher Scientific公司,切片机购自德国Leica公司,显微镜购自日本Olympus公司。
1.5 检测方法
1.5.1 HE染色
将患者肝组织在4%中性甲醛溶液中固定24 h,脱水包埋后切片干燥备检。于造模15、30、60、90 d后,颈椎脱臼法处死小鼠,取小鼠肝组织置于4%中性甲醛溶液中固定24 h,脱水包埋后切片干燥备检。将切片脱蜡脱水后,依次在苏木素染液中染色5 min,用盐酸酒精分化后,在伊红染液中染色1 min,水洗后脱水透明封片,显微镜下观察肝组织病理形态学特征。
1.5.2 天狼猩红染色
将石蜡切片经过二甲苯脱蜡,梯度酒精脱水之后,天狼猩红饱和苦味酸染色1 h,水洗后苏木素染色5 min,脱水,透明,封片,显微镜下观察肝组织纤维化程度。
1.5.3 β-半乳糖苷酶染色
将新鲜肝脏组织在4%的多聚甲醛中固定4 h,然后放置在染色盒中,加入β-半乳糖苷酶染色液,37 ℃摇床,慢速摇晃24 h,然后将组织进行石蜡包埋,切片机切片,烤片后二甲苯脱蜡,梯度酒精脱水,用含有0.2%冰醋酸的伊红染液染色2 min,脱水,透明,封片,显微镜下观察肝细胞中β-半乳糖苷酶活性。
1.5.4 免疫组化染色
将石蜡切片二甲苯脱蜡,梯度酒精脱水,放入pH6.0柠檬酸盐缓冲液中煮沸10 min,进行抗原修复,温度自然下降到60 ℃左右,取出玻片。用含5%BSA的TBS溶液配成20%的山羊血清,室温封闭1 h,滴加稀释充分的一抗p53抗体置于湿盒中4 ℃过夜,用含0.025%的TritonX-100的TBS溶液中洗涤玻片3次,3% H2O2室温孵育10 min,阻断内源性过氧化物酶,每张切片滴加50 μL HRP标记二抗,室温避光孵育1 h,用含0.025%的TritonX-100的TBS溶液清洗玻片,DAB显色出现褐色后,立即放入水中终止反应,加苏木素复染细胞核5 min,分化液分化30 s,蒸馏水浸泡15 min,脱水,透明,封片。显微镜下观察阳性表达区域。
2 结果
2.1 肝包虫患者感染灶近端肝脏纤维组织和衰老细胞增加
HE染色结果显示对照组患者肝脏肝小叶结构完整,显示正常的肝组织形态结构(图1A),包虫病组病灶周围有大量淋巴细胞浸润,正常肝脏组织形态严重破坏(图1B)。天狼猩红染色显示对照组患者肝脏偶见胶原纤维沉积(图1C),包虫病组病灶周围有大量致密的胶原纤维组织存在(图1D),表明细粒棘球蚴肝纤维化形成,提示肝脏抗纤维化的治疗也是包虫病治疗的重要方面。在细粒棘球蚴感染过程中,可观察到衰老细胞的标志,例如β-半乳糖苷酶活性和p53表达增加。相比于对照组,包虫病组肝脏中β-半乳糖苷酶活性增强(图1F),p53呈棕色大量表达(图1H),与肝脏纤维化程度相一致。因此,探究细粒棘球蚴感染肝纤维化的机制尤为重要。
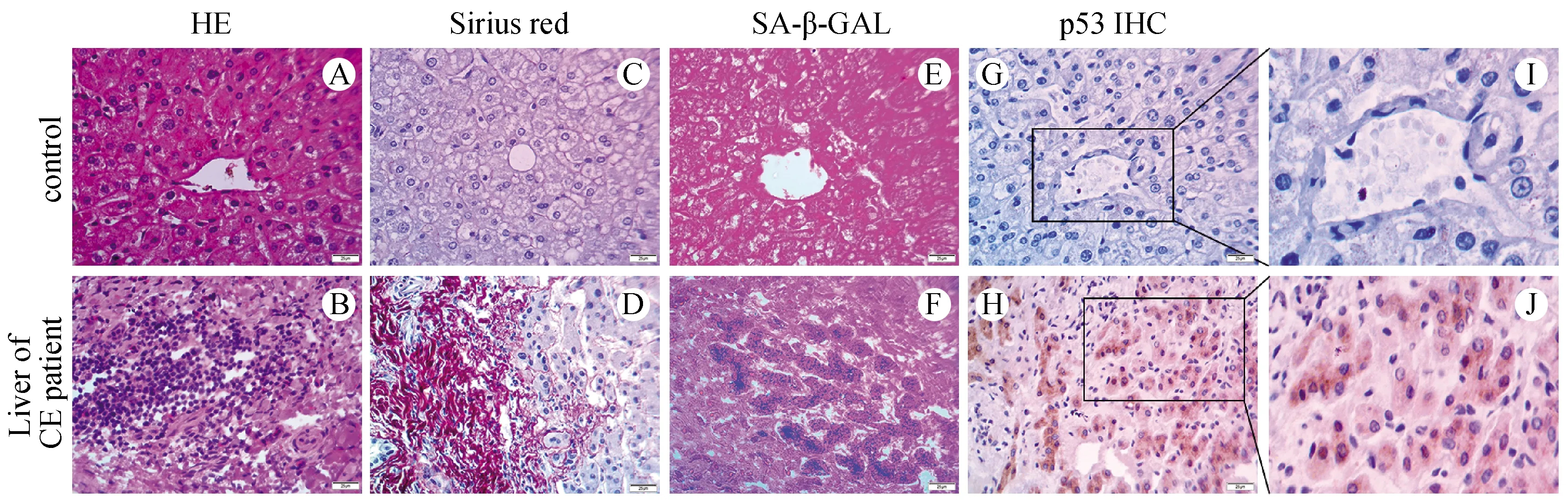
A:对照组肝组织HE染色;B:包虫病组肝组织HE染色;C:对照组肝组织天狼猩红染色;D:包虫病组肝组织天狼猩红染色;E:对照组肝组织β-半乳糖苷酶染色;F:包虫病组肝组织β-半乳糖苷酶染色;G:对照组肝组织p53免疫组化染色;H:包虫病组肝组织p53免疫组化染色;I:对照组肝组织p53免疫组化局部放大图;J:包虫病组肝组织p53免疫组化局部放大图。
2.2 小鼠感染病灶周围炎性细胞浸润
HE染色可见对照组小鼠肝细胞排列规则,无炎性细胞浸润(图2)。
感染后15 d可在囊泡内见原头节,周围大量炎性细胞浸润,炎性带增宽(图2B)。感染后30 d也可见大量炎性细胞浸润,逐渐向囊周聚集,炎性带更宽(图2D)。感染后60 d可见囊内形成空泡,生发层形成,周围仍有炎性带浸润(图2F)。感染后90 d可见炎性带变得更加致密(图2H)。
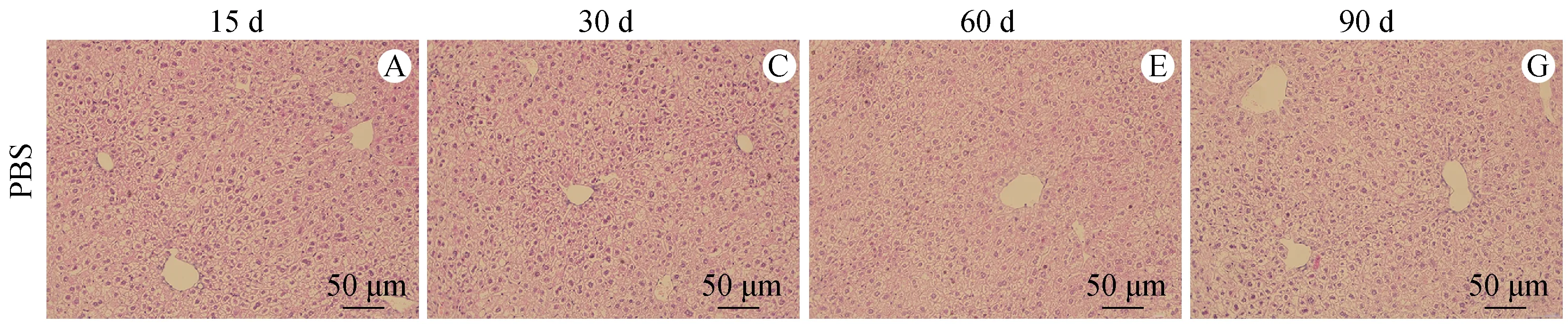
A、C、E、G:正常对照组小鼠肝组织各时期HE染色;B、D、F、H:细粒棘球蚴感染组小鼠肝组织各时期HE染色。
2.3 小鼠感染病灶周围胶原纤维组织增多
天狼猩红染色显示对照组小鼠肝脏偶见红染组织存在(图3),感染15 d可见病灶周围有大量疏松的纤维组织形成,向囊泡周围聚集(图3B),感染30 d时胶原纤维组织与炎性带交替存在(图3D),第60 d时纤维组织增多并且有致密化的趋势(图3F),第90 d纤维组织变得更加致密化,包绕在囊泡周围(图3H)。因此,在细粒棘球蚴感染过程中,胶原纤维持续存在,探究细粒棘球蚴感染肝纤维化的机制显得尤为重要。
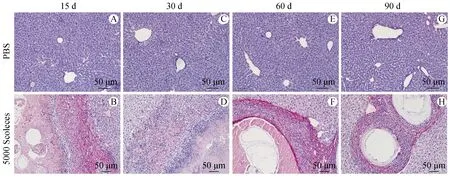
A、C、E、G:正常对照组小鼠肝组织各时期天狼猩红染色;B、D、F、H:细粒棘球蚴感染组小鼠肝组织各时期天狼猩红染色。
2.4 小鼠感染病灶周围β-半乳糖苷酶活性增加
在细粒棘球蚴感染过程中,可以观察到衰老细胞的标志β-半乳糖苷酶活性增加,反映在细粒棘球蚴感染期间有大量肝细胞发生衰老。
β-半乳糖苷酶染色显示对照组小鼠肝脏偶见衰老肝细胞的存在(图4),感染15 d时可见呈蓝色表达β-半乳糖苷酶的细胞较少(图4B),随着感染时间的延长,可见感染30 d时表达β-半乳糖苷酶的细胞越来越多(图4D),感染60 d时有大量衰老细胞存在(图4F),且感染90 d可见阳性区域越来越密集(图4H),肝细胞衰老变化与肝纤维化程度相一致,提示两者之间有密切联系。
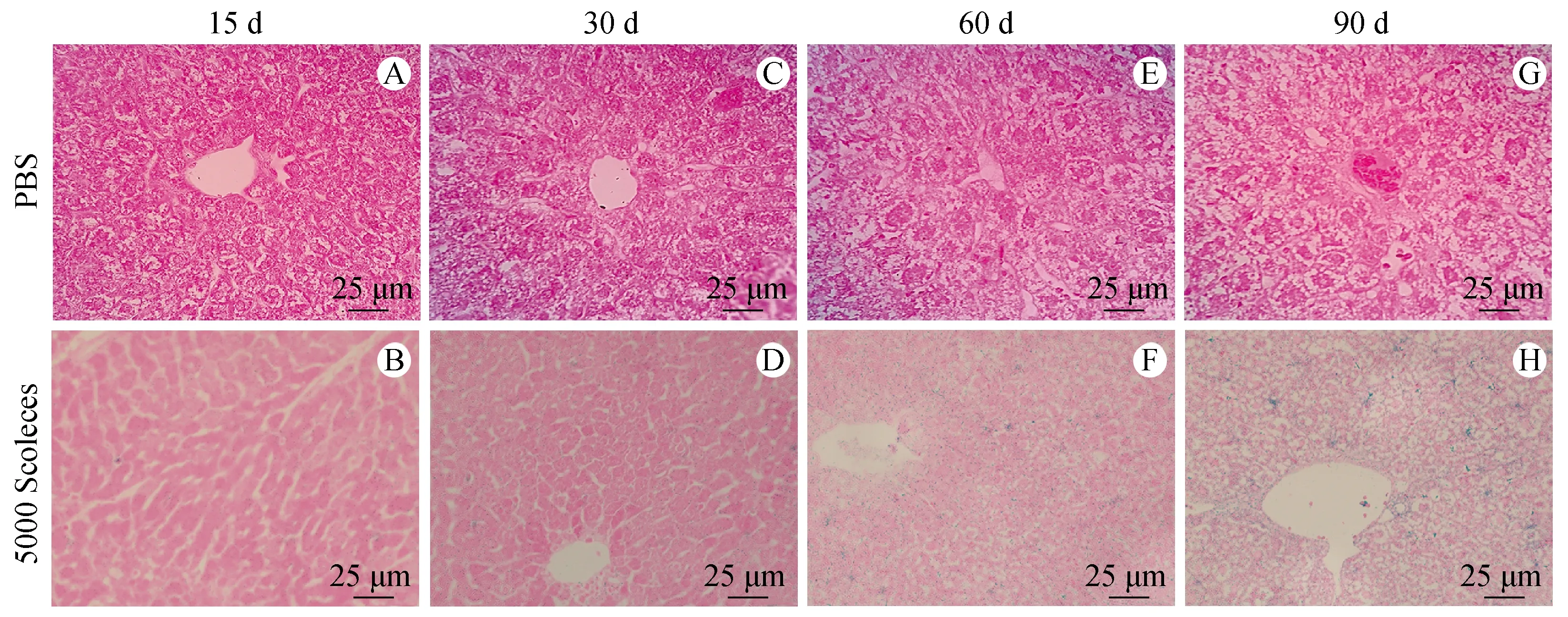
A、C、E、G:正常对照组小鼠肝组织各时期β-半乳糖苷酶染色;B、D、F、H:细粒棘球蚴感染组小鼠肝组织各时期β-半乳糖苷酶染色。
3 讨论
细粒棘球蚴感染在人体中以囊肿的形式出现,最常见于肝脏[9]。包虫囊从内向外由囊液、生发层、角质层和外膜组成[10],细粒棘球蚴感染可导致肝细胞损伤,进而引起肝细胞的病理性变化和炎症细胞在受损的肝脏中积聚,炎症细胞激活并释放大量细胞因子,肝脏的持续炎症将导致肝成纤维细胞活化、分化和增殖,随后出现肝纤维化[11]。肝纤维化严重影响肝脏功能,进一步发展可导致肝硬化甚至肝衰竭和肝癌。因此,早期预防和治疗肝纤维化有重要意义。在我们的研究中发现,细粒棘球蚴感染的肝脏中结构紊乱,有大量胶原纤维组织存在,因此探讨纤维化形成机制尤为重要。
衰老肝细胞的特征包括DNA损伤和衰老相关表型(SASP)的激活[12-13]。SASP介导IL-1α和TGF-β的表达[14],TGF-β介导和维持衰老细胞表型[15]。体外研究表明,TGF-β可促进SASP相关细胞因子的分泌,促进肝细胞的衰老[16]。诱导细胞衰老主要通过两条途径:一条是部分依赖端粒的p53-p21信号通路[17],另一条是不依赖端粒功能的p16信号通路[18]。肝细胞的炎症坏死是肝纤维化的启动和促进因素。衰老的肝细胞可激活HSC等其他类型的细胞导致肝纤维化的加剧[19]。肝细胞衰老后转变为衰老相关分泌表型(SASP),分泌多种炎症因子,如IL-6[20],其可通过“衰老传染”引起其他细胞的衰老,使肝脏内环境发生改变,进而通过反馈调节机制,促进其他肝细胞启动衰老[21],从而促进更多的衰老肝细胞参与肝纤维化的发展过程。
通过研究[22]发现,小鼠肝细胞特异性缺失编码Mdm2的基因(一种促进p53降解的蛋白质),导致肝细胞合成结缔组织生长因子(CTGF;肝纤维化主开关),增加肝细胞凋亡和自发性肝纤维化;同时去除p53可完全消除这种表型。与野生型对照组相比,肝细胞特异性p53缺失的小鼠表现出相似的肝细胞凋亡水平,但肝纤维化和肝CTGF表达降低。p53通过抑制miR-17-92上调人肝癌细胞系CTGF的表达,人类肝脏样本也显示CTGF和p53调节的基因表达之间存在相关性,两者在纤维化肝脏中的表达均增加。因此揭示p53诱导CTGF表达并促进肝纤维化,提示p53/CTGF通路可能是治疗肝纤维化的一个靶点。
体外实验证实IL-10可通过抑制细胞增殖、诱导细胞周期阻滞、提高SA-β-Gal活性、增强衰老标志蛋白p53和p21的表达,从而诱导活化HSCs的衰老。p53特异性抑制剂Pifithrin-α可抑制IL-10升高的SA-β-Gal活性及p53和p21在活化HSCs中的表达。IL-10还增加了总的和磷酸化的信号转导和转录激活子3(STAT3)的表达,并促进了磷酸化STAT3从细胞质到细胞核的易位[23],证实IL-10可以通过STAT3-p53途径诱导活化的HSC衰老,从而减轻CCl4诱导的大鼠肝纤维化。表明细胞衰老不止局限于肝细胞,还可发生在肝星状细胞中。因此通过有针对性地促进相应细胞的衰老,对于改善相关模型的纤维化程度至关重要。
本研究发现,与对照组相比,感染组患者肝脏组织结构紊乱,胶原纤维组织增多,同时伴随着衰老肝细胞的存在,p53和β-半乳糖苷酶高表达。通过建立细粒棘球蚴小鼠肝脏感染模型,对肝脏进行染色,发现小鼠感染灶周围胶原纤维组织增加,伴随着衰老肝细胞的增多,提示细粒棘球蚴肝纤维化与肝细胞衰老有关。患者与造模小鼠肝组织染色均表明肝纤维化与细胞衰老同时存在,两者相互影响。但具体是由衰老促进纤维化,还是纤维化促进衰老并没有直接证据,因此下一步研究重点在于分析肝细胞衰老与纤维化之间的具体作用机制,为肝包虫病相关的纤维化治疗提供更好的研究基础。
