含铁肠杆菌素受体调节蛋白VPA0148 对副溶血弧菌毒力的影响
2021-12-04朱馨媛刘敏黄颖赵哲
朱馨媛, 刘敏, 黄颖, 赵哲
河海大学海洋学院海洋生物系, 江苏 南京 210098
副溶血弧菌(Vibrio parahaemolyticus)是一种嗜盐性革兰氏阴性菌, 广泛分布于海洋环境中, 能够引发多种水产养殖动物的疾病(Soto-Rodriguez et al,2015)。副溶血弧菌同样能引发人类感染, 食用受副溶血弧菌污染且烹调不当的水产品会引发急性肠胃炎, 伤口暴露于存在副溶血弧菌的环境中会引起伤口感染, 严重时会引发败血症, 导致死亡(Li et al,2019)。在正常水生环境中, 副溶血弧菌的多数毒力因子不表达, 当病菌进入宿主或受到其他外源刺激时, 才会激活相应调控通路, 从而激活毒力因子表达(Ceccarelli et al, 2013)。
铁是氧的载体和电子传递的催化剂, 是微生物生长所必需的微量元素。铁不足会抑制微生物生长、定殖等重要的生理活动(León-Sicairos et al, 2015;Payne et al, 2016)。由于宿主体内可利用的游离铁稀少, 微生物进化出从宿主体内获取铁的生理机制,这一过程往往伴随着细菌对宿主的毒力作用(Payne,1993; Abu Kwaik et al, 2013; Brophy et al, 2015; Leó n-Sicairos et al, 2015)。铁离子浓度作为一种信号,控制着微生物的基因表达和调控, 其中包括多种铁代谢通路蛋白、毒力因子, 以及毒力调控蛋白(Davies et al, 2011; Mey et al, 2005b; Payne et al,2016)。针对环境中难溶的铁化合物, 细菌还能通过自身分泌或利用其他菌分泌的载体蛋白, 获得铁元素(Raymond et al, 2003; Miethke et al, 2007)。相关研究表明, 外源铁能够增强副溶血弧菌对宿主的致病力, 其主要原因是补充铁元素能够促进病菌的增殖(León-Sicairos et al, 2015)。
细菌的运动能力与致病能力紧密相关, 能够影响其在不同环境中的定殖、表面接触和生物膜的形成(Belas, 2014; Van Laar et al, 2018)。副溶血弧菌拥有双鞭毛系统, 其中周生鞭毛使弧菌能够进行群集运动(McCarter et al, 1990), 从而逃避宿主免疫系统的清除作用, 影响其迁移、黏附和在感染部位的分布(Kearns, 2010)。生物膜是微生物及其胞外产物在生物或非生物表面形成的混合物。包裹在生物膜中的细菌受到环境的影响变小, 其耐药性、抗逆性增强, 生物生产力和相互作用提高(Muhammad et al,2020)。副溶血弧菌的运动能力和生物膜形成均受到环境中铁离子浓度的影响。研究发现, 低铁条件能够促进副溶血弧菌群集运动的活性和周生鞭毛相关基因的表达(McCarter et al, 1989; Gode-Potratz et al,2010; Morabe et al, 2020), 抑制生物膜的形成(Payne et al, 2016)。当存在外界铁载体蛋白时, 副溶血弧菌的生长和生物膜形成均受到抑制(Zhang et al, 2016),这暗示外源铁载体蛋白可能对菌株毒力产生影响。因此, 与铁代谢相关的转录调节因子可能调控群集运动活性和生物膜的形成。目前, 外界铁离子浓度对群集运动和生物膜形成的调控机制仍不清楚, 需要进一步研究。
副溶血弧菌除了能表达弧菌素, 还能利用外源产气菌素(Funahashi et al, 2003)、 高铁色素(Funahashi et al, 2009)、肠杆菌素(Tanabe et al, 2012)等铁载体中的铁元素, 以满足自身生长需求。Tanabe等(2014) 发现副溶血弧菌VPA0150编码了含铁肠杆菌素受体 PeuA, 其上游存在双组分系统VPA0148-VPA0149 使VPA0150在特定位点发生转录, 从而表达出具有活性的受体蛋白。VPA0148 是含铁肠杆菌素受体调节蛋白, 该蛋白的基因VPA0148与下游组氨酸激酶基因VPA0149形成一个操纵子, 在碱性且低铁条件下发生共转录(Tanabe et al, 2014)。同时,VPA0148-VPA0149可能受Fur(Ferric uptake regulation)系统调节转录(Tanabe et al, 2014),推测VPA0148 可能参与了副溶血弧菌的毒力调控。本研究中, 通过敲除副溶血弧菌RIMD2210633 的VPA0148, 并检测缺失株生长、生物膜形成、群集运动以及斑马鱼致死率等表型的变化, 发现了含铁肠杆菌素受体调节蛋白VPA0148 具有负调控副溶血弧菌毒力的作用, 结果进一步支撑了铁调节副溶血弧菌毒力的分子机制。
1 材料与方法
1.1 菌株、质粒和培养条件
本研究所采用菌株和质粒已列于表1。液体培养基使用Luria-Bertani(LB)培养基和心浸液培养基(Bacto™ Heart Infusion Broth), 琼脂培养基中额外添加15g·L-1琼脂粉(上海生工)。本研究中普通培养基为未添加螯合剂的培养基, 低铁培养基为添加了100μmol·L-12,2′-联吡啶(2,2′-dipyridy, 上海生工)的普通培养基。抗生素的使用浓度为卡那霉素50μg·mL-1, 氯霉素(大肠杆菌)25μg·mL-1, 氯霉素(副溶血弧菌)5μg·mL-1。

表1 本研究中使用的菌株和质粒Tab. 1 Strains and plasmids
1.2 基因缺失和回补株构建
VPA0148基因敲除采用同源重组的方式进行,引物详见表2。用引物d0148-1F/1R 和d0148-2F/2R通过PCR 分别扩增出VPA0148上下游DNA 片段,并通过二次扩增, 利用引物d0148-1R、d0148-2F 中的同源臂序列, 将上下游片段相连、得到VPA0148缺失后的DNA 片段。该片段及载体质粒经内切酶XhoI、SacI(Takara)酶切后, 用T4 连接酶(Thermo Fisher)连接, 重组质粒转化到E. coliS17-1λpir菌株中。回补质粒中的目的片段使用引物p0148-F/R 扩增, 使用One Step Cloning Kit(南京诺维赞)将该片段通过同源臂重组到自杀质粒pDM4 上, 并将重组产物转化到E. coliS17-1λpir菌株中。通过S17-1λpir的接合作用, 将质粒转移到目标弧菌内, 在含有5μg·mL-1氯霉素的平板上筛选出携带质粒的弧菌菌株, 并利用载体引物通过PCR 验证质粒存在。基因敲除需要进一步在含有蔗糖的培养基中筛选成功缺失基因VPA0148的菌株, 用引物RT0148-F/R 进行PCR 验证; 并在含氯霉素的平板上验证基因缺失的菌株不含自杀质粒。

表2 本研究中所使用的引物Tab. 2 Primers in this research
1.3 生长曲线测定
本实验在含有1% NaCl 的心浸液培养基中进行。副溶血弧菌经过夜活化后, 在高铁或低铁的心浸液培养基中37℃培养2h。调菌液浓度相等后, 1%接种到高铁或低铁的心浸液培养基中并分装到培养板, 每孔400μL 菌液, 用Bioscreen 全自动生长曲线测定仪测定24h 生长曲线, 37℃振荡培养, 每小时检测一次。
1.4 斑马鱼死亡率检测
实验步骤参考之前的研究(Kinkel et al, 2010)。选用 AB 系野生型 6~9 月龄斑马鱼, 养殖于含0.06g·L-1NaCl 的去离子水中, 实验前禁食24h。过夜培养的菌株 1%接种活化并将培养基更换为0.75%生理盐水, 调浓度为5×107cfu·mL-1。斑马鱼腹腔注射使用微量注射器进行, 每尾注射10μL, 每10尾鱼一组, 注射后每4h 或8h 观察一次, 持续观察48h。对照组每尾鱼注射10μL 0.75%生理盐水。实验重复3 次。
1.5 生物膜生成量检测
实验步骤参考之前的研究(O'Toole et al, 1998)。将过夜活化的菌株1%接种于含1% NaCl 的心浸液培养基中, 分装于96 孔板中, 37℃, 100r·min-1培养24h。弃液相, 用1×Phosphate-buffered saline(PBS,0.01mol·L-1, pH 7.2~7.4, Bio-Channel)轻柔洗去各孔中菌液后, 吸净液体, 用0.1% (wt/vol)结晶紫在室温下染色30min。染色完成后弃染液, 用1×PBS 洗净残余染料, 再加入 200μL 乙醇, 室温下反应30min。检测各孔在595nm 下的吸光值。
1.6 群集运动能力检测
群集运动检测方法参考之前的研究(Gode-Potratz et al, 2010)。将2μL 普通心浸液培养基中过夜培养的饱和菌液, 滴在含有100μmol·L-12,2’-联吡啶的心浸液-琼脂平板上, 置于30℃培养12h, 测量其扩散范围的大小。每个样重复3 次, 每次实验至少重复3 次。
1.7 荧光定量PCR 分析VPA0148 的转录水平
在含3% NaCl 的LB 培养基、含1%和3% NaCl的心浸液培养基中, 1%接种过夜活化的野生型菌株,37℃培养至对数生长期。通过向上述培养基中加入铁离子特异性螯合剂2,2′-联吡啶(2,2′-dipyridyl)创造低铁环境。将对数生长期的菌液离心, 用相应的低铁培养基重悬菌体, 继续在37℃培养40min。
取培养完成的菌液离心后弃培养基, 用 1mL TRIzol®溶液(Thermo Fisher)溶解并加入200μL 氯仿,振荡混匀并于冰上放置10min 后, 12000×g、4℃离心15min。取500μL 清与等体积异丙醇混合, 冰上放置5min 后12000×g、4℃离心10min, 弃液相。用1mL 70%乙醇洗沉淀一次, 得到RNA 粗提物并溶解。去除RNA 粗体物中的DNA, 使用逆转录试剂盒(Takara)反应得到cDNA。
荧光定量PCR 使用rpoA为内参, 以cDNA 为模板, 采用 10μL 反应体系(5μL AceQ Universal SYBR qPCR Master Mix; 4μL ddH2O; 正反引物各0.25μL, 终浓度为2.5μmol·L-1; 0.5μL cDNA)在罗氏LightCycler96 实时荧光定量PCR 仪中进行。数据以2-Δ(ΔCT)法进行相对定量分析, 采用SPSS22 软件、双边T 检验分析数据是否具有显著差异性。
2 结果
2.1 VPA0148 对副溶血弧菌毒力的影响
通过斑马鱼腹腔注射实验, 探究VPA0148 对副溶血弧菌斑马鱼致死能力的影响。结果显示:VPA0148缺失株(ΔVPA0148)表现出比野生型菌株(WT)更高的生物致死率和致死速度(图1)。

图1 VPA0148 对副溶血弧菌致斑马鱼死亡能力的影响使用不同菌株对斑马鱼进行腹腔注射后, 每4h 或8h 观察死亡情况。WT: 副溶血弧菌RIMD 2210633 野生型菌株; ΔVPA0148: VPA0148缺失株; ΔVPA0148::pVPA0148: VPA0148 缺失株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒; 对照组: 注射0.75%生理盐水的处理组Fig. 1 VPA0148 inhibiting the lethality of V. parahaemolyticus to zebrafish
在注射感染4h 后, ΔVPA0148与WT 感染的斑马鱼开始出现死亡。感染4~12h 期间, 不同实验组均出现大量死亡, 而ΔVPA0148感染的斑马鱼死亡数量更多。感染20h 之后, 各实验组中存活的斑马鱼数量趋于稳定。向ΔVPA0148中回补VPA0148基因显著降低了菌株对斑马鱼的致死速度和致死率。同时, ΔVPA0148:: pVPA0148感染的斑马鱼的死亡速度和死亡数量又略低于 WT 感染组, 说明回补VPA0148后, 菌株对斑马鱼的致死能力下降; 而ΔVPA0148::pVPA0148致死能力低于WT, 可能的原因是作为VPA0148基因载体的高拷贝质粒pBBR1-MCS-1 提高了VPA0148的表达量(与WT 相比)。以上实验结果说明了VPA0148 对菌株的毒力有抑制作用。
2.2 VPA0148 的表达量受环境中铁离子浓度和NaCl 浓度的影响
通过荧光定量 PCR(quantitative reverse transcription PCR, RT-qPCR)确定VPA0148在不同条件下的表达差异。实验结果显示, 在含有1% NaCl的心浸液培养基中加入螯合剂后(低铁条件),VPA0148的表达量上调倍数最高, 因此随后对菌株毒力表型的检测实验在此培养条件下进行。对比两种不同NaCl 浓度的心浸液培养基中VPA0148的表达倍数差异, 可以发现NaCl 可能在一定程度上抑制了液体培养条件下菌株中VPA0148的表达; 对比3% NaCl 浓度的LB 和心浸液培养基中VPA0148表达量的倍数差异, 可以发现LB 中VPA0148在低铁条件下的表达量更高(图2)。以上结果说明VPA0148的表达受环境中铁离子和NaCl 浓度的影响, 在1%NaCl 心浸液培养基中, 铁离子的降低能更显著地诱导VPA0148的表达。

图2 相同NaCl 浓度和限铁条件下VPA0148 的转录分析3LB_LB: 含3% NaCl 的LB 培养基中培养的菌株转接到含3%NaCl 的LB 培养基中; 3LB_DP: 含3% NaCl 的LB 培养基中培养的菌株转接到含3% NaCl 的添加了螯合剂的LB 培养基中;3LB_DMEM: 含3% NaCl 的LB 培养基中培养的菌株转接到DMEM 培养基中; 3HI_HI: 含3% NaCl 的心浸液培养基中培养的菌株转接到含3% NaCl 的心浸液培养基中; 3HI_DP: 含3%NaCl 的心浸液培养基中培养的菌株转接到含3% NaCl 的添加了螯合剂的心浸液培养基中; 3HI_DMEM: 含3% NaCl 的心浸液培养基中培养的菌株转接到 DMEM 培养基中; 1HI_HI: 含 1%NaCl 的普通心浸液培养基中培养的菌株转接到含1% NaCl 的心浸液培养基中; 1HI_DP: 含1% NaCl 的普通心浸液培养基中培养的菌株转接到含1% NaCl 的添加了螯合剂的心浸液培养基;1HI_DMEM: 含1% NaCl 的普通心浸液培养基中培养的菌株转接到DMEM 培养基中。qPCR 检测VPA0148 的转录水平。显著性: *P<0.05, **P<0.01, ****P<0.0001Fig. 2 Relative VPA0148 mRNA transcriptional levels under different concentrations of NaCl and iron-limiting condition
DMEM 培养基(Dulbecco's Modified Eagle Medium, Gibco)是培养哺乳动物细胞的常用培养基,其中含有20mmol·L-1FeCl3。实验结果发现, 在1%NaCl 心浸液培养基中培养的菌株, 经DMEM 培养基处理后,VPA0148表达上调倍数最高(图2)。但各处理组中, DMEM 处理后VPA0148的表达量上调倍数都远低于在培养基中直接加入铁离子螯合剂的处理组。以上结果说明DMEM 能够诱导VPA0148表达上调。
2.3 VPA0148 对副溶血弧菌在低铁条件下生长的影响
通过检测生长曲线, 探究VPA0148 在低铁条件下对菌株生长的影响。实验发现, 在普通心浸液培养基中过夜培养的菌株转接到添加了铁离子螯合剂的低铁培养基中后,VPA0148缺失株ΔVPA0148的生长速度高于 WT; 回补VPA0148后, 菌株ΔVPA0148::pVPA0148的生长速度在转接后10h 内与WT 相近, 而在野生型菌株中额外表达VPA0148 后,WT::pVPA0148在低铁环境中的生长速度低于WT(图3b)。比较在普通心浸液培养基以及在添加了铁螯合剂的培养基中连续培养的菌株可以发现, 缺失株的生长速率最高, 野生型菌株中过量表达VPA0148 使菌株生长速率降低(图3a、c)。

图3 VPA0148 对副溶血弧菌在低铁条件下生长的影响本实验使用的心浸液培养基中含1% NaCl。将过夜培养的菌株分别转接到心浸液培养基(a)或含螯合剂的心浸液培养基(b)中; 将在含螯合剂的心浸液培养基中培养的菌株, 转接到含螯合剂的心浸液培养基(c)中, 测定生长曲线。WT: 野生型菌株; ΔVPA0148: VPA0148缺失株; ΔVPA0148::pVPA0148: VPA0148 缺失株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒; WT::pVPA0148: 野生型菌株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒Fig. 3 VPA0148 inhibiting the growth of V. parahaemolyticus under low-iron condition
2.4 VPA0148 对副溶血弧菌群集运动能力的影响
本实验首先比较了在不同NaCl 浓度的心浸液固体培养基上野生菌株群集运动能力的差别, 发现在含3% NaCl、1.5%琼脂的心浸液固体培养基上,菌株的群集运动更为显著(图 4a), 这可能是由于NaCl 浓度影响了平板的表面张力(Yang et al, 2017)。在含有3% NaCl 的上述平板上检测VPA0148 对菌株群集运动能力的影响。实验发现, 缺失株ΔVPA0148的群集运动能力显著高于野生株(P<0.05), 而回补了该基因后, 菌株的群集运动能力恢复至与野生型相近的水平, 过量表达VPA0148的WT::pVPA0148菌株表现出更低的群集运动能力(图4)。以上结果说明了VPA0148 能够抑制副溶血弧菌的群集运动能力。

图4 VPA0148 对副溶血弧菌群集运动活性的影响a. 不同NaCl 浓度心浸液-琼脂平板上菌株的运动范围; b. 3% NaCl 浓度心浸液-琼脂平板上不同菌株的运动范围。WT: 野生型菌株;ΔVPA0148: VPA0148 缺失株; ΔVPA0148::pVPA0148: VPA0148 缺失株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒; WT::pVPA0148:野生型菌株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒。显著性: *P<0.05 Fig. 4 VPA0148 inhibiting the swarming activity of V. parahaemolyticus
2.5 VPA0148 对副溶血弧菌的生物膜形成的影响
通过结晶紫染色法, 在含有1% NaCl 的心浸液培养基中检测VPA0148对菌株生物膜形成能力的影响。实验发现, 24h 时ΔVPA0148生物膜的形成量显著高于WT, ΔVPA0148::pVPA0148的生物膜形成量与WT 相当, 而过量表达VPA0148 会降低菌株的生物膜形成量(图5)。以上结果说明VPA0148 对副溶血弧菌生物膜的形成有抑制作用。
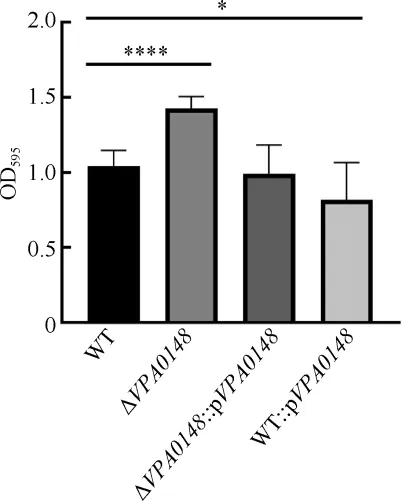
图5 VPA0148 对副溶血弧菌生物膜形成的影响WT: 野 生 型 菌 株 ; ΔVPA0148: VPA0148 缺 失 株 ;ΔVPA0148::pVPA0148: VPA0148 缺失株中回补带有VPA0148 基因的pBBR1-MCS-1 质粒; WT::pVPA0148: 野生型菌株中回补带有VPA0148 基因的 pBBR1-MCS-1 质粒。显著性: *P<0.05,****P<0.0001Fig. 5 VPA0148 inhibiting the biofilm formation of V.parahaemolyticus
3 讨论
低铁浓度是宿主体内刺激病原菌摄铁系统和毒力相关基因表达的一种信号。副溶血弧菌的摄铁系统包括铁螯合物和膜上铁受体。除了通过分泌弧菌铁蛋白获取胞外铁离子, 副溶血弧菌还能利用其他细菌分泌的铁载体, 如产气菌素、高铁色素和肠杆菌素。在副溶血弧菌中, 已知的肠杆菌素受体有IrgA、VctA和 PeuA, 分别由转录调节因子 IrgB、VctR 和VPA0148 调控表达(Tanabe et al, 2012,2014)。本研究发现, 在副溶血弧菌RIMD 2210633 中, 含铁肠杆菌素受体调节蛋白VPA0148 对菌株毒力存在负调节作用。在低铁条件下,VPA0148的缺失能够提高菌株的生长速率和群集运动的能力。VPA0148的缺失同时还增加了生物膜的形成量, 以及菌株对生物的致死能力。接下来, 我们将研究VPA0148 调控群集运动和生物膜形成的分子机制, 同时还需要探究VPA0148-VPA0149 的相互作用及在相关调控中的作用。
当环境中可利用的铁浓度不足时, 细菌的生物膜形成受到抑制, 这可能是由于胞外多糖对铁具有螯合作用, 形成生物膜后细菌更难获取铁(Payne et al, 2016)。在霍乱弧菌中, 当细胞内铁稳态受到影响时, 菌株的运动性和生物膜形成能力均受到抑制(Davis et al, 2005; Mey et al, 2005a)。因此转录调节蛋白VPA0148 可能同时参与了副溶血弧菌外源铁的摄取和细胞铁稳态的调节, 从而抑制生物膜的形成和群集运动的能力。同时, 霍乱弧菌(Vibrio cholera)、创伤弧菌(Vibrio vulnificus)等其他致病弧菌的毒力均受到细胞内铁离子浓度的调节(León-Sicairos et al, 2015)。TonB 是铁代谢通路中的能量传输系统, 研究证明在创伤弧菌、霍乱弧菌、鳗弧菌(Vibrio anguillarum)和溶藻弧菌(Vibrio alginolyticus)中, TonB 的缺失减弱了菌株对宿主的致死能力(Seliger et al, 2001; Stork et al, 2004; Wang et al, 2008; Alice et al, 2008), 说明当弧菌存在铁摄取缺陷时, 其毒力受到较大影响。在鳗弧菌中, 铁载体蛋白的缺失使菌株丧失了对动物的致死能力(Payne, 1993)。我们的研究证明了含铁肠杆菌素受体调节蛋白VPA0148 的缺失使菌株的斑马鱼致死能力增加, 这种调控可能与VPA0148 调控含铁肠杆菌素受体合成有关。
本研究进一步说明外界铁浓度对菌株代谢和毒力的调节是一个精密复杂的过程。研究已知, 细菌中存在Fur(ferric uptake regulation)系统响应环境中的铁离子浓度, 调节下游基因表达。当外界铁离子浓度偏高时, Fur 蛋白结合Fe2+, 其活性受到激活并结合在目标基因启动子处阻止基因转录; 当铁离子浓度降低后, Fur-Fe 中的铁离子被释放, 失活的Fur从结合位点脱离, 从而恢复了目标基因转录(Morabe et al, 2020)。之前的研究发现Fur 能够结合VPA0148的启动子(Tanabe et al, 2014), 这可能是铁调控VPA0148表达的一个原因。在霍乱弧菌、创伤弧菌等多种弧菌中, Fur 被证明通过多种途径调控了菌株毒力(León-Sicairos et al, 2015)。由此推测, 当环境中缺乏铁元素时, 含铁肠杆菌素受体调节蛋白VPA0148 表达量升高, 抑制菌株生长以应对不良的营养条件; 这可能是缺乏该蛋白基因时, 病菌致死能力下降的重要原因。
当环境中铁浓度过低时, 细胞会大量合成定位在细胞膜上的通道蛋白和受体蛋白, 以向胞外运输铁载体以及捕获和向胞内运送外源含铁蛋白, 这个过程会增加细胞膜压力(Acosta et al, 2015) 。 由于VPA0148-VPA0149 是胞膜压力调节系统CpxRS 的同源蛋白, 其可能响应了摄铁系统表达所造成的细胞膜压力的变化(Acosta et al, 2015)。在霍乱弧菌中, Cpx 系统被发现能够受低铁条件的诱导表达, 并能够调节众多参与铁代谢和获取的基因表达, 同时调节关键毒力调节因子ToxRS的表达(Acosta et al, 2015)。因此,VPA0148-VPA0149 抑制了其他可能增加细胞膜压力的生理活动, 如群集运动和生物膜形成。
副溶血弧菌的毒力因子主要包括黏附因子、脂多糖、溶血素(耐热直接溶血素TDH 和TDH 相关溶血素TRH)、两种Ⅲ型分泌系统(Type Ⅲ secretion system, T3SS1 and T3SS2)、Ⅵ型分泌系统(Type Ⅵsecretion system, T6SS)、铁代谢系统等(Li et al,2019)。其中, 溶血素主要与细胞毒性、肠毒性有关,TDH 直接作用于红细胞, 具有溶血活性、肠毒性、心脏毒性和细胞毒性。T3SS1 主要与菌株运动能力、细胞毒性、生物膜形成能力有关, 对菌株的肠定植能力具有负调控作用(Hiyoshi et al, 2010; Hubbard et al, 2016); T3SS2 被证明与肠毒性有关, 能够破坏细胞骨架和操纵信号传导, 并调控炎症因子释放, 有助于在宿主体内的免疫逃避, 被认为是副溶血弧菌最主要的致病因子(Hiyoshi et al, 2010; Calder et al,2014); T6SS 介导了病菌的细胞黏附和侵袭, 能够引起细胞自噬(Yu et al, 2015)。相关研究发现, 铁对副溶血弧菌的毒力有诸多影响。VPA0148 是否对其他毒力因子的表达存在调控仍有待探究。接下来我们会探究T3SS 系统的基因表达及其他毒力是否受到VPA0148 调控。之前的研究发现, 铁及相关调节蛋白可以调控细菌的黏附能力(Hackney et al, 1980;Zhang et al, 2020), 未来我们将进一步探究VPA0148 对副溶血弧菌中多种黏附蛋白基因表达及其细胞黏附能力的影响。
本研究发现含铁肠杆菌素受体调节蛋白VPA0148 能够调节副溶血弧菌生长、运动、生物膜形成和生物致死能力, 初步揭示了肠杆菌素受体调控与副溶血弧菌毒力的关系, 增进了对铁调节副溶血弧菌毒力的机制的了解。本研究结果为后续探究VPA0148 调控副溶血弧菌毒力的分子机制提供了数据支持, 也为解析副溶血弧菌双组分系统调控毒力的分子机制提供了基础。
