黄鳍金枪鱼酶解物免疫活性及其氨基酸分析
2021-12-04巫楚君潘剑宇蔡冰娜陶曙红
巫楚君, 潘剑宇, 蔡冰娜, 陶曙红
1. 广东药科大学中药学院, 广东 广州 510006;
2. 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室, 广东 广州 510301
随着生活节奏加快、饮食习惯不规律、人口老龄化以及各种慢性病发病率的急剧增加, 免疫功能在预防和控制慢性疾病方面变得越来越重要。特别是受新冠疫情影响, 增强机体免疫力已成为国民健康的迫切需求。海洋生物富含优质且活性独特的蛋白肽, 是食源性免疫增强蛋白肽的重要来源。研究发现扇贝多肽能显著对抗地塞米松引起的小鼠脾脏白髓萎缩, 提高小鼠外周血T 淋巴细胞数量(张彩梅等, 2005); 阿拉斯加狭鳕胰蛋白酶蛋白水解物Pro-Thr-Gly-Ala-Asp-Tyr (PTGADY)可增强免疫抑制小鼠的体液、细胞和非特异性免疫(Hou et al,2016)。食品工业用酶是制备食品用途活性肽的常用工具酶, 其中木瓜蛋白酶和中性蛋白酶的双酶同时水解法也常见于海洋鱼类活性肽的制备(杨萍等,2009; 纪丽娜, 2012)。
黄鳍金枪鱼(Thunnus albacores)俗称黄鲮甘、鱼串子, 在分类学上隶属于鲈形目金枪鱼科金枪鱼属,分布于印度洋、太平洋、大西洋热带、亚热带水域,是金枪鱼属中渔业产量最大的经济鱼种, 2018 年我国金枪鱼年捕获量已达到5.5 万吨(农业农村部渔业渔政管理局等, 2019)。金枪鱼在加工生产的过程中会产生大量的碎肉、鱼头、内脏等, 这些副产物最高可占原物质的 70%(Guerard et al, 2002)。Sutanbawa 等(2006)报告称, 金枪鱼罐头行业的废弃物每年估计有45 万吨之多, 这些副产物同金枪鱼白肉一样具有优质的蛋白质、小分子肽和功能性氨基酸等活性成分, 表现出多种功能活性。据研究报道,张朋等(2014)从金枪鱼(鲣鱼)碎肉中获得结构为Phe-Gly- Gly-Val (FGGV)的四肽, 具有良好的血管紧张素转化酶抑制活性; He 等(2019)在金枪鱼(鲣鱼)肉中分离所得多肽, 可降低高尿酸血症大鼠血清和肝脏天然黄嘌呤氧化酶活性; 杜帅等(2014)利用金枪鱼碎肉制备高F 值寡肽, 高F 值寡肽产品具有改善肝性脑病、醒酒、护肝等生理功能; 黄鳍金枪鱼腹部皮肤明胶经碱性蛋白酶解的产物, 具有良好的抗氧化、清除亚硝酸盐和抑制血管紧张素转化酶活性(Han et al, 2015); 内脏经复合蛋白酶水解后的产物经膜超滤得到4 个馏分F1、F2、F3、F4, 馏分F4(<3k Da)具有较高的抗氧化和抗菌特性(Pezeshk et al, 2019), 但金枪鱼肽在免疫调节方面的研究鲜有报道。
本文利用小鼠巨噬细胞系RAW264.7 细胞模型,比较了几种常用食品工业用酶水解黄鳍金枪鱼碎肉所获得酶解产物的免疫活性, 以期获得活性较好的免疫活性肽的制备方法, 并通过分析活性肽的氨基酸组成和分子量分布, 为该多肽的进一步研究提供依据。
1 材料与方法
1.1 材料
1.1.1 原料与细胞
金枪鱼加工碎肉由广东兴亿海洋生物工程股份有限公司提供, 小鼠巨噬细胞系RAW264.7 细胞购自美国ATCC 公司。
1.1.2 试剂及仪器
碱性蛋白酶、胰蛋白酶、胃蛋白酶购于南宁庞博生物工程有限公司; 高糖培养基(dulbecco's modified eagle medium, DMEM)、胎牛血清(fetal bovine serum, FBS)、青/链霉素双抗、磷酸盐缓冲生理盐水(phosphate buffer saline, PBS)购于美国Gibco生物技术有限公司; 脂多糖(lipopolysaccharide,LPS)、四甲基偶氮噻唑蓝(methyl thiazolyl tetrazolium,MTT)购于美国Sigma 化学公司; 一氧化氮检测试剂盒购于碧云天生物技术有限公司; 中性红购于索莱宝生物科技有限公司; 细胞色素C、抑肽酶、杆菌肽、和苯丙氨酸购于上海博升生物科技有限公司; L-氧化型谷胱甘肽购于上海源叶生物科技有限公司;所用的其他化学品和试剂均为分析级。所用仪器设备包括LA8080 氨基酸分析仪(日立, 日本)、1260高效液相色谱(Agilent, 美国)和VIVAFLOW 200 超滤膜包(sartorius, 德国)等。
1.2 实验方法
1.2.1 黄鳍金枪鱼碎肉蛋白酶解液及超滤组分的制备
金枪鱼酶解多肽的制备: 金枪鱼碎肉, 用匀浆机搅成肉糜, 按照表1 条件加入蒸馏水, 搅拌3 次,分别用1mol·L-1的HCl 溶液和NaOH 溶液调节pH,在水解温度下预热20min 后加入蛋白酶水解相应的时间。水解后100℃沸水浴10min, 10000r·min-1, 4℃离心30min, 取上清液用0.2μm 滤膜抽滤, 滤过液用10k 和3k MWCO 超滤膜处理, 取<3k Da 滤过液浓缩, 冷冻干燥后获得胃蛋白酶水解金枪鱼多肽(tuna protein hydrolysated by pepsin, TPP)、胰蛋白酶水解金枪鱼多肽(tuna protein hydrolysated by trypsin,TPT)和碱性蛋白酶水解金枪鱼多肽(tuna protein hydrolysated by alcalase, TPA)。

表1 金枪鱼肉酶解条件Tab. 1 Enzymolysis conditions of tuna meat
复合蛋白酶酶解多肽(tuna protein hydrolysated by pepsin and trypsin, TPPT)的制备: 取金枪鱼糜300g, 加入 3 倍水体积蒸馏水, 搅拌 3 次, 用1mol·L-1HCl 调pH 至2.0, 37℃水浴预热20min 后加入 2500U·g-1胃蛋白酶, 37℃酶解 2h 后, 加入1mol·L-1NaOH 溶液调pH 至8.0, 加入3000U·g-1胰蛋白酶, 37 ℃酶解4h 后, 后续灭活、离心、抽滤、浓缩、冷冻干燥操作同上, 获得TPPT。
1.2.2 细胞培养
RAW264.7 细胞培养于含有10% FBS、1%青霉素(10000U·mL-1)和链霉素(10000μg·mL-1)的DMEM培养基中(V/V), 在37 ℃, 5% CO2孵箱中培养, 收集对数期RAW264.7 细胞用于免疫活性研究。
1.2.3 酶解物对RAW264.7 细胞增殖的影响
将 RAW264. 7 细胞以5 × 105cells·mL-1, 每孔100μL 接种于96 孔细胞培养板中, 培养24h 后弃去上清液, 分别加入含终浓度为12.5、25、50、100、200、400 及800μg·mL-1样品溶液, 每孔200μL, 空白对照组为含10% FBS 的DMEM 培养基, 每组设6 复孔, 在37℃、5%CO2条件下培养24h 后, 于结束前4h 每孔加入5mg·mL-1的MTT, 每孔20μL, 4h 弃上清液, 加入DMSO 150μL, 振荡10min, 置于酶标仪570nm处测定OD 值, 并按公式(1)计算细胞增殖率Cr。

式中A1、A0分别为样品的吸光度和空白对照的吸光度。
1.2.4 酶解物对RAW264.7 细胞吞噬能力的影响
将 RAW264. 7 细胞以5×105cells·mL-1, 每孔100μL 接种于96 孔细胞培养板中, 培养24h 后弃去上清液, 分别加入含终浓度为12.5、25、50、100、200、400 及800μg·mL-1样品溶液, 每孔200μL, 空白对照组为含10% FBS 的DMEM 培养基, 每组设6复孔, 在37℃、5%CO2条件下培养24h 后, 弃去上清液, 每孔加入100μL 0.1%中性红溶液, 在培养箱中继续孵育1h 后吸出中性红溶液, 用PBS 洗3 次,向各孔加入100μL 细胞裂解液(乙酸: 无水乙醇=1∶1,V/V), 室温放置2h, 置于酶标仪540 nm 处测定OD 值, 并按公式(2)计算吞噬率Cp。
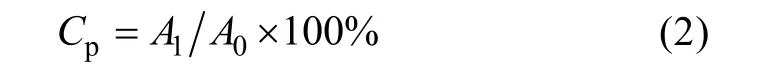
式中A1、A0分别为样品的吸光度和空白对照的吸光度。
1.2.5 酶解物对RAW264.7 细胞NO 释放量的影响
将RAW264. 7 细胞以5×105cells·mL-1, 每孔100μL 接种于96 孔细胞培养板中, 培养24h 后弃去上清液, 分别加入含终浓度为50、100 及200μg·mL-1样品溶液, 每孔200μL, 空白对照组为含10% FBS的DMEM 培养基, 每组设4 复孔, 在37℃、5%CO2条件下培养24h 后, 收集各孔中的细胞培养上清,用NO 检测试剂盒检测上清中的NO 含量, 操作按说明书进行, 置于酶标仪570nm 处测定OD 值, 并按公式(3)计算NO 的增加量INO。A1、A0分别为样品的吸光度和空白对照的吸光度。

1.2.6 氨基酸组分分析
酸水解: 准确称取样品放入水解管中, 加入6mol HCl, 封管, 于110℃水解22h, 冷却, 定容, 过滤, 蒸发去过量盐酸, 用柠檬酸钠缓冲液溶解, 采用LA8080 氨基酸分析仪(日立, 日本)分析。分析条件: 磺酸型阳离子树脂 2.6mm×150mm; 检测波长570nm 和440nm。
碱水解测色氨酸: 准确称取样品放入水解管中,加入4mol·L-1的LiOH 碱水解剂1.5mL, 连接活塞排抽真空约10~15min, 立即封口, 于110℃水解20h, 水解管冷却后切开管口, 用柠檬酸钠缓冲液将水解定量转移到25mL 容量瓶中, 再加入6mol·L-1HCl 中和, 并用柠檬酸缓冲液定容, 用0.45μm 滤膜过滤取上清液, 采用1100 高效液相仪(安捷伦, 美国)分析, 色谱柱:MN-C18, 流动相: 0.0085mol·L-1乙酸钠缓冲液和甲醇(95∶5), 流速1.5mL·min-1, 波长280nm, 进样量15μL。
氨基酸组成比较采用Heml 1.0.3.7 进行层次聚类分析。
1.2.7 分子量分布分析
采用凝胶排阻色谱进行分子量的测定。取3mg·mL-1的样品溶液, 用0.22μm 的滤膜过滤后进色谱柱TSK gel G2000SWXL(300mm×7.8mm)。用乙腈/水/三氟乙酸(20/80/0.1,V/V/V)作流动相, 检测波长 220nm, 流速 0.5mL·min-1, 柱温 35 ℃, 进样量5μL。用细胞色素C(M:12355), 抑肽酶(M:6511), 杆菌肽(M:1422), L-氧化型谷胱甘肽(M:612.63)和苯丙氨酸(M:165.2)作为相对分子质量校正标准。以标准品的logMw 及洗脱时间作标准曲线(y= -0.0169x2+0.3475x+2.3846,R2=0.9986)。
1.2.8 数据处理
实验采用SPSS 25.0 软件进行单因素方差分析和处理,P<0.05 表示数据具有显著性差异,P<0.01表示数据具有极显著性差异。
2 结果和分析
2.1 酶解物对RAW264.7 细胞体外活性筛选
2.1.1 酶解物对RAW264.7 细胞增殖活性的影响
MTT 比色法常用以反映活细胞数量及细胞活力, 广泛用于免疫学相关实验(白生宾 等, 2011)。结果如图1 所示, 不同浓度的TPPT、TPP、TPA 和TPT对RAW264.7 细胞作用24h 后, 随着浓度的增加, 细胞的增殖率出现先平缓后下降的趋势。当样品浓度在12.5~200μg·mL-1较低范围内时, 金枪鱼肉酶解物对RAW264.7 细胞的增殖率影响不显著, 没有明显的细胞毒性作用。浓度大于 400μg·mL-1时, 对RAW264.7 细胞产生抑制作用, 与空白对照相比有极显著性差异(P<0.01)。

图1 不同浓度金枪鱼肉酶解物对RAW264.7 细胞增殖活性影响与空白组对比, *表示P<0.05, **表示P<0.01Fig. 1 Effects of different concentrations of tuna enzymatic hydrolysates on RAW264.7 cell proliferation activity
2.1.2 酶解物对RAW264.7 细胞吞噬能力的影响
巨噬细胞在脊椎动物体内参与先天性免疫和细胞免疫, 是重要的免疫细胞, 其激活与否是检测候选活性物免疫活性的重要标志之一(Lin et al, 2017)。本文采用中性红法检测各组RAW264.7 细胞吞噬功能的变化, 结果如图2 所示, 在12.5~400μg·mL-1范围内, 随着浓度的增加, TPPT、TPP 和TPT 的吞噬率呈上升趋势; 在浓度为400μg·mL-1时达到最大,TPPT、TPP 和TPT 的吞噬率分别为131.25%、122.88%和132.50% (P<0.01); 当浓度大于400μg·mL-1时, 吞噬率出现下降趋势。而TPA 的吞噬能力无明显变化,与空白组相比无显著差异。
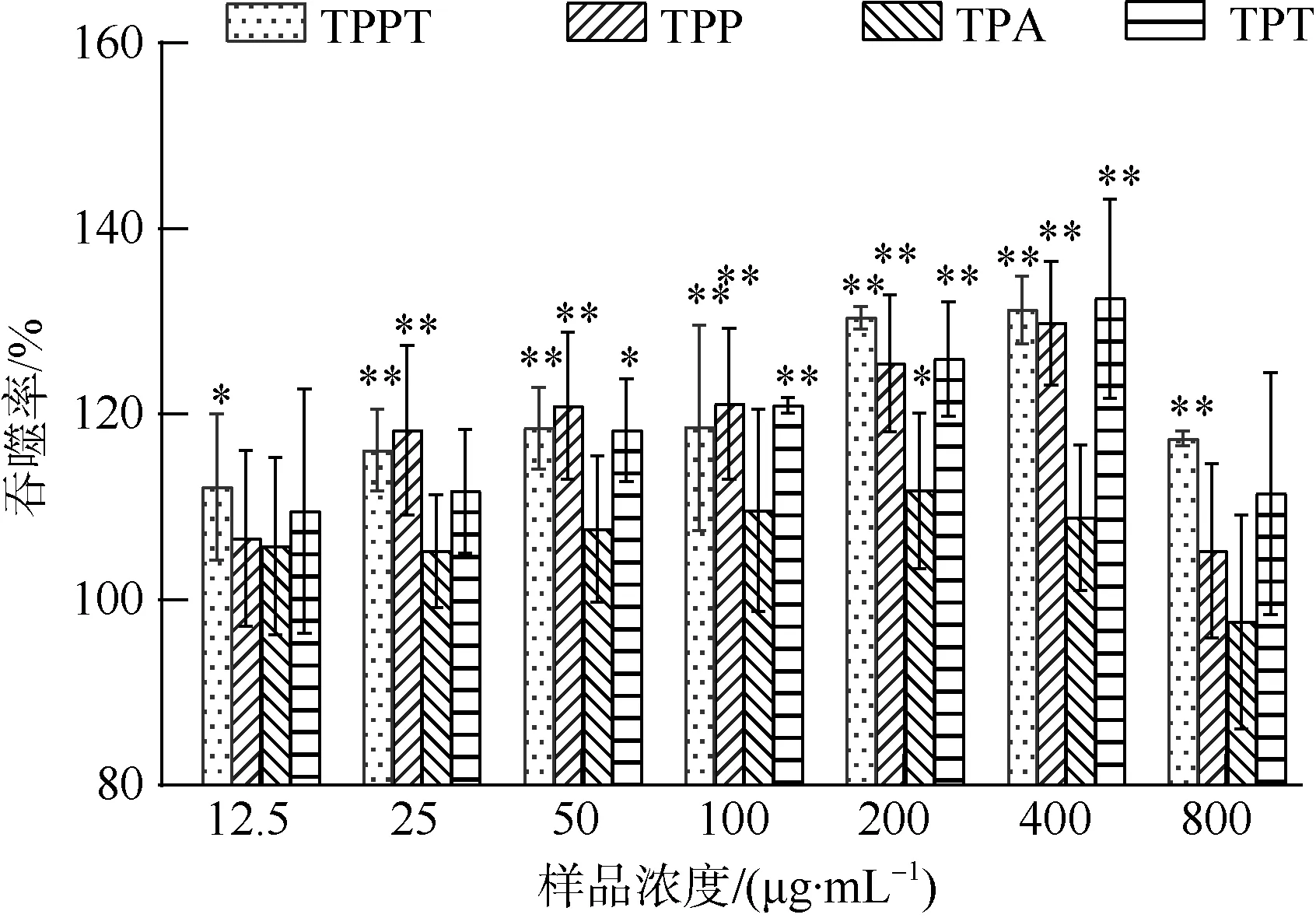
图2 不同浓度金枪鱼肉酶解物对RAW264.7 细胞吞噬能力影响与空白组对比, *表示P<0.05, **表示P<0.01Fig. 2 Effects of different concentrations of enzymatic hydrolysates on the phagocytosis of RAW264.7 cells
2.1.3 酶解物对RAW264.7 细胞NO 释放量的影响
NO 是介导炎症反应的关键因子, 也是参与免疫反应的重要免疫因子, 在内毒素致机体损伤中起重要作用(Yang et al, 2002)。在免疫应答初期, 巨噬细胞在免疫活性物质的作用下, 会活化并释放适量NO 等免疫因子, 进而参与免疫反应, 适量的NO 可以直接杀死病原体、降低病原体复制功能, 同时还能抑制肿瘤细胞生长甚至可以杀伤肿瘤细胞。本文采用Griess 试剂检测细胞培养上清液中NO 含量。结果如图3 所示, 与空白对照组相比, 不同浓度TPT均可极显著促进RAW264.7 细胞生成NO(P<0. 01), 且NO 释放量与酶解液浓度存在一定的量效关系, 在浓度为200μg·mL-1时, NO 产量增加量高达286.33%, 而其他酶解物与空白对照组相比无显著性差异。

图3 不同浓度金枪鱼肉酶解物对RAW264.7 细胞释放NO 的影响与空白组对比, *表示P<0.05, **表示P<0.01Fig. 3 Effects of different concentrations of tuna enzymatic hydrolysates on the release of NO in RAW264.7 cells
2.2 酶解物氨基酸组分分析
氨基酸是人体免疫系统的基本物质, 与免疫系统的组织、器官发育密切相关, 进入体内后被重新分配, 参与炎症和免疫反应。4 种酶解物中氨基酸组成的聚类分析见图4, 4 种金枪鱼碎肉酶解物氨基酸含量丰富, 必需氨基酸含量高达47.89%, 其中TPT 的必需氨基酸含量最高, 占该组分氨基酸总量的51.09%。如图4 所示, TPP 和TPA 的水解产物形成了两个非常紧密的簇。TPPT 水解物的氨基酸组成也与TPP 和TPA 的水解物有一些相似之处, 但落在更宽的距离上; TPT 水解物与其他水解物距离最宽, 说明酶解物TPP 和TPA 的氨基酸组成较为接近; 而TPT与其他3 个酶解物的氨基酸组成有着较大差距, 其中由图4 和表2 可知, TPT 的组氨酸、赖氨酸和精氨酸等3 个碱性氨基酸的相对含量较高, 分别为11.59%、11.00%和6.90%, 均高于其他酶解物。
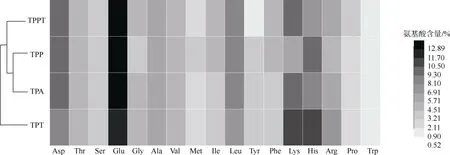
图4 样品氨基酸组成层次聚类分析图Fig. 4 Cluster analysis diagram of amino acid composition hierarchy of samples
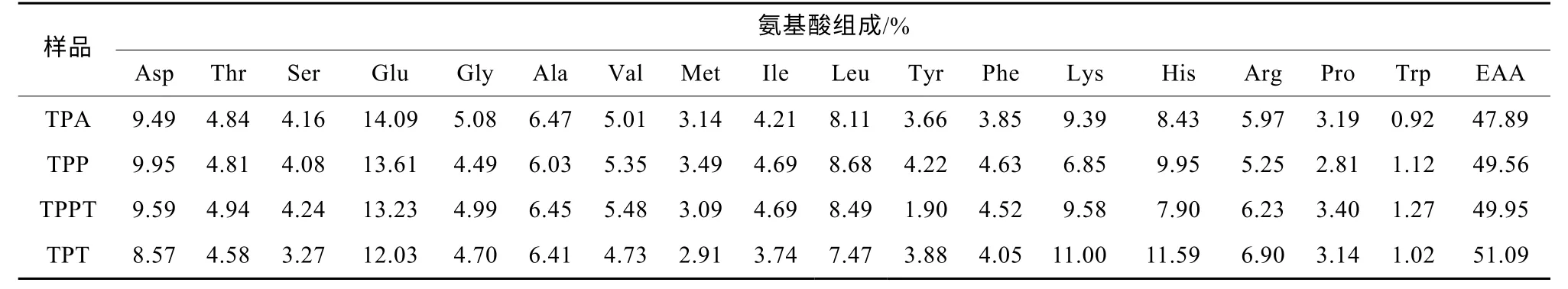
表2 酶解样品氨基酸组成Tab. 2 Amino acid composition of enzymolysis sample
2.3 酶解物分子量分布
酶解物的分子量分布如表3 所示, TPP 和TPT相比, 都是特异性酶切位点, 且都含有小分子肽,但胰蛋白酶的酶切位点比胃蛋白酶更为严格, 且TPT 的活性更好; TPT 与TPA 相比, 分子量分布相近,但碱性蛋白酶是非特异性酶, 胰蛋白酶为特异性蛋白酶, 水解Lys 和Arg 形成肽键, 因此经胰蛋白酶酶解后的肽链末端氨基酸大多以Lys 和Arg 存在, 综合提示活性与酶切位点有关; TPPT 与TPT 相比, 小于0.5k Da 的组分含量高达88.08%, TPPT 为复合酶酶解产物, 可能更多的释放出游离氨基酸, 使其活性弱于TPT, 提示TPPT 会破坏相关活性序列特征。

表3 酶解物不同分子量范围所占峰面积百分比Tab. 3 Percentage of peak area of enzymatic hydrolysates with different molecular weight ranges
3 讨论
机体遭遇外来异物攻击时, 会激活巨噬细胞的吞噬作用, 而免疫活性肽具有增强巨噬细胞吞噬作用, 促进巨噬细胞释放NO 等功能。巨噬细胞的增殖能力、吞噬能力、NO 释放能力等是评价其是否被激活的常用指标。本实验检测金枪鱼肉不同蛋白酶酶解物对RAW264.7 细胞的免疫活性, 研究显示,不同浓度胰蛋白酶酶解产物TPT 作用于RAW264.7细胞24h 后, 均可增强其吞噬作用, 促进其NO 释放,显示胰蛋白酶酶解产物具有明显的免疫活性。这一结果与Hou 等(2012, 2016)用胰蛋白酶酶解鳕鱼的研究相似。TPT 表现出对RAW264.7 细胞显著的NO释放提升作用, 可能与其能诱导细胞中iNOS 的表达有关(Lind et al, 2017)。
氨基酸在人类免疫系统中发挥着各种作用, 苏氨酸在免疫球蛋白中含量丰富, 在维持肠道固有免疫屏障完整性方面起重要作用; 缬氨酸、亮氨酸、异亮氨酸属支链氨基酸, 支链氨基酸能促进Th1 型免疫反应的进行; 色氨酸在血浆和组织中浓度较低,但其产生的中间代谢物会生成自由基清除剂和抗氧化剂, 从而参与机体免疫反应; 组氨酸经催化生成的组氨在炎症和过敏反应中扮演重要角色(王晓芳等, 2013), 这些氨基酸都属于必需氨基酸(EAA), 与其他酶解物相比, TPT 中EAA 含量最高; 此外, 赖氨酸能将抗原和T 细胞连接在一起, 使T 细胞产生针对抗原的特异效应, 具有增强人体免疫的功能(Ghosh et al, 2008); 精氨酸可减少手术后内毒素和应激反应的发生(Hou et al,2012), 可增加肝脏中精氨酸酶的活性, 有助于将血液中的氨转化为尿素排出去, 提高机体免疫功能(Mizock, 2010; 张爱琳 等,2016)。Hou 等(2012)研究发现阿拉斯加狭鳕骨胰蛋白酶酶解物具有较高的免疫调节活性, 这可能因为其富含苏氨酸、谷氨酸、精氨酸和半胱氨酸这些与免疫调节活性有关的氨基酸。这提示酶解物的氨基酸组成与免疫调节活性有较大关联, TPT 除了含有上述具有免疫调节活性的EAA, 还富含赖氨酸和精氨酸, 因胰蛋白酶专属水解赖氨酸和精氨酸所形成的肽键。因此, TPT 所具有的免疫活性可能与胰蛋白酶酶解物的氨基酸组成有关。
叶盛旺等(2019)研究发现青蛤多肽高免疫活性组分的分子量小于3kDa; 杨萍等(2010)研究发现黄鳍金枪鱼鱼头酶解物小于1k Da 组分单独作用能明显促进淋巴细胞增殖。由分子量分布结果可以看出,TPT 分子量小于1k Da 的含量高达97.48%, 由此推测TPT 酶解物3k Da 超滤组分具有较高的免疫活性可能与其小肽序列的必需氨基酸和碱性氨基酸组成和结构有关。
综上所述, 胰蛋白酶酶解黄鳍金枪鱼肉得到的小于3k Da 超滤组分, 值得深入分析结构组成与研究其作用机制, 为进一步开发具有增强免疫力功效的金枪鱼肽食品提供理论依据及参考。
