提高气液氢甲酰化反应传质的途径*
2021-12-04姜伟丽张瑛媛周广林
姜伟丽,张瑛媛,周广林
(中国石油大学(北京)新能源与材料学院,北京 102249)
质量传递(简称“传质”)作为自然界和工程领域普遍存在的现象,很早就引起人们的研究兴趣。尤其在化工生产领域,传质及分离过程起到了特别重要的作用。因此“传质与分离”的知识体系,成为工程类尤其是化工类本科生的重要课程内容。基于不同的生产过程涉及的质量传递的机理不同,人们把传质分离过程分为平衡分离和速率分离两大类。前者指借助分离媒介使均相混合物体系变成两相体系,根据各组分在两相中的分配关系的不同实现组分的分离;而后者主要指借助某种推动力,利用各组分扩散速度的不同实现组分的分离。由于工业中用到的传质分离过程大多为平衡分离过程,如气液传质过程、气液传质过程、液液传质过程、液固传质过程等,因此关于气-液相际传质也是“传质与分离”课程研究的重要内容。由于该课程内容偏难,知识体系较为复杂,理论基础要求较高,因此学生学起来颇有难度。为了在授课过程中增加课堂实例,可引入工业上应用最广泛的均相反应——烯烃氢甲酰化反应,让学生了解工业与实验室研究进展,拓展其知识面[1]。
烯烃氢甲酰化反应是指烯烃与合成气(VCO∶VH2=1∶1)在催化剂的作用下,生成多一个碳的醛的反应。该反应具有反应转化率高、产物醛的正异比高、催化剂可循环使用等特点,被认为是当今绿色化工工艺技术的代表,是未来重点发展的化工技术。目前中国应用最广的是丙烯氢甲酰化生产丁辛醇的反应,丁辛醇也是目前中国应用最多的塑料增塑剂醇。但随着环保要求的日趋严格,由戊醛衍生出的2-丙基庚醇生产的邻苯二甲酸二(2-丙基庚)酯(DPHP)因具有良好的低温性能,而被认为是目前广泛使用的DOP 最理想的替代品,也是欧美发达国家主要使用的塑料增塑剂[2]。戊醛主要由丁烯氢甲酰化反应得到。随着中国原油加工能力和乙烯工业生产能力的不断增加以及煤化工的快速发展,C4烃的总产量逐年增加。丁烯(包括1-丁烯和2-丁烯)是C4烃的重要组成部分,目前中国丁烯的化工利用率还很低,利用混合丁烯生产高附加值的戊醛也有利于中国化工行业的发展。目前工业氢甲酰化反应采用油溶性的铑/膦配合物催化的气液相反应,反应的活性和选择性都比较高,反应条件温和,容易控制。但由于金属铑催化剂价格昂贵,且反应过程受到诸多因素的影响,如何提高铑催化剂的利用率并减少其损失是影响此技术工业应用的关键[3]。
由正丁烯经氢甲酰化反应生成戊醛的反应方程式为:
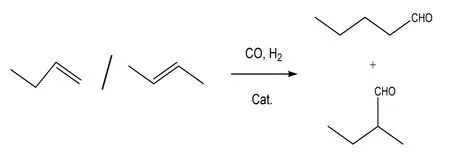
正丁烯中的1-丁烯和2-丁烯均可以发生氢甲酰化反应生成正构戊醛和异构戊醛,但2-丁烯的反应活性远低于1-丁烯。而且由于正戊醛的下游产品需求量远大于异戊醛,因此反应产物的正异比(正戊醛/异戊醛)是衡量此反应的重要指标。
氢甲酰化反应中由于存在多种化学平衡而对反应条件非常敏感,在连续操作或重复使用时,催化剂体系的活性受多种因素的影响而逐渐降低。如何延长催化剂寿命并减少过程中的催化剂失活对工业化的成功具有重要意义。
1 实验过程
为了增加气液相际传质,气液反应往往需要在高压反应釜中进行,如图1 所示。将一定量的2-丁烯、膦配体、催化剂和溶剂加入反应釜中,用氮气吹扫釜内空气,确认不漏气后用合成气吹扫置换氮气;之后加合成气至一定压力,并搅拌升温;待温度到达指定温度后,再次加入合成气至指定压力,此时开始计时反应;当反应达所需时间后,停止加热,将反应釜冷却至室温,并对反应产物进行分析。
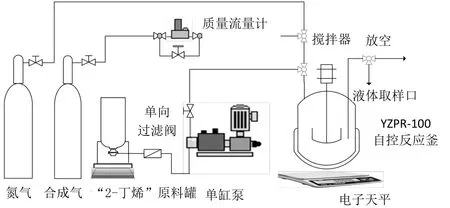
图1 氢甲酰化反应示意图
2 影响因素分析
通过实验可以发现,反应温度、反应压力、搅拌速率、催化剂浓度等条件都对反应有明显的影响,下面一一进行分析。
2.1 反应温度的影响
适当升高反应温度有利于提高催化剂活性,从而加快反应速率。但温度过高,丁烯及合成气在溶液中的溶解度减小,将导致反应速率快速下降。而且,对于1-丁烯氢甲酰化反应来说,温度的升高将急剧地增加1-丁烯异构反应,导致2-丁烯产量增加,而2-丁烯的氢甲酰化反应活性较低,因此降低了产物醛的收率。另一方面,过高的反应温度下,催化剂物种铑络合物(如HRh(CO)(PPh3)3)解离加速,生成的大量中间物种(RhH(CO)(PPh3)2)在较高温度下易聚合形成无活性的膦桥二聚体(-Rh-PPh2-Rh-),从而使体系催化活性下降。所以,反应的转化率(或产物的收率)随着反应温度的增加一般有个极大值。对于1-丁烯均相氢甲酰化反应来说,最佳的反应温度一般为90~100 ℃。
2.2 反应压力的影响
气液相反应通常受到反应总压的影响比较明显,因为总压往往直接影响气相原料的含量或者浓度。在1-丁烯氢甲酰化反应体系中,一方面,由于合成气(H2∶CO=1∶1)在溶液中的溶解度很低,增加反应压力有利于增加合成的溶解度,也可以增加1-丁烯的溶解度。根据亨利定律,在总压不太高的情况下,稀溶液中溶质的摩尔分数与其平衡分压成正比。因此压力的增加,将使得合成气在溶液中的溶解度增大,必然将增大合成与丁烯以及催化剂的接触概率,从而提高反应速率。另一方面,由于该反应是压力减小的反应,从化学平衡的角度看,压力的增加将有利于反应的发生。但是,在1-丁烯均相氢甲酰化反应体系中,压力过高,CO 的浓度增大,使得催化活性物种平衡逐渐向生成异戊醛的方向移动,使得产物醛的正异比(正戊醛/异戊醛)随压力的增大先增大后减小,见公式(1)。实验发现,在1-丁烯氢甲酰化反应的过程中,总压对反应转化率和正戊醛的选择性的影响存在极大值,最佳压力值通常为2.0~3.0 MPa。
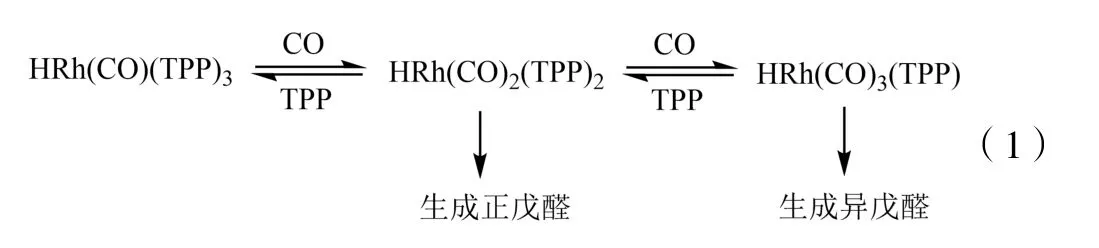
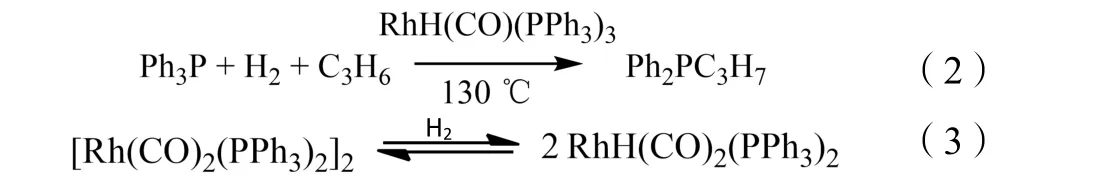
此外,合成气中CO 和H2的分压对反应也有明显的影响。在CO 分压较高的情况下,氢甲酰化反应有可能被阻止。H2分压稍高于CO 时有利于活性物种RhH(CO)2P2的形成,因此可以提高反应速率。然而,H2的过量将会导致加氢反应的发生。另外,加氢条件下,三苯基膦与烯烃容易被Rh 配合物催化形成低活性的烷基二苯基膦化合物,见公式(2),向体系中补充CO 将使这种情况得到抑制。在H2分压较低并且铑的浓度较高时,催化剂易聚合形成无活性的桥连二聚体,如-Rh-CO-Rh-。这种二聚体可以通过增加体系中的H2分压而得到再生,见公式(3)[4]。
2.3 搅拌速率的影响
为了实现两相更均匀的混合,气液相反应通常都会在一定的搅拌速率下进行。一般来讲,提高反应搅拌速率,有利于增加气液传质。根据质量传递原理可以知道,在湍流流体中,既存在分子扩散,也存在涡流扩散。搅拌使得流体中形成湍流流动;搅拌速率越快,产生的涡流扩散越强烈。由于涡流扩散的通量远大于分子扩散的通量,因此搅拌速率的提高有利于原料气向溶液中扩散,提高反应的转化率。同时,该反应为微放热反应,增加搅拌速度,利于热量的均衡性,及时将反应热扩散开,从而促进了反应的发生。
2.4 催化剂浓度的影响
提高催化剂的浓度,意味着单位体积内与原料相接触的催化活性中心数目增多,通常可以明显提高反应原料的转化率。但还应当考虑,催化剂浓度升高以后,催化剂之间的相互碰撞的概率也随之增大。对于1-丁烯均相氢甲酰化反应体系来说,由于所用的铑配合物之间有可能会发生聚合反应,形成惰性的桥连二聚体,如-Rh-CO-Rh-,因此当催化剂浓度超过一定量后,原料的转化率并不会随着催化剂浓度的增加一直升高,反而有可能会下降。此外,催化剂浓度升高,将导致反应成本增加。尤其是铑是一种非常昂贵的金属,一定要兼顾催化剂的转化频率与生产成本。
2.5 膦配体的影响
为了提高丁烯的反应转化率,往往需要向反应体系中加入一部分膦配体。膦配体由于具有特殊的电子效应和立体效应,对氢甲酰化反应的反应活性和产物醛的选择性有着重要的影响[5]。目前,氢甲酰化反应的催化体系中主要采用芳基膦、亚磷酸酯以及其他结构复杂的膦配体。三芳基膦类配体因结构简单,在一定的反应条件下可以获得较好的活性和稳定性而成为使用最广泛的配体,而且这种单齿膦配体的大量加入有助于提高产物醛的正异比。以乙酰丙酮三苯基膦羰基氢铑(ROPAC)催化剂为例,当体系中存在过量的三苯基膦(PPh3)时,ROPAC 会先脱去乙酰丙酮基,生成静态物种HRh(CO)(PPh3)3(物种Ⅰ),物种Ⅰ将进一步发生解离形成具有选择性的四配位中间物种Ⅲ,这一物种更倾向于形成直链醛。在较低的PPh3浓度下,体系中的静态物种以Ⅱ的形式存在,Ⅱ或者解离下CO 形成中间物种Ⅲ(若CO 浓度高这一过程将被阻止),或者解离下PPh3形成中间物种Ⅳ。物种Ⅳ被认为更倾向于形成支链醛,如图2 所示。虽然高的膦配体浓度有利于提高产物的正异比,但过多的配体则会因抑制静态产物的解离而降低反应速率。
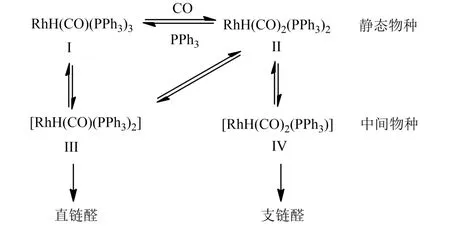
图2 ROPAC/PPh3 催化体系中存在的物种平衡
3 结论
均相反应作为重要的一类反应过程,具有反应条件温和、活性高、反应机理容易监测等优点。对于气液相反应,由于气相需要与液相接触或者溶于液相才发生反应,所以其本质上属于均相反应。在反应体系一定的前提下,提高气液相际传质是提高气液相反应效率的重要方式。而研究提高气液相际传质的途径,即影响传质的因素,无论对于工程应用、实验室研究,还是课堂上的理论学习,都具有重要的指导意义。
