茅台镇酱香型白酒不同生产轮次酿造环境的细菌菌群结构特征
2021-12-03胡小霞黄永光
王 琳,胡小霞,黄永光
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
中国传统白酒作为华夏民族最古老的酒精饮料之一,拥有8 000多年的悠久发展历史,以文化底蕴深厚、酿造工艺复杂以及风味丰富多彩而闻名世界,为世界六大蒸馏酒之一[1]。中国白酒酿造产区生态环境各异,致使微生态各不相同,进而导致品种繁多、香型各异。酱香型白酒作为中国白酒的传统典型酒种之一,具有酱香突出、幽雅细腻、回味悠长、空杯留香持久等特点[2],其受到更多消费者青睐,呈现快速发展的良好态势[3-4]。酱香白酒的发展与其自身优良的品质密不可分,而好品质来源于匠心独具的生产工艺流程与天然不可复制的酿造微生物环境。位于赤水河畔的茅台镇是中国酱酒圣地,被誉为“中国第一酒镇”,其酿造环境空气湿度和温度为参与白酒酿造的微生物菌群繁衍生息提供了适宜的条件。茅台镇独特的酿造环境及其基酒的特殊风味是其他地区所无法比拟的,充分说明酿造环境及其微生物对白酒酿造的重要性。环境微生物主要包括细菌、酵母菌、霉菌和放线菌[5],其中,细菌作为白酒酿造过程中生香和产酶的关键功能微生物,直接影响酒体风味的形成[6]。因此,系统研究酿造环境中细菌菌群结构组成分布及其多样性有助于充分认识酿造环境对白酒酿造的影响机制,从而揭示酿造环境微生物在酿造过程中的关键性作用。
近年,研究者越来越关注白酒酿造核心产区的价值,茅台镇的地域优势与酿造价值备受关注,尤其是酿造微生物生态效应[7]。谭旭[8]对茅台地区赤水河水体四季上下游的微生物多样性进行分析,得出细菌种类夏季>冬季>秋季>春季的结论。张亚丽[9]研究了茅台镇空气中的微生物,发现参与酱香白酒酿造的部分微生物来源于环境空气。黄永光等[10]论述了茅台酒极端酿酒环境和极端微生物间的关系,并呼吁保护茅台镇环境酿酒微生物资源。王兴初等[11]研究了茅台酒生产环境中的空气细菌区系,发现细菌在长期的酿造过程中不断被选择富集,最终形成密度较大、结构复杂的特定细菌区系。文献查阅显示,关联酱香白酒酿造环境细菌菌群的系统性研究和解析,特别是对茅台镇酿造环境的细菌菌群极其有限,更缺乏对各酿造轮次细菌菌群结构之间的多样性、异同性的系统研究。致使对茅台镇酿造环境微生物生态结构与酱香白酒酿造品质之间的相关性机理、机制仍然是模糊的,这十分不利于茅台镇白酒产业高质量的可持续发展。因此,系统全面地研究不同酿造轮次酿造环境中的细菌菌群结构及其演替规律,对科学认识酱香白酒核心产区的独特性及其酿造科学机制具有深远意义和重大价值。
本研究结合高通量测序技术与数理统计方法,对茅台镇酱香白酒1~7轮次酿造环境样本中的细菌菌群结构组成及多样性、差异性进行系统研究,旨在揭示茅台镇各轮次酿造环境的细菌菌群结构组成分布,进一步为“世界酱香白酒核心产区”打造及茅台镇酱香型白酒产业发展提供理论基础和科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品采自贵州省仁怀市茅台镇7 个酱香白酒主酿区(根据酿造企业集中度、地理区位分,分别为镇观音寺区、茅台镇上坪村、茅台镇椿树村、茅台镇岩滩村、茅台镇向阳村、茅台镇卢荣坝村和合马镇街道社区)的17 个代表性酿酒企业的酿造环境,采样点如图1所示。按照轮次划分,将相同轮次及同一区域内的不同酿造环境样品等量混合为该轮次该主酿区的综合样,共49 个综合样品。环境取样点包括:酿造生产车间窗户、窗台、墙体、梁柱、晾堂、行车梯、配电箱和消防箱、储酒罐、沟渠表面及车间外地面。取样时间为2018年1—9月,茅台镇酱香型白酒酿造1~7轮次酿造生产的堆积发酵期。每个采样点(酿造区域环境)的样品采集点均固定在同一采样位置。每轮次样品采集完后及时将样品转移至-80 ℃冰箱密封保存。
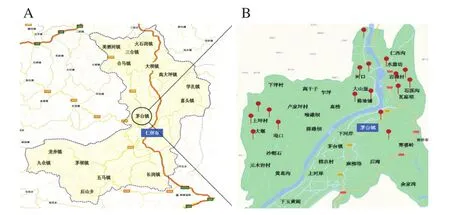
图1 茅台镇酿造环境样品采样点Fig.1 Sampling points of fermentation environmental samples in Maotai town
1.1.2 试剂
E.Z.N.A.Soil DNA Kit 美国Omega BioTek公司;rTaqDNA聚合酶试剂盒 北京全式金生物技术有限公司;DNA Marker 大连TaKaRa公司;引物合成 生工生物工程(上海)股份有限公司;Gengreen染料 上海赛百盛有限公司。
1.2 仪器与设备
台式高速冷冻离心机 德国Sigma公司;G154DW高压蒸汽灭菌锅 厦门致徽仪器有限公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪美国ABI公司;DYY-8C型电泳仪 北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品总DNA提取
各取混匀的综合样品20 g于100 mL离心管中,加入35 mL灭菌后的0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)悬浮和3~5 颗玻璃珠,充分振荡7 min,400 r/min离心5 min,吸取上清液。沉淀用PBS洗涤,旋涡振荡4 min,400 r/min离心5 min,收集上清液。重复上一步操作共收集40~50 mL上清液,12 000 r/min离心5 min,弃上清液,收集细胞沉淀。预处理后每个样品的总DNA提取步骤参考E.Z.N.A.Soil DNA Kit的操作说明书。
1.3.2 PCR 扩增
细菌PCR扩增引物:338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGG GTWTCTAAT-3’);扩增程序:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系20 μL,分别为4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs、0.8 μL引物(5 μmol/L)、0.4 μL FastPfu聚合酶、10 ng DNA模板。
1.3.3 Illumina MiSeq测序
利用Illumina公司的MiSeq PE300平台,分别对细菌V3-V4高变区序列进行测序分析(上海美吉生物医药科技有限公司)。
1.4 数据及图像处理
采用Microsoft Office Excel 2016进行数据计算和分析。基于Illumina MiSeq测序平台,利用R语言、Origin作图软件、SIMCA 14.1绘制稀释曲线、丰度图和偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)图等。
2 结果与分析
2.1 细菌菌群结构多样性分析
2.1.1 基于可操作分类单元(operational taxonomic unit,OTU)聚类分析
利用MiSeq平台的扩增子测序技术分析茅台镇1~7轮次酿造环境中的细菌菌群结构多样性及演替规律,共获得1 049 629 条高质量序列。应用稀释曲线测序数据量可表征样本中物种的丰富度、均一性或多样性,并说明样本的测序数据量是否合理[12];Shannon指数曲线可反映样本微生物多样性[13]。图2表明,本研究每个样本的序列数均超过了22 000,且样本的稀释曲线与Shannon指数曲线均趋于平坦,充分说明测序数据量足够大,完全可以反映样本中绝大多数微生物的多样性信息。
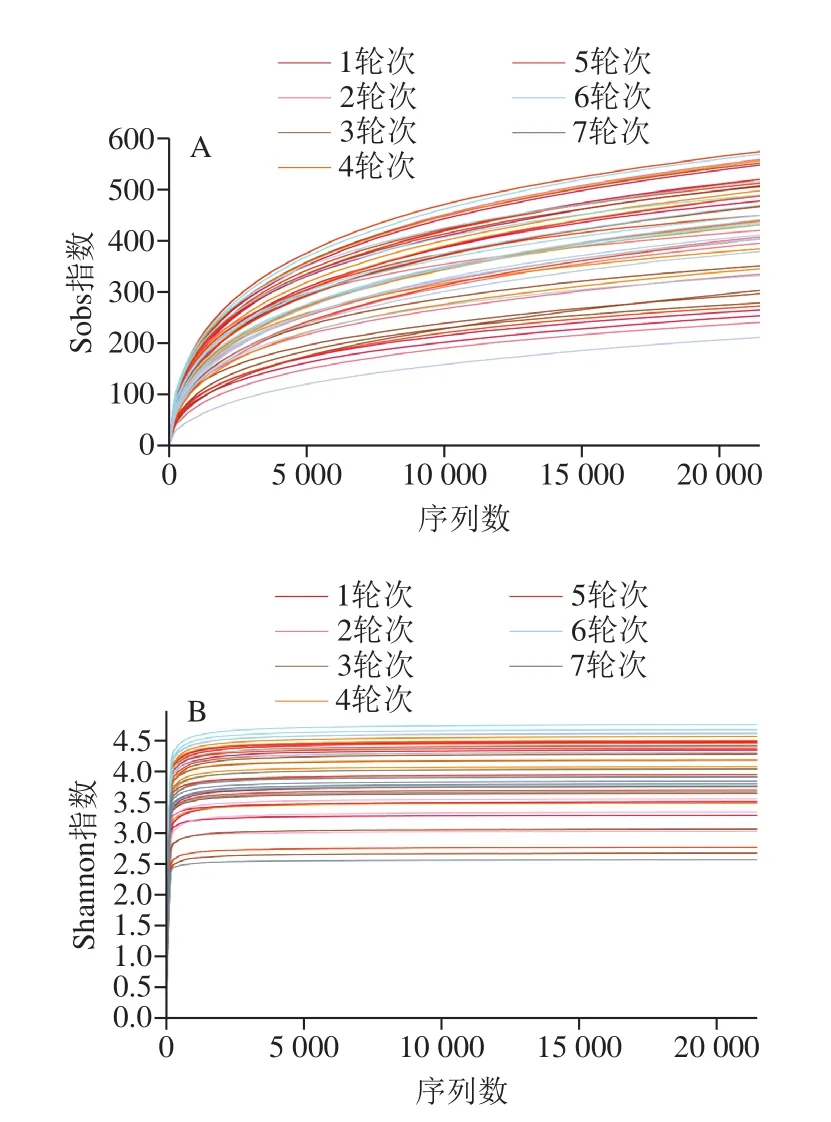
图2 各样品细菌的稀释曲线(A)和Shannon指数曲线(B)Fig.2 Rarefaction curves (A) and Shannon-Wiener curves (B) of bacterial samples
2.1.2α多样性分析
α多样性分析可揭示酿造环境中微生物群落的丰富度和多样性。计算Shannon指数、Simpson指数、ACE指数、Chao指数和覆盖率,以描述样本中的细菌菌群多样性[14]。
由表1可知,茅台镇主酿区1~7轮次酿造环境样本在97%水平下共得到OTU数为1 054,其中第4轮次样本中的OTU数最高为493;第7轮次为365,是全年样本中OTU数最低的。Shannon指数和Simpson指数表明,4、5、6轮次酿造环境的细菌多样性和丰富度明显高于其他轮次,该结果表明这3 个轮次期间(5月、6月和7月)的环境气候条件适宜于细菌生长。各个样本的覆盖率都在99.40%以上,说明各样品文库的覆盖率足够大,绝大部分的微生物种系类型都被检测到,测序结果充分体现茅台镇酱香白酒主酿区酿造环境样本细菌群落多样性的真实情况。
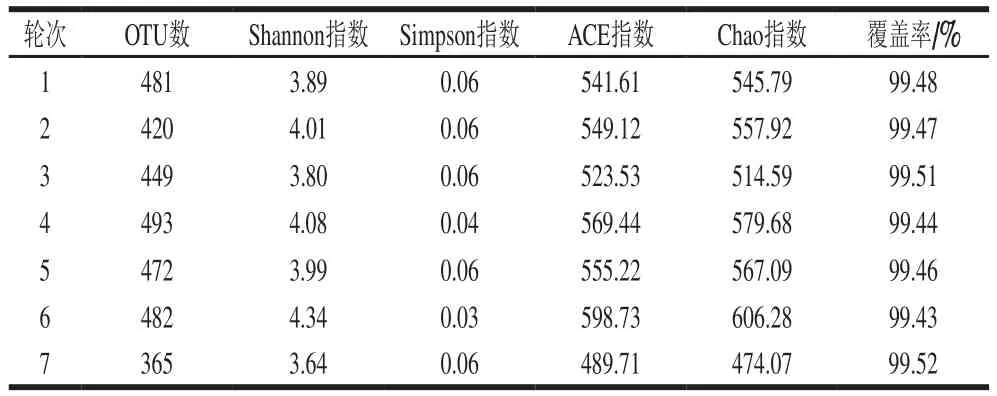
表1 样本细菌群落多样性指数Table 1 α-Diversity indices of bacterial community
2.2 细菌物种与群落结构分析
基于Illumina MiSeq测序数据对茅台镇2018年度1~7轮次酿造环境中细菌的16S rDNA基因V3-V4区序列进行分析,研究茅台镇主酿区酿造环境中细菌物种和群落结构,图3为各轮次酿造环境样本在门水平上的细菌群落结构组成。
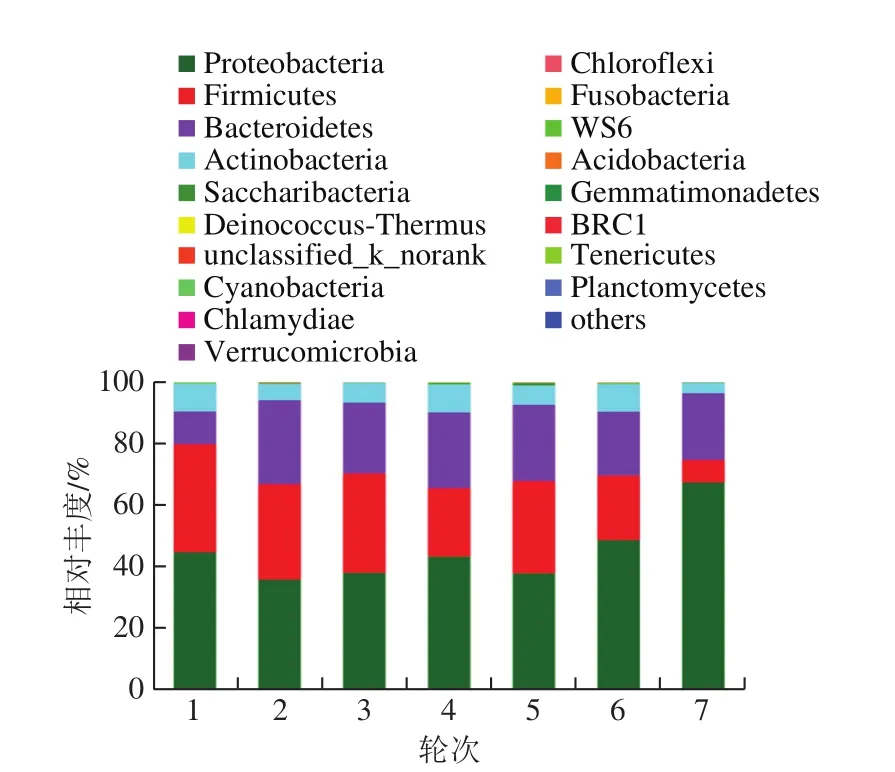
图3 环境样品细菌菌群结构(门水平)Fig.3 Bacterial community structure in environmental samples at the phylum level
从1~7轮次环境中依次检测出16、16、18、19、18、17 个和15 个细菌门,共19 个门。7 个轮次共有的细菌门为Acidobacteria、Actinobacteria、Bacteroidetes、Chlamydiae、Chloroflexi、Cyanobacteria、Deinococcus-Thermus、Firmicutes、Fusobacteria、Proteobacteria、Saccharibacteria、Verrucomicrobia、Gemmatimonadetes和Tenericutes,共14 个,占检出总菌门的73.68%,充分说明在门水平上各轮次间微生物菌群结构具有明显的稳定性。这与谭旭[8]通过高通量测序技术研究茅台地区赤水河中细菌菌群多样性得到的结果基本一致,其中Chlamydiae和Tenericutes未在赤水河水体中检出。
由图3可看出,各轮次的第1优势菌门为Proteobacteria(45.34%)、第2优势菌门为Firmicutes(25.52%)、第3优势菌门为Bacteroidetes(21.76%)、第4优势菌门为Actinobacteria(6.93%)。任爱容等[15]从茅台镇主酿区大曲样本中检测出21 个门,其中4 个为优势菌门,分别是Firmicutes、Proteobacteria、Actinobacteria和Bacteroidetes;郭敏[16]对酱香大曲制曲微生态多样性进行了研究,从曲胚中共检出细菌9 个门,其优势菌门主要为Firmicutes、Proteobacteria、Actinobacteria。王欢等[17]从酱香白酒机械化酿造1~7轮次堆积发酵酒醅中检出14 个细菌门类,结果显示,Proteobacteria、Actinobacteria和Firmicutes为酒醅样本中的优势菌门。上述研究结果与本研究比较分析,发现茅台镇酿造环境与酱香大曲、堆积发酵酒醅中的优势菌门显著相关,说明酿造环境微生物与酿造大曲、酒醅堆积发酵微生物菌群之间存在非常密切的联系(可能存在明显的微生物迁徙,本课题组正在开展相关研究)。同样,Wang Haiyan等[18]解析了浓香型和芝麻香型白酒酿造过程的微生物,发现Proteobacteria和Firmicutes为这两种香型白酒酿造的主要微生物菌群。同时,这2 个门同样是清香型[19]及酱香型[20]白酒发酵过程中的优势细菌门,表明这2 个菌门种群不仅是酿造环境中的优势微生物,也是中国白酒发酵过程中的重要微生物。
上述结果表明,茅台镇酱香型白酒酿造环境的优势细菌门在7 个轮次的相对含量及结构多样性特征相似性较高。Proteobacteria、Firmicutes、Bacteroidetes和Actinobacteria均是各酿造轮次酿造环境中的优势细菌门,表明茅台镇酱香白酒酿造环境中的主要细菌菌门在1~7 个轮次之间具有较好的相对稳定性,这是茅台镇酿造环境微生态结构的酿造特征。
从1~7轮次酿造环境样品中依次检出203、154、187、202、186、219 个和165 个细菌属,共检测出396 个不同的细菌属。酿造环境中相对丰度≥1.00%的细菌属在1~7轮次的分布数量(比例)依次为22(79.34%)、20(75.76%)、24(81.35%)、23(80.05%)、21(71.74%)、24(76.92%)、16(83.43%),这些属为各轮次酿造环境中的优势细菌属,也表征了各酿造轮次环境细菌结构的特征。
由图4可知,Sphingobacterium(12.30%)、Enterobacter(8.69%)、Pantoea(7.02%)、Acinetobacter(5.16%)、unclassified_f_Enterobacteriaceae(5.35%)、Pseudomonas(3.22%)、Escherichia-Shigella(1.85%)和Staphylococcus(1.96%)为7 个轮次酿造环境的共有优势细菌属。而Chryseobacterium(3.30%)、Flavobacterium(1.44%)、Oceanobacillus(4.40%)、Kroppenstedtia(3.01%)、Weissella(2.72%)、Bacillus(2.00%)是1~7轮次酿造环境中至少在5 个轮次中的优势细菌属。Sphingobacterium广泛存在于沙漠、堆肥、各类土壤、植物等自然界中,最适生长温度为25~30 ℃,可分泌大量活性酶[21-22]。对比任爱容等[15]的研究可发现该菌属在酱香大曲中的相对含量远小于酿造环境,这主要是因为制曲过程中高温大曲的培养温度在60 ℃以上,远超其最适生长温度致使含量降低。张亚丽[9]利用罗氏454测序技术对茅台镇空气中不可培养微生物群落进行分析,得出Staphylococcus为夏季空气样本的优势菌属,Acinetobacter则为春季、秋季和冬季的优势菌属的结论。任爱容等[23]对茅台镇酿造环境及大曲中细菌进行可培养时发现Pseudomonas只存在于酿造环境中,其在酿造环境和大曲中都分离到了Enterobacter,而且在酿造环境中的相对含量大于大曲;戴奕杰等[24]在大曲和糟醅中也检测到了Enterobacter;郭敏[16]基于高通量测序发现酱香大曲中Oceanobacillus、Kroppenstedtia是其主要菌属。由此可见,酿造环境中的微生物可能通过大曲制曲、贮存富集网络、堆积发酵迁徙进入到酿造过程,为白酒酿造提供微生物来源。Bacillus和Weissella是白酒发酵过程中的主要功能细菌菌群,在多种香型白酒发酵过程中均有报道[25-26]。其中作为大曲重要核心细菌属的Bacillus为关键的产酸和产香菌,可代谢4-甲基吡嗪[27]、乙偶姻[28]等白酒关键风味物质。Weissella为高、中、低温大曲和小曲中的主要细菌之一,可代谢产生乳酸、乙酸等有机酸类,是发酵的启动剂[3]。王雪山[29]研究了清香型白酒发酵环境中微生物种群结构,发现清香型白酒酿造环境中的优势细菌属主要是Bacillus、Weissella等。由此可见,酱香型白酒与清香型白酒酿造环境优势细菌属差异较大,这可能也是导致两种不同香型白酒酒体风格差异的重要原因。
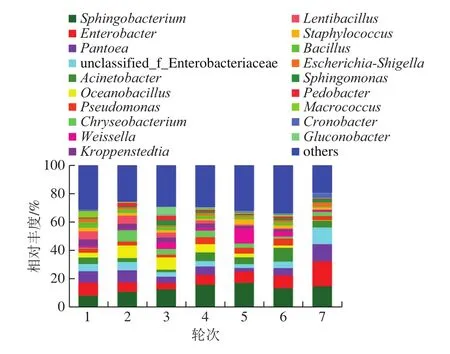
图4 环境样品细菌菌群结构(属水平)Fig.4 Bacterial community structure in environmental samples at the genus level
通过统计分析,发现7 个轮次酿造环境的共有优势细菌属总含量占比为45.55%,说明各轮次酿造环境微生物物种在属水平上具有相对稳定性,同时也表明了酿造环境微生态的差异性更大。由表2可知,7 个轮次酿造环境中的特有优势细菌属为1~5 个属类,1轮次酿造环境中的特有优势细菌属类最多,为5 类,分别是Serratia、Lactobacillus、Thermoactinomyces、Macrococcus、Planomicrobium,而4轮次仅有Corynebacterium;Corynebacterium可利用环境中的碳源发酵产生赖氨酸,而赖氨酸具有防臭保鲜的作用,可能对于改善酒质以及酒的风味能够发挥一定的作用[30]。Serratia在茅台镇空气中检测到,且为秋季样本的优势菌属[9]。Lactobacillus、Thermoactinomyces是白酒酿造过程中重要的功能细菌种群[31],其中,Lactobacillus可为白酒中风味物质提供合成前体[30],而Thermoactinomyces是大曲[32]和酒醅[14]细菌微生物区系中的核心功能细菌微生物类群。
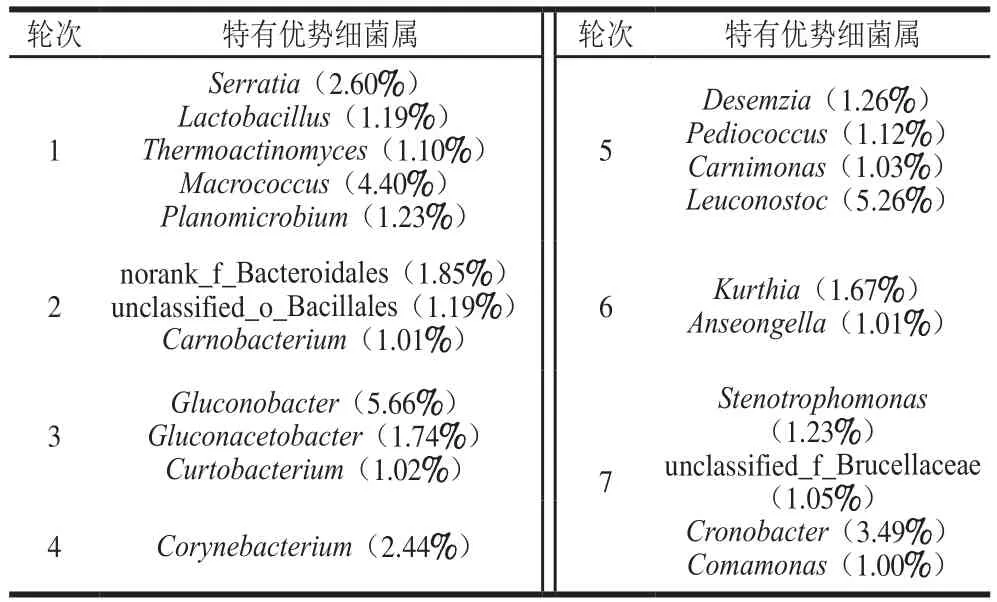
表2 1~7轮次酿造环境样本中特有优势细菌属Table 2 Unique dominant genera in environmental samples from rounds 1–7
上述结论表明,茅台镇酱香白酒各酿造轮次期间酿造环境中的细菌群落在属水平上种类非常丰富,是酱香白酒复杂风味结构形成的关键所在。各轮次之间酿造环境微生物菌群结构多样性特征明显,而且各轮次酿造环境的细菌属结构组成特征差异性大于共性,这也是不同酿造轮次的特征所在。
2.3 酿造环境细菌菌群结构差异性特征
在酱香型白酒实际生产中7 个轮次酿酒产量、质量及风格差异较大,这不仅与1~7轮次的酿造工艺有关,与不同轮次酿造环境微生物结构也紧密相关。解析1~7轮次的细菌菌群结构差异性,拟揭示茅台镇酱香白酒酿造过程各轮次酿造环境微生物的差异性及其特征,为此本研究利用PLS-DA(图5)结合Adonis分析、PERMANOVA分析和ANOSIM分析(表3、4)解析茅台镇各酿造轮次环境样本中细菌菌群结构的差异性特征。
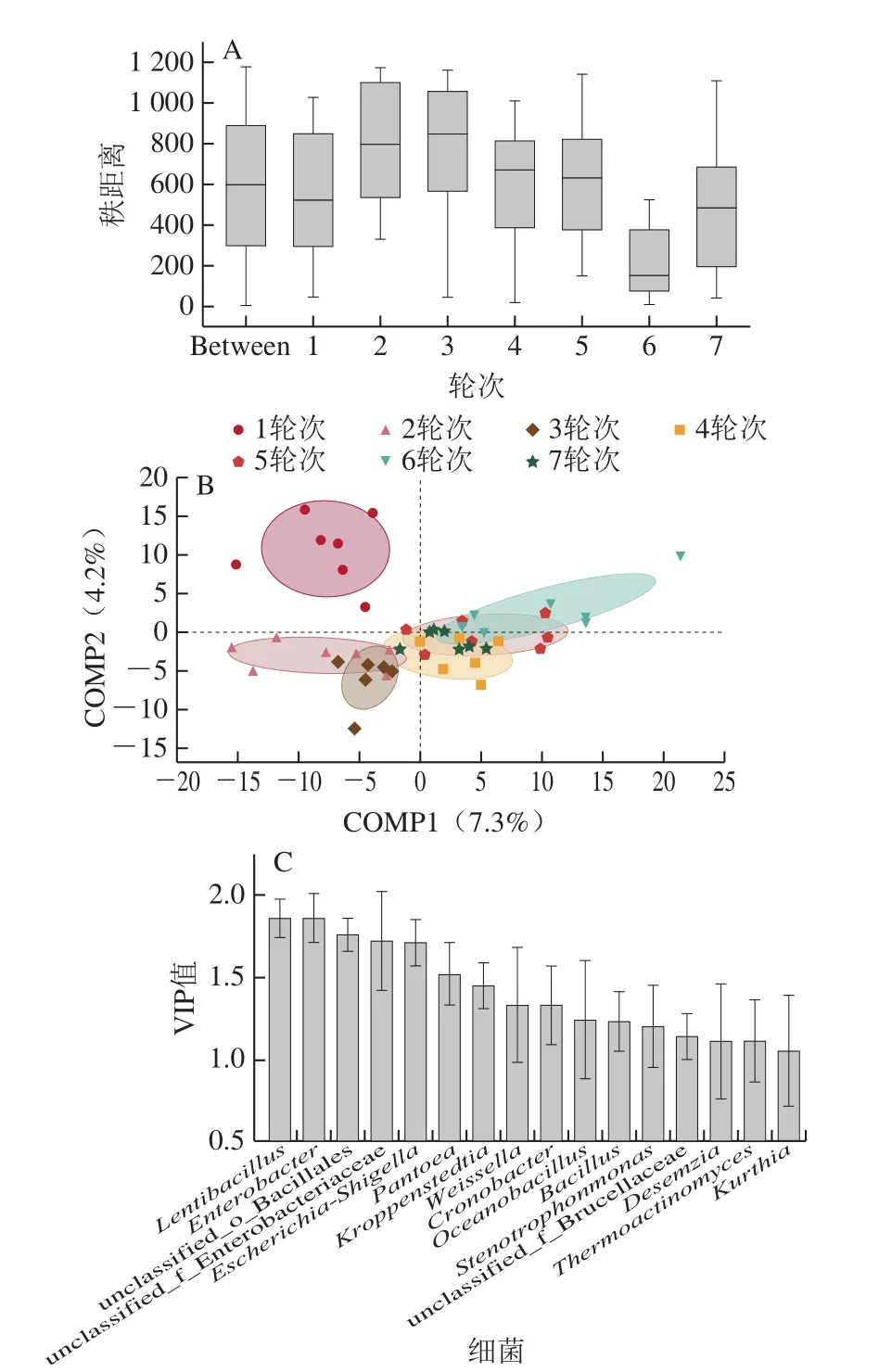
图5 环境样本细菌菌群差异性分析Fig.5 Analysis of the difference in the diversity of bacterial community in environmental samples
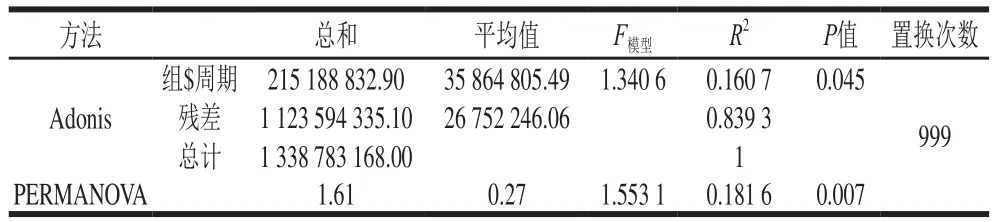
表3 Adonis和PERMANOVA分析结果Table 3 Results of Adonis and PERMANOVA
如图5A所示,茅台镇2018年度酱香白酒7 个酿造轮次酿造环境样本间距离等级的中位数相差较大,说明各轮次细菌菌群结构之间的差异性有统计学意义,而且相互之间的差异性各有不同。结合表3中Adonis和PERMANOVA分析中的P值为0.045、0.007,R2分别为0.160 7、0.181 6,而表4中的ANOSIM分析(P=0.044,R=0.042 1)验证,本次差异性分析可信度高,说明茅台镇酱香白酒各酿造轮次酿造环境中细菌菌群结构之间存在差异性,且组间细菌菌群差异大于组内差异,成为茅台镇酱香型白酒不同酿造轮次产酒、酒质各异的酿造环境微生物原因。
从图5B可明显看出,7 个轮次酿造环境样本细菌菌群结构组间差异性大,组内相似度高,进一步验证了前述聚类分析的结果。1轮次酿造环境样本与其余6 个轮次样本的得分点完全分开,说明1轮次的细菌菌群与其他轮次之间具有较大差异性。原因可能是1轮次酿造时正处寒冬季节,最适生长温度较低的细菌菌群能正常生长繁殖,微生物多样性上多为耐低温型菌群结构,由此菌群特征呈现种类多,优势菌群多且相对丰度较平均的特征[8],从而导致1轮次酿造环境中的细菌菌群种类有别于其他轮次。通过分析还表明茅台镇1~7 个酿造轮次酿造环境中的细菌菌群结构的变化规律。结合图3、4和表2发现,各酿造轮次环境样本在门水平上均无显著性差异,但在属水平上,1轮次酿造环境中特有优势细菌属较其他轮次多,这可能是1轮次与其余轮次细菌菌群结构差异性明显的原因之一,也是受1轮次季节温度、湿度影响的结果。
PLS-DA度量变量对模型的重要性(variable importance in the projection,VIP)值[33](图5C),VIP值越大,说明该菌属越是关键的差异微生物。茅台镇1~7 个酿造轮次酿酒环境样本中呈现显著性差异(1.5>VIP≥1.0)的细菌菌属为Kroppenstedtia、Weissella、Cronobacter、Oceanobacillus、Bacillus、Stenotrophomonas等10 个属。而VIP≥1.5的细菌菌属有Lentibacillus、Enterobacter、unclassified_o_Bacillales、unclassified_f_Enterobacteriaceae、Escherichia-Shigella和Pantoea,表明这6 个属在7 个轮次中具有极显著差异性。上述差异性显著的16 个属在1轮次酿造环境中占了50.02%(10 个属占18.98%,6 个属占30.04%),均高于2~7轮次中任意轮次的相对含量占比,如在4轮次酿造环境中占比为42.45%。
综上所述,茅台镇酱香白酒酿造过程各轮次酿造环境样本之间细菌菌群结构具有差异性,且组间差异大于组内差异,1轮次与其他轮次的差异特征显著性最大,其原因主要有:一是由酿造环境气候条件引起;二是特有优势菌属数量较其他轮次多;三为关键差异微生物在7 个轮次间的相对含量占比各异,且在1轮次酿造环境中占比最大。
3 结 论
对茅台镇酱香型白酒不同轮次的酿造环境中细菌菌群结构多样性及其特征进行了系统研究,并比较分析了各酿造轮次酿造环境间的细菌菌群结构差异性。从1~7 个生产轮次的酿造环境中共检测出19 个细菌门,396 个细菌属,优势细菌门为Proteobacteria、Firmicutes、Bacteroidetes和Actinobacteria;其优势细菌属主要有14 个,分别是Sphingobacterium、Enterobacter、Pantoea、Acinetobacter、unclassified_f_Enterobacteriaceae、Pseudomonas、Escherichia-Shigella、Staphylococcus、Chryseobacterium、Flavobacterium、Oceanobacillus、Kroppenstedtia、Weissella和Bacillus。同时,结合Adonis、PERMANOVA和ANOSIM分析结果表明,不同轮次间的细菌菌群结构存在显著差异性,且各轮次酿造环境间的差异大于轮次内的差异。通过细菌属的PLS-DA,结果表明茅台镇酱香白酒1~7 个生产轮次期间酿造环境间的细菌菌群结构在门水平上无显著性差异,但在属水平上,各轮次酿造环境中的细菌菌群结构具有差异性,且1轮次的酿造环境中的细菌菌群与其他轮次之间存在显著差异性。Kroppenstedtia、Weissella、Cronobacter、Oceanobacillus、Lentibacillus、Enterobacter、unclassified_o_Bacillales、Pantoea、unclassified_f_Enterobacteriaceae和Escherichia-Shigella等16 个细菌属是导致酿造环境各轮次间差异的主要细菌种群。前述结论充分表征了茅台镇7 个生产轮次的酿造环境中细菌菌群结构多样性及其特征,为充分认识茅台镇酱香白酒酿造环境中的细菌菌群结构及酿造机制提供了理论基础,为茅台镇酱香型白酒酿造季节调控、生产工艺调控提供了科学依据。
