不同植物DNA条形码对铁皮石斛鉴定能力的评价
2021-12-03陈文强汪小福陈笑芸徐俊锋
陈文强,汪小福,陈笑芸,彭 城,徐俊锋,蔡 健
(1.浙江省农业科学院,农产品质量安全危害因子与风险防控国家重点实验室,浙江 杭州 310021;2.阜阳师范大学生物与食品工程学院,安徽 阜阳 236037)
铁皮石斛(Dendrobium officinaleKimura et Migo)又称黑节草,为兰科石斛属多年生附生型草本植物,为我国传统珍贵中药材之一,具有滋阴除热、生津养胃等功效[1],主要分布于我国南方地区如浙江、云南、贵州及安徽等地。铁皮石斛含有丰富的多糖、生物素、氨基酸和微量元素,其有效成分具有增强免疫力、抗衰老、抗氧化、降血糖等生物作用[2]。铁皮石斛的自然生长条件较为苛刻,通常位于1 600 m以上海拔的背阳山坡,喜潮喜湿、耐寒能力差[3],生长周期较长,繁殖率低[4]。近代快速繁殖离体培养技术缓解了铁皮石斛野生资源短缺的压力[5],但由于其优良的保健价值及人们对健康生活的追求,使得国内外对铁皮石斛的需求量也逐年增加。在巨大的利益驱动下,市场上出现了利用性状相似的金钗或紫皮石斛等充当铁皮石斛。而石斛种类繁多,形态相似,特别是加工为成品如铁皮枫斗后更加难以区分,造成了目前铁皮石斛市场上“以假乱真”、“以次充好”等混乱现象。严重损害了消费者的正当权益及消费者对铁皮石斛的信用,阻碍了铁皮石斛产业健康可持续性的发展,迫切需要对铁皮石斛建立精准的鉴别方法,以满足其质量控制和市场监管的需要。
目前鉴定铁皮石斛的方法主要包括传统形态学鉴定、理化分析鉴定和DNA分子鉴定方法。传统形态学通过观察铁皮石斛表面及显微切片进行分析[6],需要有较高的鉴别经验,对材料的新鲜度与完整性要求较高,并且缺少明确鉴定铁皮石斛的专属性状特征。理化性质鉴别通过一系列物理、化学分析方法,例如高效液相色谱技术[7]、固相萃取技术[8]以及红外光谱[9]或者紫外光谱法[10]等对铁皮石斛中所含成分进行分析,获取其中具有鉴别价值的理化性质。其缺点是仪器费用高、材料前处理不易控制且微量分离鉴定效果不明显。
DNA分子鉴别常用的有DNA分子标记技术和DNA条形码技术等[11]。DNA条形码技术是利用基因组中一段标准的、相对较短的DNA片段进行物种鉴定的分子鉴定新方法。目前,DNA条形码技术在发现新物种和辨别混乱或错误物种方面应用颇多,线粒体基因细胞色素C氧化酶COI基因片段作为动物分类鉴定的通用DNA条形码[12],COI对真菌和藻类也有较高的分辨率,但植物的线粒体基因进化速率慢,因而COI不适合植物的物种鉴定。在植物方面,2009年,国际生命条形码联盟(Consortium for the Barcode of Life,CBOL)推荐使用叶绿体基因片段rbcL和matK作为植物通用的DNA条形码[11]。近年来,更多的叶绿体基因及核基因片段被用作植物的DNA条形码。
许多学者开展了利用DNA条形码对铁皮石斛鉴定的研究。如付涛等[13]基于叶绿体DNA条形码鉴定铁皮石斛种质资源,认为rbcL和matK可作为鉴定铁皮石斛的候选序列;丁小余等[14]对ITS全序列构建数据库,并对序列进行分析,发现利用ITS序列可以成功鉴别石斛类的待检品种;邵世光等[15]对石斛中trnH-psbA序列进行分析,发现trnH-psbA在不同石斛种间均存在差异,可用作石斛分子的鉴定;杨培[16]利用psbK-psbI对34 份石斛属样品进行检测,成功鉴定出未知待检样品的品种。
目前研究多是利用一个或少数几个DNA条形码对石斛进行鉴定或分类,有待全面和深入研究。本研究选择目前常用的9 种植物DNA条形码(ITS2、nad1、matK、ycbL、psbK-psbI、trnL-trnF、trnG-trnS、rbcL和trnH-psbA),分别从扩增性、遗传分化距离、序列特征分析等方面,全面系统地解析不同植物DNA条形码对铁皮石斛的鉴定能力,以期为铁皮石斛鉴定选择合适的DNA条形码提供分子依据和参考。
1 材料与方法
1.1 材料与试剂
本研究采集到浙江省、安徽省、云南省以及广西壮族自治区4 个地区25 份铁皮石斛鲜样和10 种不同种石斛属鲜样,共计35 份样品,并由浙江省农业科学院于国光副研究员鉴定为相应的石斛材料。材料信息详见表1。

表1 铁皮石斛及其近缘属材料信息Table 1 Information about leaf and stem samples of D.officinale and its related species
75%乙醇、琼脂糖、TAE缓冲液50×、DNA Marker DL2000 生工生物工程(上海)股份有限公司;液氮、植物总DNA提取试剂盒 杭州新景生物有限公司;Prime STAR®HS Premix 宝日医生物技术(北京)有限公司;引物均由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
Nanodrop 2000核酸蛋白分析仪 美国Thermo公司;96 孔超速梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;凝胶电泳仪 美国GE公司;全自动凝胶成像仪 上海嘉鹏科技有限公司。
1.3 方法
1.3.1 DNA提取
将选取的石斛组织(鲜叶、茎)用75%乙醇溶液擦拭,保存至-80 ℃备用。称取100 mg石斛样品,用液氮研磨,然后通过植物总DNA提取试剂盒方法提取石斛总DNA。使用Nanodrop 2000核酸蛋白分析仪检测所提DNA浓度及纯度,通过1%凝胶电泳判定DNA质量。稀释至均一浓度后放入-20 ℃保存备用。
1.3.2 PCR扩增及产物测序
查阅文献并结合前期实验选定9 种常用植物DNA条形码及其引物序列(表2),对所有DNA样本进行PCR扩增。采用25 μL PCR扩增体系,包括12.5 μL Prime STAR®HS Premix、上下游引物1 μL(10 mmol/L)、DNA模板2 μL(约40 ng)、ddH2O 8.5 μL。PCR扩增产物用琼脂糖凝胶进行电泳检测后,将得到的单一、明亮条带,经胶回收后送生工生物工程(上海)股份有限公司进行双向测序。

表2 DNA条形码引物信息及来源Table 2 Primer sequences and reaction conditions used for amplification of DNA barcodes
1.3.3 生物信息学分析
利用Chromas3.0软件对序列峰图进行查看,并判断测序结果是否理想。对于测序成功获得的序列,采用ClustalW软件,将测序两端无用序列删除,采用NCBI(National Center for Biotechnology Information)平台的BLAST工具与数据库进行比对。利用MEGA6.0软件进行序列比对,分析测得核酸序列的长度、核苷酸组成、进行序列比对、变异位点分析。扩增率为实验引物与所有待实验石斛材料总DNA进行扩增,成功扩增材料与总研究材料之比。变异率为序列中所含变异位点与序列总碱基含量之比。种内遗传距离的计算和系统发育邻接(Neighbor-Joining,NJ)进化树的构建利用的是K2P(Kimura 2-parameter)模型,Bootstrap的次数设为1 000 次,并自动删除小于50%的数值,确定每个分支的支持率不小于50%,可判断正确鉴定到种。利用SPSS 20.0中的Wilcoxon秩和检验对单片段DNA条形码序列种间与种内遗传距离进行评价,筛选出铁皮石斛资源鉴定的DNA条形码。
本研究序列分析软件主要为Chromas3.0和ClustalW;遗传距离计算与NJ进化树构建则使用MEGA6.0;统计分析软件为SPSS20.0;绘图所使用软件为Microsoft Office的Excel和PowerPoint。
2 结果与分析
2.1 序列测定与比对
9 条DNA条形码序列在35 份石斛属植物共得315 条序列。将所得序列均通过NCBI进行BLAST相似性检验。将比对的结果进行分类总结,测序所得序列与NCBI数据库中已知的11 种石斛属序列的同源性为100%(相应的序列号见表3),对比结果也说明本实验的测序结果可靠准确。

表3 测序与GenBank对比DNA条形码序列信息Table 3 Sequencing of DNA barcodes and comparison with GenBank sequences
2.2 不同条形码特征分析
不同植物DNA条形码序列的具体特征信息见表4。结果显示,不同DNA条形码的序列全长介于456~809 bp之间,trnG-trnS片段序列最长,平均为775 bp,ITS2基因序列最短,平均为457 bp。9 种DNA条形码序列GC含量介于24.1%~57.9%,其中ITS2基因GC含量最高,平均为53.8%,trnG-trnS片段序列GC含量最低,平均为24.5%。考察各DNA条形码的引物在不同材料中的扩增率,其中matK序列扩增率为91.4%,大包鞘石斛和束花石斛没有得到扩增,可能是这2 个材料中的matK序列有变异或进化。其余8 条DNA条形码扩增率均为100%;9 条DNA条形码的测序成功率均为100%。变异率反映序列的变异程度,其中ITS2、trnL-trnF和trnG-trnS的变异率较高,均超过20%,说明这些序列进化速率较快。
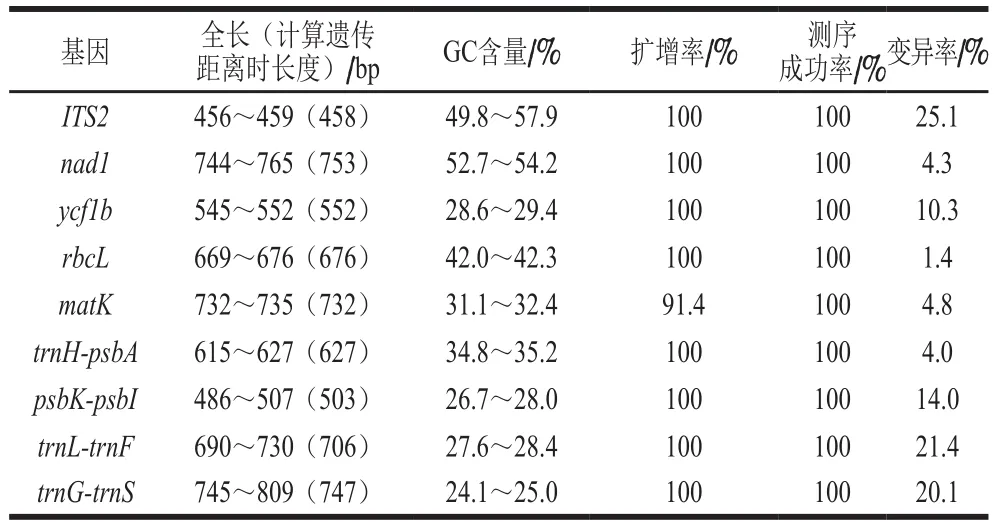
表4 不同DNA条形码基本特征信息Table 4 Basic characteristics of DNA barcode sequences
2.3 DNA条形码遗传距离分析
DNA条形码应具有足够小的种内变异与明显的种间变异,在遗传距离上即要求种内差异最大值小于种间差异最小值。对11 种石斛属的9 条DNA条形码序列进行种内与种间遗传距离计算(表5)。结果显示,在铁皮石斛种内,nad1、matK、psbK-psbI、trnG-trnS的序列没有变异,其在铁皮石斛种内遗传距离为0。种内遗传距离大小顺序为rbcL>ITS2>trnH-psbA>trnL-trnF>ycf1b。石斛属种间遗传距离统计结果显示,ITS2的种间遗传距离最大,平均为0.074 4,nad1的种间遗传距离最小,平均为0.004 5。种间遗传距离大小顺序为ITS2>trnG-trnS>trnL-trnF>psbK-psbI>ycf1b>rbcL>matK>trnH-psbA>nad1。其中,rbcL与trnH-psbA种内最大遗传距离大于种间最小遗传距离,不符合DNA条形码对遗传距离的要求,其余条形码种内最大遗传距离小于种间最小遗传距离。
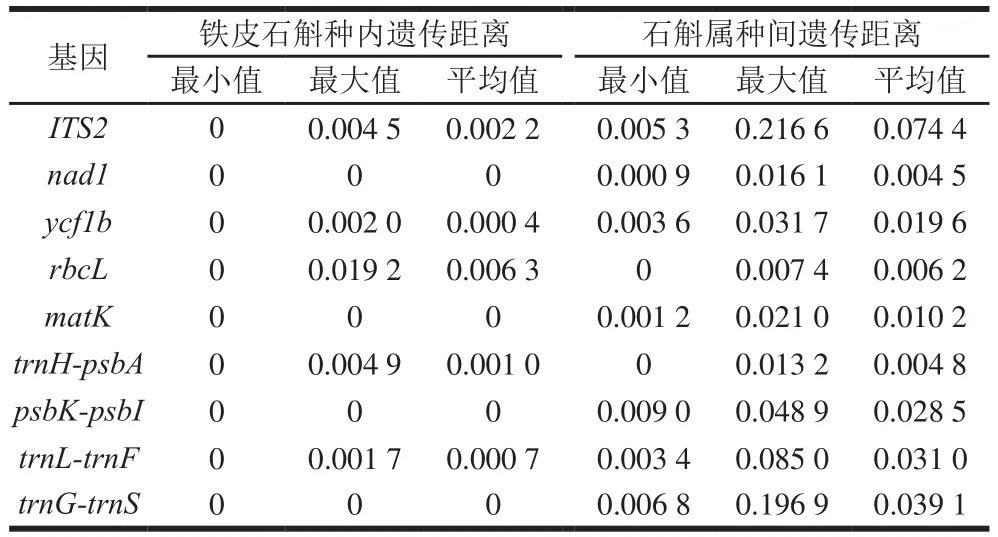
表5 种内、种间遗传距离Table 5 Genetic distances within and between species
进一步利用种内与种间K2P遗传距离得到“barcoding gap”分布图(图1),ITS2、nad1、matK、ycf1b、psbK-psbI、trnL-trnF、trnG-trnS基因及片段序列存在“barcoding gap”,有小部分重叠。ycf1b、matK、nad1与psbK-psbI序列遗传距离分布频率在图中整体分布呈正态分布向种内方向倾斜;ITS2、trnL-trnF及trnG-trnS序列种内变异差异和样本分布的比例明显较小,而品种间的样本分布和变异差异明显较大,有利于铁皮石斛资源的鉴定。而rbcL与trnH-psbA序列不存在“barcoding gap”且品种间和品种内变异重合,不适合用于铁皮石斛资源的鉴定。
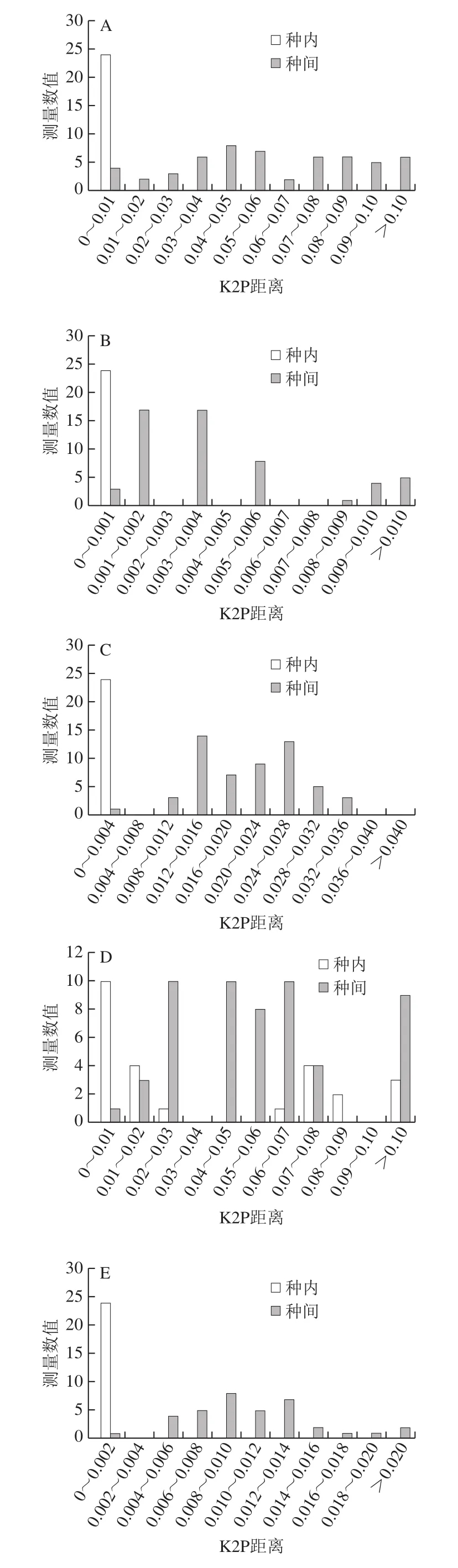
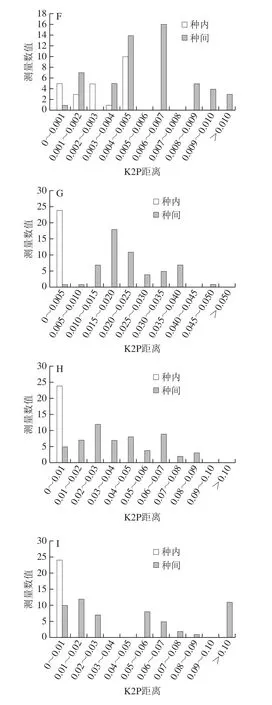
图1 不同DNA条形码种内和种间K2P距离分布图Fig.1 Distribution of interspecific and intraspecific K2P distances of different DNA barcodes
2.4 不同序列变异的Wilcoxon秩和检验
根据遗传变异分化的不同,采用SPSS 20.0统计软件对7 条候选DNA条形码序列遗传距离进行种间Wilcoxon秩和检验(表6),分析两两序列种间的变异情况作为筛选候补DNA条形码的一个指标。根据P<0.05为显著性差异的原则,ITS2序列的检验值最大,其余序列种间距离变异差异大小顺序为ITS2>trnL-trnF>trnG-trnS>psbK-psbI>ycf1b>matK>nad1,与种间变异分析结果一致。
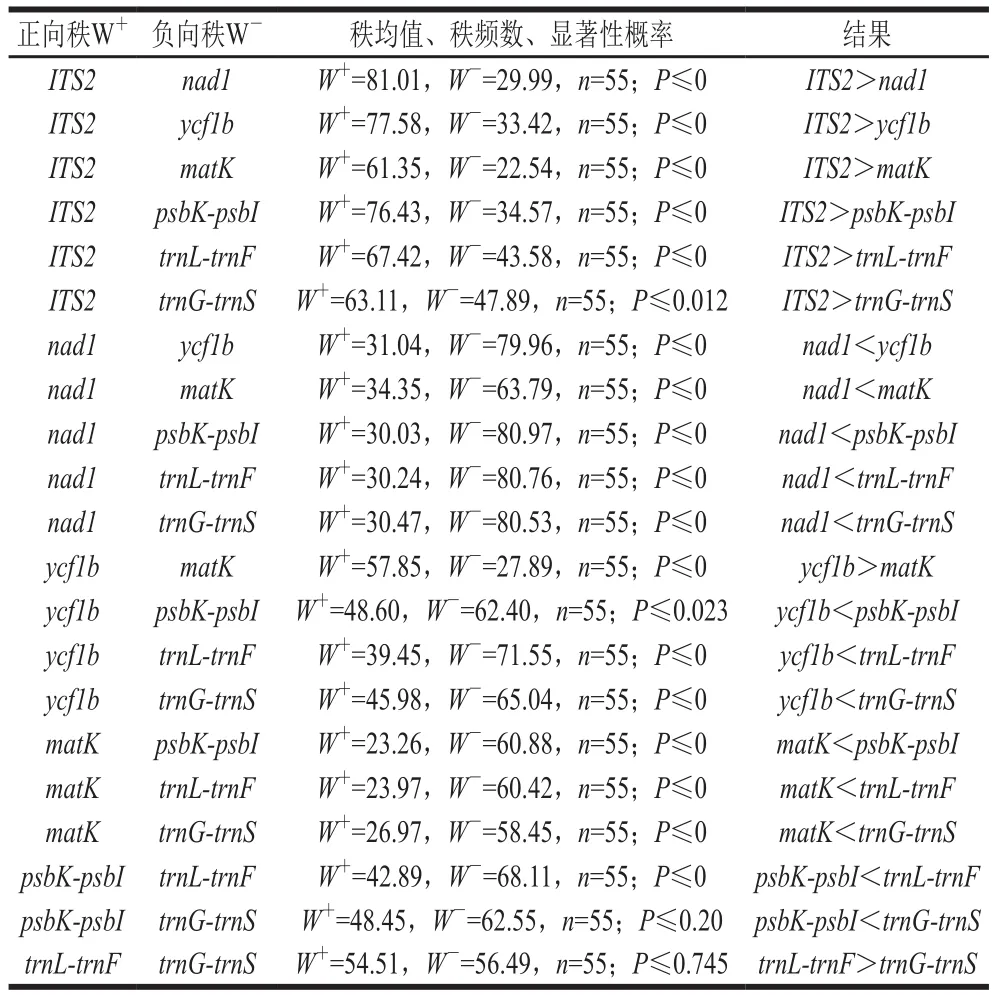
表6 不同序列变异的Wilcoxon秩和检验Table 6 Wilcoxon rank sum test of different sequence variations
2.5 DNA条形码鉴定分析
DNA条形码分辨率是判断选择的条形码是否合适的标准之一。通过NJ进化树个体聚成一支且支持率不小于50%可认为鉴定成功。9 条DNA条形码对本实验中石斛属材料的NJ聚类分析如图2所示。ITS2、ycf1b、psbK-psbI以及trnL-trnF序列可将铁皮石斛资源以近似50%的支持率,单独聚为一支;其余3 种未能得到较好的区别,nad1序列将重唇石斛、鼓槌石斛、钩状石斛等7 种与铁皮石斛聚为一支,matK序列将铜皮石斛、肿节石斛、重唇石斛等5 种与铁皮石斛聚为一支;trnG-trnS序列将金钗石斛、喇叭唇石斛、重唇石斛等6 种与铁皮石斛聚为一支。7 条DNA条形码对铁皮石斛的分辨率见表7。其中,nad1序列分辨率最低,为36.3%,ITS2与trnL-trnF序列分辨率最高,为90.1%。根据实验结果,推荐使用ITS2和trnL-trnF序列作为铁皮石斛资源鉴定的DNA条形码。
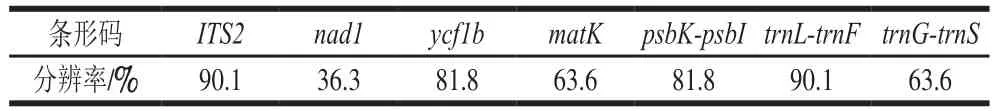
表7 石斛属种间分辨率Table 7 Interspecific identification rates of Dendrobium

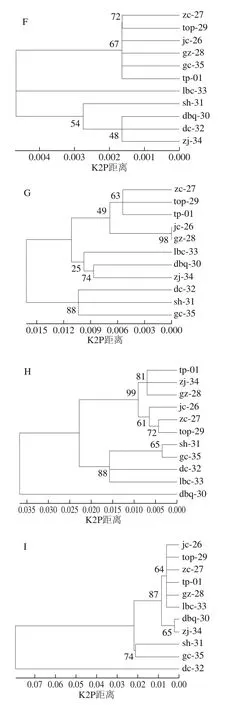
图2 基于多条DNA条形码构建的NJ树Fig.2 NJ trees constructed based on multiple DNA barcodes
进一步,将ITS2和trnL-trnF2个片段组合,进行NJ进化树的构建(图3)。通过NJ树个体聚成一支且支持率≥50%可认为鉴定成功。图3中每个分支的支持率均超过50%,11 种石斛都能成功鉴定。推荐使用ITS2+trnL-trnF组合序列作为铁皮石斛资源鉴定的DNA条形码。
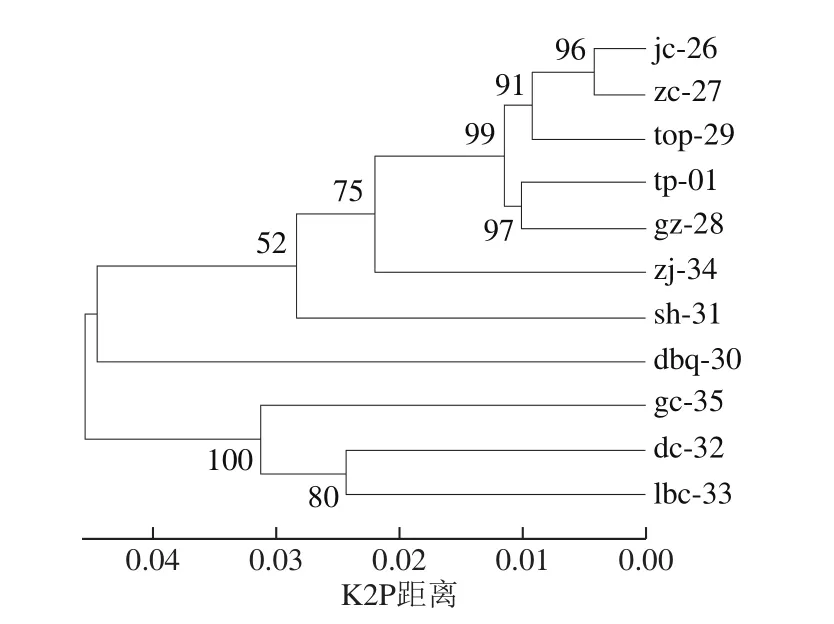
图3 基于ITS2+trnL-trnF组合DNA条形码构建的NJ树Fig.3 NJ tree constructed based on ITS2 combined with trnL-trnF
3 讨 论
DNA条形码技术由于其受环境条件或材料品质等影响较小,所需样品量少、鉴定准确性高、方便快速等优点,被广泛应用到铁皮石斛的鉴定[21]。目前,应用到植物鉴定和分类的DNA条形码有很多,主要为叶绿体的基因片段,叶绿体基因的间隔区,还有来源核基因片段。本研究选择了目前比较常用的植物DNA条形码,其中叶绿体基因片段为rbcL、ycf1b、matK,叶绿体基因的间隔区trnH-psbA、psbK-psbI、trnL-trnF、trnG-trnS,ITS2为核基因片段,nad1则为线粒体基因。主要从通用性和分辨率等方面探讨它们对铁皮石斛鉴定的适合程度。
在通用性方面,主要比较了9 种DNA条形码的扩增性和测序成功率。整体而言,通用性都比较强,其中matK扩增率91.4%,相较与其他条形码,其通用性稍差。之前就有报道,matK基因虽然是叶绿体基因组编码蛋白中进化最快的基因,但其引物通用性一直饱受争议[22]。DNA条形码的扩增性直接影响其应用范围和效果。如果一个DNA条形码其扩增性不强,通用性比较低,即使它的分辨率很高,也很难得到推广和应用[23]。为了提高条形码的通用性,一般选择扩增效率高的引物,及更短的片段,即微型DNA条形码,这种微型DNA条形码更适合DNA受到降解或DNA难以提取样品的鉴定[24]。
本研究对DNA条形码序列测序、校正,计算遗传分化距离,并利用Wilcoxon秩和检验和建立NJ树等分析方法,评价它们对铁皮石斛及其他石斛的分辨能力。虽然rbcL和trnH-psbA在植物类鉴别与分类中经常使用[25],但在本实验中,它们在铁皮石斛种内的最大遗传距离却大于其他石斛种间的最小遗传距离,不适合用于铁皮石斛与其近缘石斛之间的鉴定。另外7 条DNA条形码满足种内最大遗传距离小于种间最小遗传距离的要求,初步判定可作为鉴定铁皮石斛的候选条形码。其中,nad1基因序列所含的变异位点少,进化速度慢,对本实验中石斛材料的分辨率为36.3%。丁鸽等[17]利用nad1序列研究金钗石斛和其混合品亲缘关系时,也发现该序列变异程度不高。进一步体现了植物线粒体基因进化速度慢的事实,在选择此类基因作为DNA条形码时更需要筛选和验证。trnG-trnS片段序列在石斛属中变异程度相对较大,但存在很多碱基的插入/缺失,过多的插入以及缺失不利于序列比对,导致鉴定准确率和效率低[20]。Ycf1b与psbK-psbI序列对于金钗石斛和钩状石斛的鉴定效果不理想,但这两种石斛是市场上与铁皮石斛混淆最为严重的亲缘种[26]。ITS2和trnL-trnF序列对本研究中的石斛材料的分辨率最高,都达到了90.1%,但都还无法做到100%的分辨。这与丁小余等[14]利用ITS2进行石斛类鉴定成功率不同,可能由于所选取的材料数量与种类不同,鉴定结果计算也大不相同。李海霞[27]同样基于ITS2序列分析了多种石斛属种间鉴别,得出有部分石斛由于序列分析混乱,也无法做到利用ITS2均可成功鉴定。有关trnl-trnF序列片段进行石斛类鉴定的研究较少,邢文瑞[28]利用trnL-trnF序列片段构建NJ进化树,得到石斛属种间鉴定效果良好,但也无法满足单一DNA条形码鉴定。因此在利用DNA条形码对植物材料进行鉴定或分类时,推荐多条DNA条形码组合使用,从而提高分辨率。本实验推荐ITS2+trnL-trnF序列作为铁皮石斛及其近缘种鉴定的条形码组合。ITS2序列片段位于核糖体DNA变异较大的基因转录间隔区,同时具有较高的拷贝数与较快的进化速率[29]。trnL-trnF基因片段位于叶绿体基因非编码区的大单拷贝区,约为600~1 400 bp,因为进化速率较快,适合作为DNA条形码[30]。一方面这两个条形码的分辨率高,另一方面,ITS2为核基因组条形码,trnL-trnF为叶绿体条形码,这两个不同来源的基因片段可能在不同的类群中存在不同的分辨率,两者的结合,则有效提高分辨率。ITS2+trnL-trnF的组合能对本实验中所选的11 种石斛属材料进行鉴定,然而我国石斛种类有70 多种,ITS2+trnL-trnF的组合是否适合更多石斛材料的鉴别,还需要进一步研究。
4 结 论
本研究比较分析了9 种常用植物DNA条形码对11 种石斛属材料的鉴别能力,9 种条形码的扩增性及通用性良好,不同条形码对所测试石斛属材料的鉴别能力有差异,其中ITS2序列和trnL-trnF片段序列的鉴定能力最高,分辨率均达到90.1%。将ITS2序列和trnL-trnF序列相结合,对所用石斛属材料达到了100%鉴定,推荐推荐使用ITS2+trnL-trnF组合作为铁皮石斛资源鉴定的DNA条形码。
