对羟基苯甲醛和阿魏酸对酿酒酵母理化特性的影响
2021-12-03安佳星龙秀锋伍时华曾令杰黄锦翔丰丕雪
安佳星,龙秀锋,伍时华,曾令杰,黄锦翔,丰丕雪,易 弋
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西 柳州 545006)
由于化石能源在使用过程中引起的环境问题,使绿色生物能源越来越受到人们的关注。燃料乙醇作为一种重要的清洁可再生能源,以其循环经济、环境友好等优点,已迅速发展成为全球可再生能源领域的战略性新兴产业[1]。但国内大部分地区主要以玉米、甘蔗等粮食作物为原料生产燃料乙醇[2],而这些作物的供应有限,会导致燃料乙醇生产与粮食供应之间产生竞争。木质纤维素[3]主要由纤维素、半纤维素和木质素构成,是世界上储量最丰富的碳水化合物资源,若将木质纤维素用于生产燃料乙醇,将更有利于节约经济成本,实现可持续发展[4]。在以木质纤维素为原料的燃料乙醇生产过程中,经预处理和水解尽管提高了木质素的降解率[5-6],增加了纤维素和半纤维素的含量,但也产生了大量的抑制物,如弱酸类、呋喃类、酚类化合物,这些物质的存在会对酵母生长造成一定影响[7]。
对羟基苯甲醛(p-hydroxybenzaldehyde,pb)和阿魏酸(ferulic acid,fer)是木质纤维素水解液中的主要酚类化合物,其毒性作用强于水解液中的其他酚类抑制物。为探明这两种抑制物对酿酒酵母的毒性,通过测定pb和fer处理后酿酒酵母的生长情况、细胞形态、细胞膜通透性、海藻糖含量、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析等,初步了解抑制物对酿酒酵母的破坏程度,以期为揭示pb和fer对酿酒酵母的毒性机理以及培育耐受性菌株提供依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)GGSF16由广西科技大学发酵工程研究所提供;pb、fer、醋酸钡、间苯二酚、硫脲 上海麦克林生化科技有限公司;D-海藻糖、蒽酮 北京索莱宝科技有限公司;三氯乙酸西陇科学股份有限公司;戊二醛 天津市科密欧化学试剂有限公司;所有溶剂均为国产分析纯。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH值自然,115 ℃灭菌20 min。
发酵培养基:葡萄糖50 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH值自然,115 ℃灭菌20 min。
1.2 仪器与设备
Alpha1-2LDplus真空冷冻干燥机 德国Christ公司;456-GC气相色谱仪 天美创科仪器(北京)有限公司;SBA-40E生物传感分析仪 济南延和生物科技有限公司;Phenom飞纳台式扫描电镜 复纳科学仪器(上海)有限公司;PerkinElmer FTIR仪(Frontier)兴和仪器(上海)有限公司;UV-8000S紫外-可见分光光度计 上海元析仪器有限公司;H2100R低温高速离心机 湖南湘仪离心机仪器有限公司;HH系列数显恒温水浴锅 金坛市科析仪器有限公司;LDZH-100KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;ZWYRC2402C叠式恒温调速摇床 上海智诚分析仪器制造有限公司。
1.3 方法
1.3.1 酵母菌菌悬液制备
从YPD平板上挑取酿酒酵母GGSF16单菌落到YPD培养基中,30 ℃、160 r/min摇床振荡培养活化,调整菌液浓度为108CFU/mL,备用。
1.3.2 pb和fer对细胞生长的影响
按10%接种量,将酵母菌菌悬液接种到200 mL发酵培养基中,在无菌操作下将pb和fer加到发酵培养基中,分别制成0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0 g/L质量浓度梯度,以未添加pb和fer的菌液为对照组,30 ℃、160 r/min培养,测定样品在600 nm波长处OD值,每隔2 h测一次,以时间为横坐标,OD值为纵坐标绘制生长曲线。
1.3.3 pb和fer对糖代谢和乙醇发酵的影响
按照1.3.2节方法,将pb和fer分别制成1.0 g/L和1.25 g/L质量浓度,以未添加pb和fer的菌液为对照组,30 ℃、160 r/min培养,每隔2 h取上清液,适当稀释,用生物传感分析仪测定发酵过程中葡萄糖质量浓度,用气相色谱仪测定发酵过程中乙醇质量浓度,实验重复3 次。
1.3.4 pb和fer对细胞膜通透性的影响
按10%接种量,将酵母菌菌悬液接种到100 mL发酵培养基中培养8 h,将100 mL菌液(菌液浓度107CFU/mL)加入含有pb和fer的100 mL发酵培养基中,使pb和fer的终质量浓度分别为1.0 g/L和1.25 g/L。30 ℃、160 r/min培养4 h,5 000 r/min离心10 min,参考Dai Chunhua等[8]方法,分别在260 nm和280 nm波长处测定上清液OD值,表示核酸和蛋白质含量,实验重复3 次。
1.3.5 pb和fer对胞内海藻糖含量的影响
1.3.5.1 海藻糖标准曲线
配制0.1 mg/mL的海藻糖母液,稀释成0.01~0.09 mg/mL海藻糖标准液,以水为空白对照。每个样品取1 mL于具塞比色管中,加入5 mL硫酸-蒽酮试剂,混匀后沸水浴10 min,立即放入冰水浴中冷却,测定样品的OD620nm。
1.3.5.2 胞内海藻糖含量的测定
按照1.3.4节方法,取两份培养液各5 mL,5 000 r/min离心10 min,弃上清液,沉淀用水洗涤3 次,其中一份烘干称质量,另一份加入4 mL 0.5 mol/L三氯乙酸溶液重悬菌体,冰浴1.5 h,期间每隔15 min上下颠倒混匀,萃取结束后10 000 r/min离心5 min,取上清液1 mL,加入5 mL硫酸-蒽酮试剂,混匀后置于沸水浴10 min,立即放入冰水浴中冷却,测定OD620nm,实验重复3 次。
1.3.6 分子结构的FTIR分析
采用FTIR法[9]对酵母分子结构的变化进行分析,按照1.3.4节方法获得培养液,5 000 r/min离心10 min,弃上清液,用0.01 mol/L磷酸盐缓冲液清洗3 次,真空冷冻干燥后用FTIR仪对干燥酵母细胞进行分析。
1.3.7 扫描电子显微镜观察
参考文献[10-11]方法,观察酵母菌在pb和fer胁迫下的细胞形态变化。按照1.3.4节方法获得培养液,5 000 r/min离心10 min,弃上清液,向沉淀细胞中加入2.5%戊二醛溶液1 mL,4 ℃过夜固定,5 000 r/min离心10 min收集菌体,用20%~100%的乙醇溶液脱水处理,5 000 r/min离心10 min收集菌体,真空冷冻干燥后喷金,用扫描电子显微镜观察酵母菌的形态变化。
1.4 数据统计与分析
采用Origin Pro 9.1软件(单因素方差分析)和Graphpad Prism 8.0.1软件对数据进行显著性分析和图表的绘制。
2 结果与分析
2.1 pb和fer对细胞生长的影响
由图1可以看出,对照组的酵母生长速率较高,在开始的8 h内迅速生长,之后趋于稳定,而从图1A可以看出,随着pb质量浓度的增加,对酿酒酵母的抑制作用越来越明显,当pb质量浓度为2.0 g/L时,酿酒酵母的生长被完全抑制,为保证后续的分析,选取pb质量浓度为1.0 g/L。如图1B所示,fer质量浓度不高于1.5 g/L时,对数生长期延长[12-13],在稳定期的OD值比对照组低,但酿酒酵母的生长曲线没有产生很明显的分离现象,而当fer质量浓度高于1.75 g/L时,酿酒酵母的OD值突然降低,说明fer质量浓度在1.75 g/L以上时,酵母的生长会受到明显的抑制,由图1B也可以看出,fer质量浓度在2.0 g/L时,酿酒酵母的生长被完全抑制,为保证后续的分析,选取fer质量浓度为1.25 g/L。
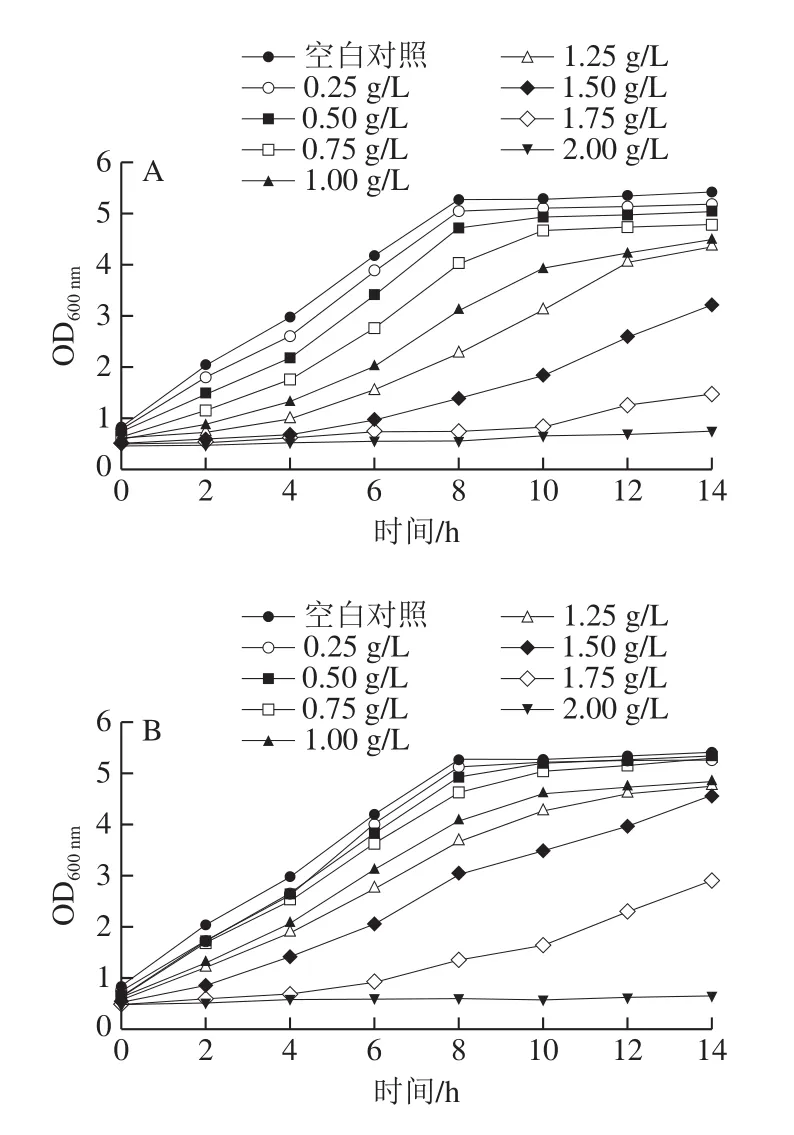
图1 pb(A)和fer(B)对酿酒酵母生长的影响Fig.1 Effects of p-hydroxybenzaldehyde (A) and ferulic acid (B) on the growth of S.cerevisiae
2.2 pb和fer对酿酒酵母糖代谢及乙醇含量的影响
酿酒酵母利用葡萄糖可以产生乙醇,而pb和fer的添加会抑制酵母菌的生长从而抑制葡萄糖的消耗及乙醇的生成。由图2可知,对照组在6~10 h葡萄糖消耗较快,第12小时葡萄糖基本消耗完全,乙醇在6~10 h产量较多,并在第12小时趋于平缓。而在酿酒酵母中添加1.25 g/L fer后葡萄糖消耗延迟为6~12 h,14 h葡萄糖基本消耗完全,乙醇的快速生成延迟为6~12 h,之后乙醇生成缓慢增长,基本达到对照组的乙醇产量。当在酿酒酵母中添加1.0 g/L pb后葡萄糖消耗延迟为6~16 h,16 h葡萄糖基本消耗完全,乙醇在6~16 h呈指数形式快速产生,并在第16小时基本达到对照组乙醇含量。因此,1.25 g/L的fer对细胞抑制作用略低于1.0 g/L的pb。
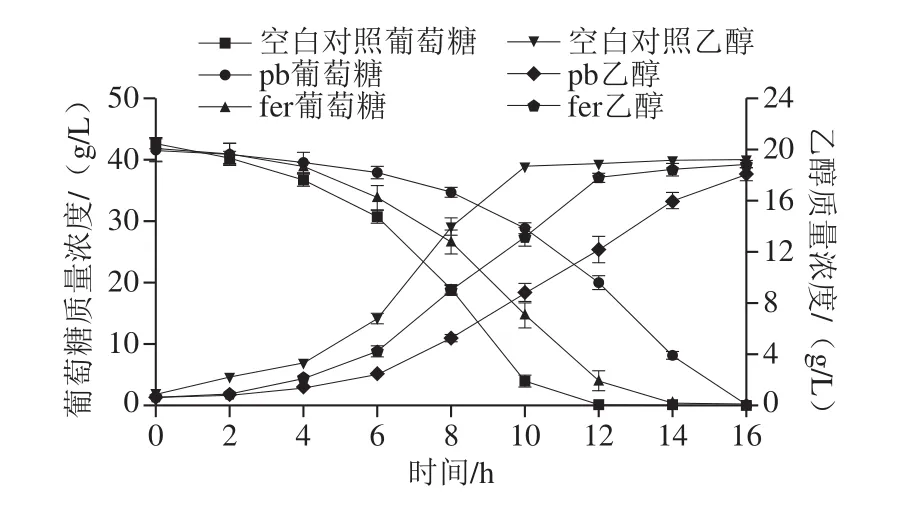
图2 pb和fer胁迫下酿酒酵母葡萄糖含量及乙醇产量变化曲线Fig.2 Changes in glucose content and ethanol production of S.cerevisiae under p-hydroxybenzaldehyde or ferulic acid stress
2.3 pb和fer对酿酒酵母细胞膜通透性的影响
从表1可以看出,与对照组相比,pb处理后酿酒酵母的核酸和蛋白质释放量分别增加58.1%和37.6%,fer处理后酿酒酵母的核酸和蛋白质释放量分别增加47.7%和12.0%,通过比较发现,OD260nm比OD280nm增加更为明显,可能是因为核酸的相对分子质量比蛋白质小,核酸比蛋白质更容易透过细胞膜。
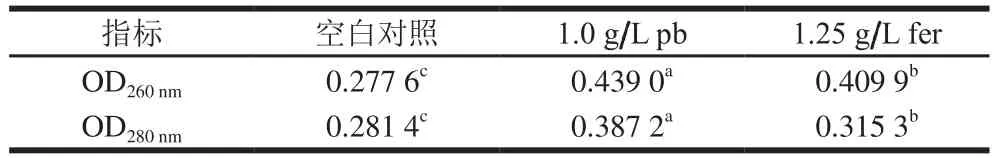
表1 胞外DNA和蛋白质含量Table 1 Effect of p-hydroxybenzaldehyde and ferulic acid on extracellular DNA and protein contents of S.cerevisiae
2.4 pb和fer对胞内海藻糖含量的影响
由图3可以看出,与对照组相比,加入1.0 g/L pb和1.25 g/L fer在第0小时海藻糖含量没有显著变化;在第4小时海藻糖含量明显增多,经pb处理后比对照组的海藻糖含量高约34.4%,fer处理后比对照组的海藻糖含量高约16.9%,可能原因是经pb和fer处理后,酵母细胞为应对外界环境的压力,从而产生大量的海藻糖[14]。通过对比pb和fer处理后细胞的海藻糖含量变化,发现pb处理后的海藻糖含量比fer处理后的海藻糖含量高约15.0%,可能原因是pb对酵母的生长抑制比例比fer大,因此,pb处理后比fer处理后的胞内海藻糖含量多。
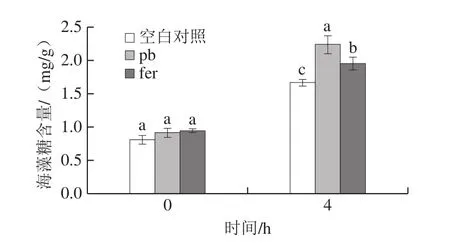
图3 pb和fer对酿酒酵母海藻糖含量的影响Fig.3 Effects of p-hydroxybenzaldehyde and ferulic acid on intracellular trehalose content of S.cerevisiae
2.5 FTIR分析
根据前人的研究结果[15-17],3 700 cm-1与3 000 cm-1之间有一较宽的吸收带,是由于几丁质中的羟基和仲胺中的N—H的伸缩振动引起;3 100~2 800 cm-1吸收峰为三酰基甘油中的脂肪酸酰基链CH2的拉伸,代表脂质官能团;表征蛋白质最重要的谱带是酰胺带[18],1 652、1 542、1 244 cm-1分别为酰胺I、II、III带,其中1 652 cm-1吸收峰是C=O的伸缩振动引起的,1 542 cm-1吸收峰是N—H变形振动和C—N伸缩振动的耦合振动峰,1 244 cm-1吸收峰是由N—H弯曲振动和C—N伸缩振动引起,是蛋白质的特征谱带;1 078 cm-1左右的吸收峰为酵母中DNA、RNA、细胞壁中存在的碳水化合物或醇中的C—O伸缩振动峰;915 cm-1左右的吸收峰代表细胞壁多糖环键。
由图4可知,与对照组相比,经pb和fer处理后酿酒酵母的特征峰变化较明显,特征峰吸光度整体呈现增强趋势,在3 315 cm-1处吸收峰面积增加,表明pb和fer改变了细胞壁中几丁质的结构,使细胞的身体骨架发生改变,不能正常保护细胞;代表脂质的官能团在3 002 cm-1和2 930 cm-1处的吸光度均明显增强,表明pb和fer改变酰基链—CH2—的拉伸,从而对酵母细胞膜的脂质产生破坏;在酰胺I带峰的吸收强度有所增加,表明蛋白质二级结构中α-螺旋或无规卷曲增加,酰胺II带峰的吸收强度增加,表明蛋白质分子间或分子内的氢键缔合作用加强,而蛋白质是细胞壁、细胞膜的主要成分之一,因此,通过改变蛋白质的结构进而对酵母细胞壁和细胞膜产生影响;在1 072 cm-1处的吸光度明显增强,说明pb和fer改变了核酸的结构;在914 cm-1处的吸收峰明显增强,表明pb和fer改变了酿酒酵母表面的多糖羟基骨架,进而改变酵母细胞壁的结构。
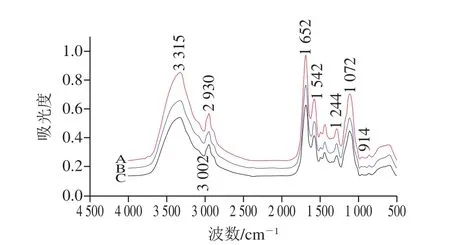
图4 pb和fer处理后FTIR图Fig.4 FTIR before and after treatment with p-hydroxybenzaldehyde or ferulic acid
2.6 pb和fer对酿酒酵母细胞形态的影响
空白对照组(图5A)酵母细胞圆润饱满、形态完整、表面光滑,并且彼此间无粘黏,经1.0 g/L pb处理组(图5B)和1.25 g/L fer处理组(图5C)作用后,酵母细胞形态上发生了较大变化。经pb处理后,细胞明显变形,细胞壁严重脱落,细胞膜结构被破坏,增加细胞通透性,使细胞内容物泄漏,细胞外有大量的黏膜,细胞粘黏在一起,阻碍酵母蛋白质的正常表达,影响细胞的结构组成与酶的催化活性,进而导致酵母正常生理功能丧失[19],造成部分菌体死亡;经fer处理后,细胞也明显受到破坏,细胞表面褶皱变形,细胞壁塌陷,细胞呈黏连状态。由结果可知,相对于fer处理组,pb处理后的酿酒酵母的形态有着更大的变化,在pb的作用下,酿酒酵母的细胞壁大量脱落,而失去细胞壁保护的酵母可能使更多的成分暴露于外膜(如蛋白质、脂质),细胞因不能正常生长而死亡。

图5 pb和fer处理后扫描电子显微镜图Fig.5 SEM images of S.cerevisiae before and after treatment with p-hydroxybenzaldehyde or ferulic acid
3 讨 论
木质纤维素经预处理会产生许多酚类抑制物,这些物质的存在会抑制酵母细胞生长、底物利用、产物合成以及影响酵母细胞膜通透性,从而大大降低木质纤维素发酵产乙醇的生产效率。pb和fer作为木质纤维素预处理水解液中毒性较强的酚类抑制物,添加到酿酒酵母中无疑会抑制细胞生长和乙醇的生成[20]。经验证,1.0 g/L的pb和1.25 g/L的fer严重抑制酵母的生长,并且乙醇的发酵时间明显延长。Yan Yu等[21]在香草醛存在下野生型梭状芽孢杆菌BOH3出现自聚集,与对照组相比,在6.6 mmol/L香草醛的存在下,丁醇产量降低了(15.58±0.66)%。Xu Hongtao等[12]通过研究发现,0.5 g/L的香兰素可以抑制67%的谷氨酸棒杆菌生长,而0.5 g/L的丁香醛可以完全抑制谷氨酸棒杆菌的生长。Pereira等[13]认为,枯草芽孢杆菌不能在高于0.5 g/L的丁香醛环境下生长,在所选的抑制物中,香兰素对酵母的抑制作用最大,在1.5 g/L时其生长速率降低了95%。
细胞膜作为生物与外界环境接触的屏障,具有维持细胞内环境稳态、确保物质正常运输的功能[22]。当细胞膜遭到破坏时,胞内的一些磷酸盐、碳酸盐、DNA、RNA等均会先后从细胞膜中释放出来。经pb和fer处理后,酿酒酵母的核酸和蛋白质释放量均显著增加(P<0.05),且pb处理组的释放量比fer大,可能是由于pb对酵母的生长抑制作用比fer大造成。这与周倩倩等[23]研究丁香酚使腐败希瓦氏菌和荧光假单胞菌紫外吸收物质泄漏的结论相似。海藻糖是已被认为的抵抗多种不利环境变换的一种保护性细胞内代谢物,为研究酵母细胞对代谢水平的应激反应,确定海藻糖含量的变化是必要的[24-25]。Guo Zhongpeng等[26]研究表明,暴露于弱酸环境下的酵母细胞中海藻糖含量会显著提高。本研究结果表明,经pb和fer处理后酿酒酵母的海藻糖含量均显著增加(P<0.05)。
FTIR可以反映pb和fer加入后酿酒酵母的分子组成变化[27]。Sayqal等[28]认为甲苯胁迫对恶臭假单胞菌的最显著影响与蛋白质和脂质成分变化有关。本研究结果表明,经pb和fer处理后酿酒酵母代表脂质、蛋白质、核酸等分子成分官能团发生变化,结合扫描电子显微镜,可以直观看出经pb和fer处理后细胞的结构变化,并且本研究结果与Jeyanthi等[29]报道的通过扫描电子显微镜和透射电子显微镜分析确定甲氧西林诱导金黄色葡萄球菌超微结构变化相似。
4 结 论
根据添加不同质量浓度pb和fer的酿酒酵母生长曲线可知,1.0 g/L pb和1.25 g/L fer能明显抑制酿酒酵母的生长。经1.0 g/L pb和1.25 g/L fer处理均能使酿酒酵母糖代谢和乙醇发酵时间延长,且pb处理组的延长时间较fer处理组延长时间更长。pb和fer处理后会破坏酵母细胞膜,使核酸、蛋白质泄漏到细胞外,导致细胞无法进行正常的生命活动而死亡,为应对外界环境变化对酵母细胞造成影响,处理后的胞内海藻糖含量均明显提高。从pb和fer处理前后的扫描电子显微镜图像可以看出,原本光滑完整的细胞出现褶皱、粘黏现象,并伴有细胞壁的脱落,结合FTIR呈现的代表脂质、蛋白质、核酸等分子成分基团的变化,进一步说明了pb和fer对酿酒酵母的毒性,为揭示pb和fer对酿酒酵母的毒性机理以及培育耐受性菌株提供依据。
