赤红球菌组氨酸激酶的融合表达和功能分析
2021-12-03吴钟昊
吴钟昊,彭 仁
(江西师范大学生命科学学院,江西 南昌 330022)
组氨酸激酶是一种膜蛋白,它的功能主要发生在双组分系统途径中。在原核生物中,双组分系统通常仅限于两个功能模块之间的通信——组氨酸激酶和反应调控蛋白之间的磷酸化转移。在经典的原核系统中,信号感知可调节组氨酸激酶在保守组氨酸残基上的自磷酸化,然后转移至组氨酸激酶的C端结构域中的保守天冬氨酸残基,最后传递至反应调控蛋白的保守天冬氨酸残基,从而磷酸化反应调控蛋白影响下游基因的转录[1]。组氨酸激酶是细菌信号转导的中心,它的多样性、多功能性、广泛的分布以及与下游相关组件配合的特殊性,使其成为生物治疗[2]和生物技术操作[3]的重要目标,并成为生物传感器系统工程的基础[4-5]。
红球菌作为一类重要的模式微生物,在自然环境中分布广泛且菌株种类多样。它具有降解有机污染物[6-8]、生物转化[9-10]、产色素[11]和胡萝卜素[12]、产表面活性剂[13]、降解毒素[14]等作用,在环境治理、生物合成与转化以及医药领域都具有潜在的应用价值。目前尚鲜有红球菌组氨酸激酶的研究报道。
赤红球菌(Rhodococcus ruber)SD3是1 株耐受多种有机溶剂耐受菌,在前期工作中发现在苯酚和甲苯的胁迫下,组氨酸激酶基因的表达均发生下调。为研究组氨酸激酶在R.ruberSD3独特生理特性中的作用,本研究通过异源表达得到有活性的组氨酸激酶融合蛋白,并确定组氨酸激酶与R.ruber有机溶剂耐受性之间的关系,旨在为进一步揭示R.ruberSD3中组氨酸激酶涉及的信号转导途径与R.ruber有机溶剂耐受性的关联机制奠定基础。
1 材料与方法
1.1 材料与试剂
R.ruberSD3保存于中国典型培养物保藏中心,保藏编号为 CCTCC NO:M2012035。pGEX-4T-2质粒、大肠杆菌(Escherichia coli)TOP10和BL21(DE3)感受态保存于本实验室。
胰蛋白胨、酵母浸粉、琼脂粉、丙烯酰胺、甲叉双丙烯酰胺、四甲基二乙胺、还原型谷胱甘肽、核酸染料、ATP、异丙基-β-D-硫代吡喃半乳糖苷(isopropylβ-D-thiogalactopyranoside,IPTG)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、琼脂糖凝胶DNA回收试剂盒、细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;蛋白质浓度测定试剂盒 上海Beyotime公司;质粒小量提取试剂盒 美国Axygen公司;GoTaq®GreenMaster Mix、Kinase-GloTMLuminescent Kinase Kit 美国Promega公司;BamH I、Hind III等限制性内切酶、T4 DNA连接酶 美国New England Biolabs公司。
1.2 仪器与设备
721紫外-可见分光光度计 上海佑科仪器仪表有限公司;TC-XP-G XP基因扩增仪 杭州博日科技有限公司;THZ-98A恒温振荡器 上海一恒科学仪器有限公司;HH-2数显恒温水浴锅 常州朗越仪器制造有限公司;JY96-IIN细胞破碎仪 上海净信实业发展有限公司;2524DN-384-04 24DN型电泳仪 北京六一生物科技有限公司;MBE-150水平凝胶电泳仪 美国Major Science公司;E5331 GloMax荧光测量仪 美国Promega公司;Nano-200超微量核酸分析仪 杭州奥盛仪器有限公司;D3024R高速冷冻离心机 美国SCILOGEX公司;MicroPulserTM电转仪 美国Bio-Rad公司;ekspertTMnano液相色谱系统、Triple TOF 5600-plus高分辨串联质谱美国AB SCIEX公司。
1.3 方法
1.3.1R.ruberSD3组氨酸激酶基因(rhk)密码子优化和基因合成
对rhk基因(GenBank的序列登录号为MN688330)进行序列分析,发现其稀有密码子较多,GC含量较高,存在一些重复序列,并且存在一段跨膜区。为了能在E.coli中进行有效表达,采用通用生物公司开发的密码子优化软件对R.ruberSD3的rhk基因进行序列优化,将序列优化后的基因命名为rhks。该基因已将原基因中终止密码子去掉,其5’端和3’端分别加上限制性酶切位点分别为BamHI(G/GATCC)和EcoRI(G/AATTC),然后由通用生物公司合成带有限制性酶切位点的rhks基因。
1.3.2 构建含重组质粒pGM-T-rhks的E.coliTOP 10菌株
将rhks基因与pGM-T载体按pGM-T克隆试剂盒的操作步骤进行16 ℃过夜酶连,酶连产物转化至E.coliTOP 10感受态细胞:然后在LB固体平板筛选阳性克隆,并进行菌落聚合酶链式反应(polymerase chain reaction,PCR)和DNA序列鉴定。
1.3.3 构建含重组质粒pGEX-4T-2-rhks的E.coli重组菌
将pGM-T-rhks重组质粒和pGEX-4T-2质粒进行双酶切,之后进行琼脂糖凝胶电泳,并按照天根生化科技(北京)有限公司的DNA琼脂糖胶回收试剂盒步骤回收酶切产物,在16 ℃条件下进行过夜酶连,将酶连产物转化到E.coliBL21(DE3)感受态细胞中,筛选阳性克隆并进行菌落PCR和DNA序列鉴定。
1.3.4 组氨酸激酶基因的表达及其表达条件优化
将含重组质粒pGEX-4T-2-rhks(重组质粒图谱见图1)的阳性克隆转接到含氨苄青霉素(100 μg/mL)的Luria-Bertani培养基,培养到菌液OD600nm为0.6~0.8,取1 mL菌液作为未诱导的对照样品,剩余菌液加1 mmol/L IPTG溶液诱导,在37 ℃、180 r/min条件下再诱导培养8 h,分别将1 mL IPTG诱导的菌液和1 mL未诱导菌液在12 000×g离心2 min,去掉上清液,加150 μL 1×磷酸盐缓冲液(phosphate buffered saline,PBS)充分重悬,分别取10 μL未诱导与诱导的重悬液,各加入10 μL的1×蛋白质上样缓冲液,短暂离心后沸水浴10 min,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。
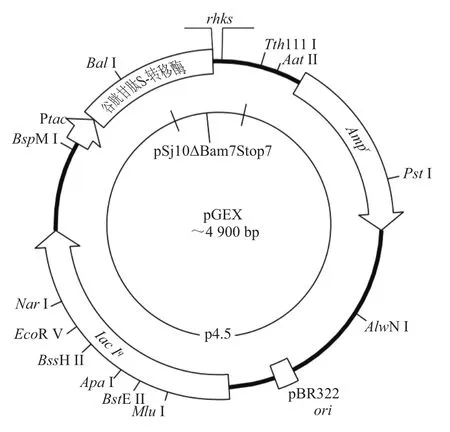
图1 重组质粒pGEX-4T-2-rhksFig.1 Map of recombinant plasmid pGEX-4T-2-rhks
为了达到最大的可溶性表达,对含有pGEX-4T-rhks重组质粒的E.coliBL21(DE3)重组菌株进行表达条件优化,分别设置不同的诱导温度(16、20、25 ℃)、诱导时间(4、6、8 h)和IPTG浓度(0.1、0.5、1 mmol/L)。
1.3.5 组氨酸激酶融合蛋白GST-RHK的纯化
根据上述最优培养条件培养重组菌,将菌液在5 000 r/min离心10 min,然后将菌体放入-40 ℃冰箱冰冻1 h以上,再加入PBS(pH 7.4)破碎缓冲液(含5 mmol/L二硫苏糖醇、0.1% TritonX-100和1 mmol/L苯甲基磺酰氟)。将菌悬液进行超声破碎,其中功率为60 W,破碎时间为3 s,间隙5 s,破碎总时间为15 min。破碎液4 ℃、10 000×g离心20 min,收集上清液。将破碎裂解液上清液经0.45 μm的滤膜过滤后上柱,加入预冷的1×PBS清洗层析柱,每次加入2 mL,共10 mL,然后加入预冷的Tris-HCl溶液(pH 8.0)洗涤层析柱,每次加入2 mL,共10 mL。加入15 mmol/L还原型谷胱甘肽洗脱液(pH 8.0)洗脱融合蛋白。每次1 mL,共10 mL,收集洗脱液,测定蛋白质浓度,将含有蛋白质的洗脱液合并,得到纯化的组氨酸激酶融合蛋白GST-RHK。在提纯过程中,分别取15 μL破碎裂解液、破碎裂解液上清液、破碎裂解液沉淀、最后收集的洗涤液和含有蛋白质的洗脱液进行SDS-PAGE分析。
1.3.6 组氨酸激酶融合蛋白GST-RHK的液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)鉴定
将纯化的重组蛋白GST-RHK进行SDS-PAGE,切下目的胶条。加入终浓度10 mmol/L二硫苏糖醇还原蛋白质,接着加入终浓度55 mmol/L碘乙酰胺,最后加入1 μg的Trypsin酶,过夜酶解8~16 h。酶解产生的多肽用C18柱除盐,已经除盐的多肽抽干后用15 μL Loading Buffer(含0.1%甲酸和3%乙腈)溶解多肽。多肽上LC-MS/MS仪器进行分析,然后对结果进行评估。
1.3.7 酶活性的测定
采用Kinase-GloTMLuminescent Kinase Kit检测样品的激酶活性。取10 μL样品与5 μL ATP溶液混合,使反应体系中ATP终浓度为5 µmol/L,25 ℃反应10 min,在避光条件下各加入50 μL发光试剂,25 ℃反应10 min,在GloMax荧光测量仪上测定荧光值。本研究规定在25 ℃和pH 7.5条件下1 min内酶催化消耗1 nmol ATP为1 U。
1.3.8 组氨酸激酶融合蛋白GST-RHK的酶促反应动力学
取10 μL融合蛋白GST-RHK分别与40 μL浓度为2、4、6、8、10 μmol/L和12.5 μmol/L的ATP溶液混合,使ATP终浓度分别为 1.6、3.2、4.8、6.4、8.0 μmol/L和10 μmol/L,25 ℃反应10 min,然后在避光条件下加入50 μL荧光试剂,25 ℃反应10 min,在GloMax荧光测量仪上测量荧光值。
1.3.9 pNV18-rhkE强化质粒的构建
使用细菌基因组提取试剂盒提取R.ruberSD3基因组,以此为模板进行PCR扩增,使用TOLOBIO生物公司的2×P6 High-Fidelity Premix,rhkE的正向引物为5’-ATGGATCCGTGAGCCGCGTACGGCC-3’(BamHI),反向引物为5’-CGAAAGCTTTCACTCCA CCGGCATCCGC-3’(Hind III)。PCR条件:94 ℃预变性2 min;随后94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸90 s,此3 步骤循环30 次,72 ℃再延伸5 min,于4 ℃低温保存。采用天根DNA琼脂糖胶回收试剂盒步骤进行切胶回收纯化PCR产物,于-40 ℃保存。
将上述PCR产物与pNV18质粒用BamHI和HindIII进行双酶切,用DNA琼脂糖胶回收试剂盒步骤回收酶切产物,然后过夜酶连,之后转化到E.coliTOP10感受态,挑取转化后的单菌落进行摇菌培养,随后进行菌落PCR和测序鉴定,阳性克隆中含有pNV18-rhkE强化质粒。
1.3.10 pNV18-rhkD敲减质粒的构建
使用细菌基因组提取试剂盒提取R.ruberSD3基因组,以此为模板进行PCR扩增,使用TOLOBIO生物公司的2×P6 High-Fidelity Premix,rhkD的正向引物为5’-CGAAAGCTTGTGAGCCGCGTACGGCC-3’(Hind III),反向引物为5’-ATGGATCCTCACTCCACCGGCATCCGC-3’(BamHI)[15]。PCR条件:94 ℃预变性2 min;随后94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸90 s,此3 步骤循环30 次,72 ℃再延伸5 min,于4 ℃低温保存。采用天根的DNA琼脂糖胶回收试剂盒步骤进行切胶回收纯化PCR产物,并-40 ℃保存。
同样按1.3.9节方法构建pNV18-rhkD敲减质粒。
1.3.11 基因增强株sdrhkE和基因敲减株sdrhkD的制备
培养含有pNV18-rhkE、pNV18-rhkD重组质粒的E.coliTOP10菌株,提取两种质粒。按照所示方法制备R.ruberSD3感受态细胞[16],将pNV18-rhkE、pNV18-rhkD重组质粒分别电转到R.ruberSD3感受态细胞,其中电压为1.5 kV,电击时间为5.6 ms,挑取转化后的单菌落进行摇菌培养,随后进行菌落PCR和测序鉴定,于是分别获得sdrhkE基因增强株和sdrhkE基因敲减株。
1.3.12 sdrhkE基因增强株和sdrhkD基因敲减株中组氨酸激酶基因表达的实时PCR(real-time PCR)分析
sdrhkE基因增强株和sdrhkD基因敲减株中总RNA的提取按照Kuang Sufang等[17]的方法。
real-time PCR分析组氨酸激酶基因表达情况的正向引物序列为CAACCTCGTCACCAACGC,反向引物序列为GATAGAAACGCTCGAAGACCC。16S rRNA基因作为内参基因,其正向引物序列为ACTGGGCGTAAAGAGYTCGT,反向引物序列为CGCATTTCACCGCTACAC。反应体系含有2×SYBR Green Mix(5 μL),上游引物和下游引物均为0.5 μL(10 µmol/L),cDNA 2 μL,然后用双蒸水补至10 μL。其程序设定:95 ℃预变性5 min;随后95 ℃变性10 s,60 ℃退火及延伸25 s,此3 步骤共40 个循环[17]。real-time PCR结果采用2-ΔΔCt相对定量法进行分析[18]。
1.3.13 sdrhkE基因增强株和sdrhkD基因敲减株在有机溶剂胁迫下的生长情况
分别制备野生型R.ruberSD3、sdrhkE基因增强株和sdrhkD基因敲减株的种子液,将种子液1 mL分别转移至100 mL LB液体培养基,再分别加入终质量浓度为0.1 g/100 mL的苯酚、0.1%(V/V)甲苯、0.1%(V/V)氯苯、0.1%(V/V)异辛烷,于35 ℃、200 r/min的恒温摇床内培养,分别在12、24、36、48、60 h和72 h测量培养菌株的OD600nm值。
1.4 数据统计
2 结果与分析
2.1 重组质粒pGEX-4T-2-rhks的构建
按1.3.4节步骤进行双酶切,回收酶切产物,然后将回收产物进行酶连,转化到BL21(DE3)感受态细胞,筛选得到阳性克隆后进行菌落PCR,电泳结果见图2,条带大小符合预期。送生工生物工程(上海)股份有限公司测序,测序结果与预期基因序列相符,说明表达质粒pGEX-4T-2-rhks构建成功。
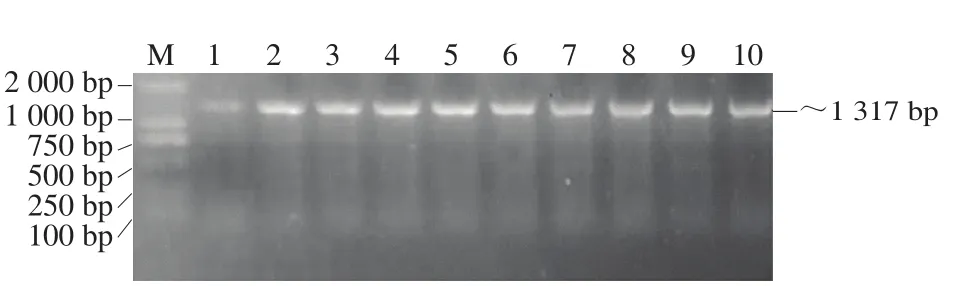
图2 含有重组质粒pGEX-4T-2-rhks的E.coliBL21(DE3)菌落PCR鉴定Fig.2 PCR identification of E.coli BL21(DE3) colonies containing recombinant plasmid pGEX-4T-2-rhks
2.2 组氨酸激酶融合蛋白GST-RHK表达条件的优化
膜蛋白与营养物质和代谢产物跨膜运输、信号转导、细胞间通讯和细胞形态的维持等多种细胞功能有关。尽管它们在细胞中发挥起重要作用,但是膜蛋白表达仍然是蛋白质表达中的难点。为使膜蛋白组氨酸激酶能够有效表达,本研究尝试了不同的质粒,最后确定pGEX-4T-2作为重组表达质粒。pGEX-4T-2表达载体含有GST标签,通常此标签能够增强蛋白可溶性和提高蛋白表达量,可在不同的宿主中表达,纯化条件温和,并且能保留了蛋白的生物活性[19]。如图3所示,组氨酸激酶融合蛋白GST-RHK获得成功表达。同时本实验为了获得更大的表达量,还进行了诱导条件的优化。SDS-PAGE结果表明在OD600nm达到0.6~0.8时加入1 mmol/L IPTG,25 ℃诱导8 h表达量最大(图3)。钱英子等[20]用pET-28a作为载体表达了变形链球菌组氨酸蛋白激酶VicK,其中在最优的表达条件为IPTG终浓度0.3 mmol/L,18 ℃诱导15 h。这说明低温可能更适合组氨酸激酶的表达。
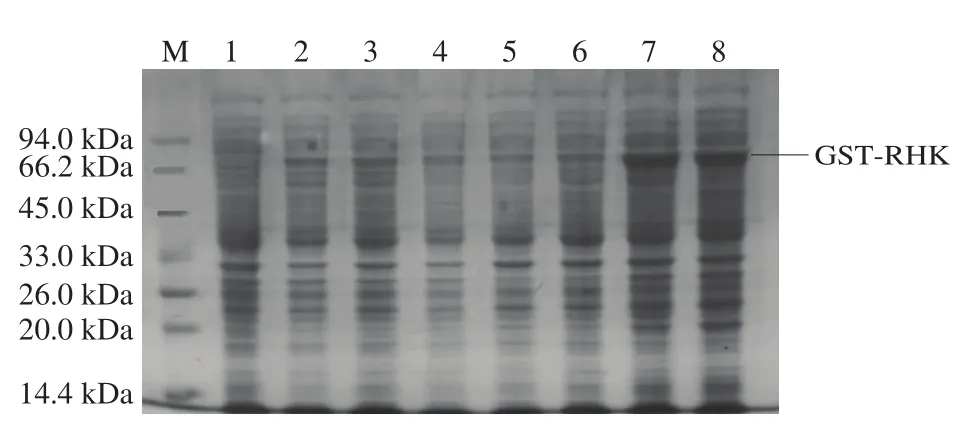
图3 pGEX-4T-2-rhks表达条件优化的SDS-PAGE分析Fig.3 SDS-PAGE analysis for optimization of expression conditions of pGEX-4T-2-rhks
2.3 GST-RHK蛋白的纯化
分别取全蛋白、菌株裂解液上清液、菌株裂解液沉淀、最后收集的洗涤液、洗脱液与1×蛋白质上样缓冲液按1∶1的比例混匀,沸水浴10 min,然后取10 μL进行SDS-PAGE鉴定,如图4所示,在上清液中表达较多,沉淀中表达较少,说明大多数融合蛋白以可溶性的形式表达,因此将细胞裂解液的上清液用于亲和层析纯化。图4泳道4表明在纯化过程中已将杂蛋白洗涤干净。泳道5~8洗脱液中,第7和第8泳道中对应的洗脱液中有更多的目的蛋白。经谷胱甘肽琼脂糖亲和层析纯化,获得电泳纯的GST-RHK融合蛋白,其中纯化倍数为3.1,得率为19.5%(表1)。
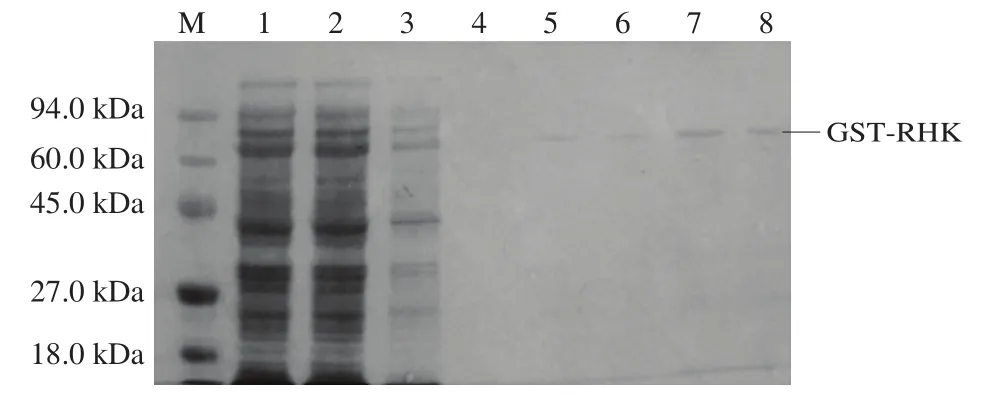
图4 GST-RHK蛋白纯化的SDS-PAGE分析Fig.4 SDS-PAGE analysis for purification of GST-RHK protein
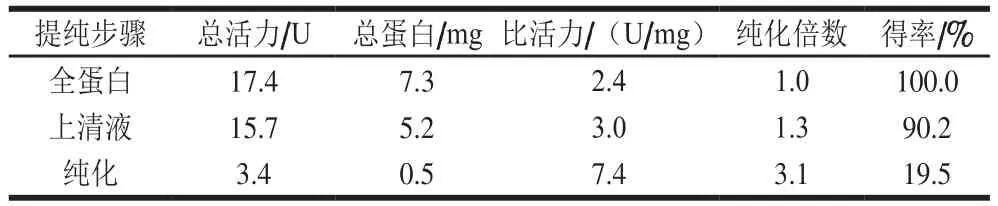
表1 GST-RHK蛋白质的纯化结果Table 1 Summary of the purification process of GST-RHK protein
2.4 GST-RHK融合蛋白的LC-MS/MS分析
当设置可信度conf≥95%、Unique peptides≥1时,GST-RHK融合蛋白LC-MS/MS产生的二级谱图数为1 326,解析的二级谱图数为9,蛋白质覆盖率为25.81%。序列显示为绿色其可信度在95%以上(图5)。结果表明纯化得到的蛋白为目的蛋白。

图5 经质谱分析获得的肽段与GST-RHK蛋白的覆盖度Fig.5 Coverage of peptide fragments obtained by LC-MS/MS in the sequence of GST-RHK
2.5 GST-RHK融合蛋白的分子质量和酶促反应动力学分析
根据GST-RHK融合蛋白的SDS-PAGE图谱,计算得到GST-RHK融合蛋白的分子质量为72.75 kDa,与理论值72.17 kDa基本一致。采用双倒数作图法,计算得到GST-RHK融合蛋白的Km和Vmax分别为20.92 μmol/L和0.17 μmol/(L·min)(图6),进一步计算得到Kcat值为1.4 min-1。Tawa等[21]测得E.coli中组氨酸激酶CheA的Kcat值约为0.028 s-1,说明这两种激酶的催化能力相当。
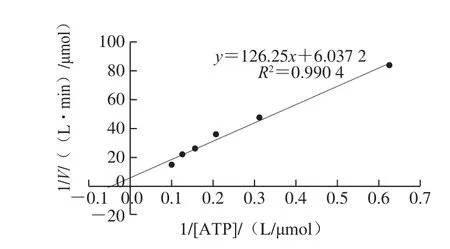
图6 GST-RHK融合蛋白的Km和Vmax值测定Fig.6 Determination of Km and Vmax of GST-RHK fusion protein
2.6 sdrhkE基因增强株和sdrhkD基因敲减株中组氨酸激酶基因的表达情况
pNV18质粒是E.coli和红球菌之间的穿梭质粒,能用于红球菌中表达蛋白质[22-23]。将组氨酸激酶基因正向连接到pNV18质粒上建构组氨酸激酶基因强化质粒,然后将组氨酸激酶基因部分反向连接到pNV18质粒上建构组氨酸激酶基因敲减质粒,然后采用real-time PCR进一步鉴定是否成功构建sdrhkE基因增强株和sdrhkD基因敲减株,并分析组氨酸激酶基因的表达变化情况。如图7所示,与野生型R.ruber相比,sdrhkE基因增强株中组氨酸激酶基因的表达扩大到原来的46.57 倍。sdrhkD基因敲减株组氨酸激酶基因的表达减少到原来的5%。说明增强质粒中的组氨酸激酶基因表达后有效提高了R.ruber中总的组氨酸激酶mRNA含量,然而敲减质粒产生的反义RNA能够和R.ruber基因组产生的组氨酸激酶mRNA结合,从而能够降低组氨酸激酶基因的表达。
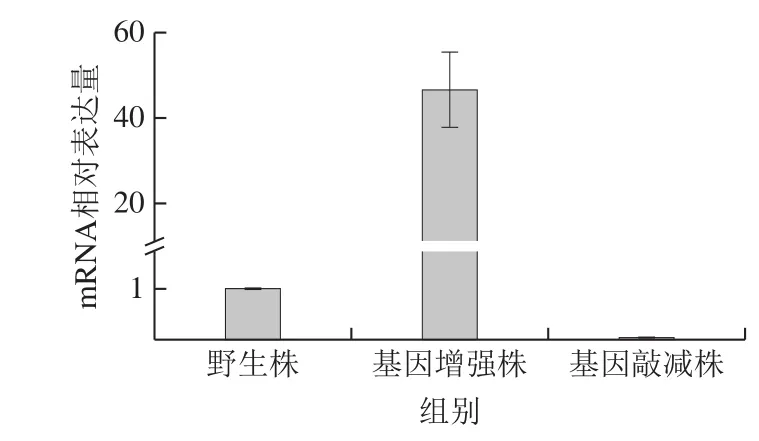
图7 R.ruber SD3野生株、增强株和敲减株中组氨酸激酶基因转录变化情况Fig.7 Transcriptional change of histidine kinase gene in wild-type,sdrhkE enhancement, and sdrhkD knockdown strains
2.7 有机溶剂胁迫下sdrhkE基因增强株和sdrhkD基因敲减株的生长情况
为研究组氨酸激酶基因对R.ruberSD3有机溶剂耐受性的影响,实验测定野生型R.ruber、sdrhkE基因增强株和sdrhkD基因敲减株在不同有机溶剂存在情况下的生长曲线。如图8所示,在苯酚、甲苯、氯苯、异辛烷4 种有机溶剂胁迫下,在前24 h内,野生型R.ruber、sdrhkE基因增强株、sdrhkD基因敲减株生长情况区别较小,在24~72 h,上述3 种菌株生长情况呈现差异。其中sdrhkD基因敲减株的生长情况都优于野生型R.ruberSD3,sdrhkE基因增强株的生长情况都低于野生型R.ruberSD3。这些结果表明组氨酸基因表达下调使菌株有机溶剂耐受性增加,然而组氨酸基因表达上调使菌株有机溶剂耐受性下降。在前期研究中发现R.ruberSD3在甲苯和苯酚处理下,组氨酸激酶基因均下调,这说明R.ruberSD3的有机溶剂耐受性和组氨酸激酶基因负相关,和R.ruberSD3、sdrhkE基因增强株和sdrhkD基因敲减株的生长情况一致。
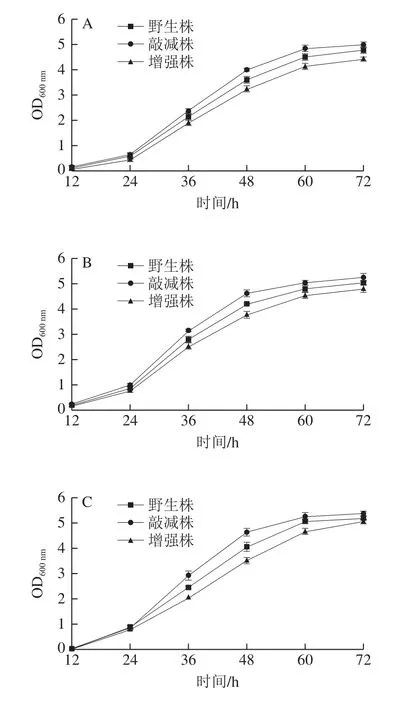
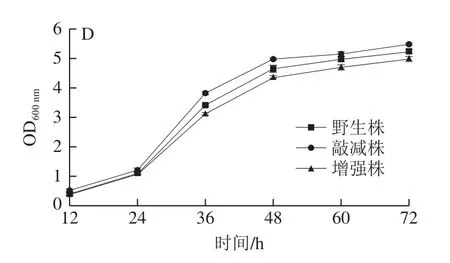
图8 不同有机溶剂处理下野生株、敲减株和增强株的生长曲线Fig.8 Growth curves of wild-type, sdrhkD knockdown and sdrhkE enhancement strains cultured in the presence of different organic solvents
3 讨 论
红球菌属于专性好氧的革兰氏阳性菌,由于其具有代谢多样性和功能的多样性,能够广泛用于环境修复、生物转化、生物合成等方面。目前对红球菌属在分类[24]、组学[17,25]、遗传改造[26]及其应用等方面开展了许多研究,然而对于红球菌的信号转导途径有待于进一步深入研究。对于生物制备和生物修复过程,红球菌属微生物都会接触化学物质,其中一些化学物质对微生物具有一定毒性,影响微生物的生长和代谢,因此红球菌如何感知这些化学物质信号并作出响应是红球菌研究中一个重要的科学问题。
组氨酸激酶介导的信号转导途径广泛存在各种细菌中,它作为双组分信号转导系统的一部分,参与调控细菌的各种生命活动,包括营养物质的获取、代谢作用、适应环境的变化、孢子和生物膜形成、毒性等[27]。在适应环境的变化中往往涉及渗透压、光、趋药性、温度、氧等因素。例如E.coli的EnvZ-OmpR双组分系统中EnvZ是一种组氨酸激酶,它感受到外界渗透压的变化进而调节细胞的渗透压[28]。Deng Chaoying等[29]发现在野油菜黄单胞菌组氨酸激酶VgrS与该菌的渗透压抗性相关。另外一种与细菌趋化系统密切相关是一种组氨酸激酶CheA,其中趋化受体MCP感受外界刺激,并通过组氨酸激酶CheA和反应调节器CheY将信号传递给鞭毛马达,从而使得细菌趋向或远离化学物质[30]。迄今为止鲜见有R.ruber中有关组氨酸激酶的研究报道。本研究从R.ruberSD3中克隆了组氨酸激酶基因,并成功地进行了融合表达。融合蛋白与E.coli中组氨酸激酶CheA的激酶活性相当。此外,本研究通过pNV18质粒增强或降低了组氨酸激酶的表达,并且发现组氨酸基因的表达变化与R.ruber的有机溶剂耐受性相关,然而尚未发现其他菌株存在该现象。目前还未找到组氨酸激酶的底物,因此组氨酸激酶如何对R.ruber有机溶剂耐受性产生影响的分子机制还有待于进一步研究。
4 结 论
本研究从R.ruberSD3发现了一种新的组氨酸激酶,证实了其激酶活性,并且它与R.ruberSD3的有机溶剂耐受性存在关联,通过强化或敲减该组氨酸激酶可以改变R.ruberSD3的有机溶剂耐受性,这些研究结果为进一步揭示组氨酸激酶介导的信号转导途径与R.ruberSD3有机溶剂耐受性提供研究依据,也为R.ruberSD3的遗传改造提供了新的靶标。
