金属有机框架材料在食品检测中应用的研究进展
2021-12-02李光华邓素梅康维钧高志贤
李光华,刘 厦,康 凯,邓素梅,康维钧,*,高志贤,*
(1.河北医科大学公共卫生学院,河北 石家庄 050017;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津市环境与食品安全风险监控技术重点实验室,天津 300050)
食品安全问题是当今世界的热点话题。食品污染会对人体造成急性、亚急性或慢性危害,给人们的健康带来巨大威胁。食品的供应链复杂,涉及多个阶段,包括种植、生产、加工、储存等,每一个环节都可能受到有害物质的污染[1]。食品中污染物主要包括金属离子[2]、农兽药残留[3-5]、环境有机污染物[6]、食品添加剂[7]等,这些污染物也可通过水进入食物链,直接威胁人体健康。构建检测食品和水中污染物的方法在食品质量监测和确保食品安全方面起着至关重要的作用。传统检测食品中污染物的方法主要有色谱法[8-12]、毛细管电泳[13]、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)[14]等,但这些仪器方法存在样品前处理复杂、价格昂贵、操作费时费力等缺点。因此,开发操作简单、快速、灵敏的食品污染物检测方法具有十分重要的意义。
金属有机框架(metal-organic frameworks,MOFs)是由金属离子或金属团簇与有机配体自组装而成的新型多孔晶体材料[15],是一个涉及无机化学、有机化学和配位化学等多学科的崭新课题,是近十几年来发展迅速的一种新型材料。常见MOFs的类型主要有网状金属有机骨架材料(isoreticular metal-organic-framework,IRMOFs)、类沸石咪唑酯骨架材料(zeoliticimidazolate framework,ZIFs)、莱瓦希尔骨架材料(material sofistitute Lavoisierframeworks,MILs)、孔-通道式骨架材料(pocket-channel frameworks,PCNs)[16]。除此之外,UiO(Universtiy of Oslo)、CPL(Coordination Pillared-layer)、HKUST(Hong Kong University of Science and Technology)等MOFs材料也在不断发展。与其他材料相比,MOFs具有比表面积大、孔隙率高、骨架结构多样以及骨架孔径尺寸可调节等优点,在气体存储、吸附与分离[17]、传感[18-19]、发光[20-21]、催化[22]等领域得到广泛的应用。将MOFs作为传感材料或样品前处理材料应用于食品检测,可以提高检测灵敏度、降低成本、使操作简单快速。本文综述近些年来MOFs及其复合材料在食品检测中应用的研究进展,包括作为传感材料在传感器检测法中的应用和作为前处理材料在色谱法检测前处理中的应用,旨在为其在食品安全领域的应用提供参考。
1 MOFs在传感器检测法中的应用
传感器是能感受分析物并按照一定的规律转换成可用信号的器件或装置,传感器检测法具有灵敏度高、操作简单、成本低、响应速度快等优点,在食品检测中得到广泛应用。MOFs因其独特的优点已经成为构建分析物传感器的先进材料,使其参与到传感系统进行检测可进一步提高检测器的灵敏度和缩短检测时间。MOFs作为传感材料已被广泛应用于构建各种传感器对食品中污染物进行检测,包括电化学传感器、荧光传感器、比色传感器等。
1.1 电化学传感器
电化学传感器因检测灵敏度高、响应速度快、成本低等优点,已广泛应用于食品检测中。电极材料是构建新型电化学传感器的关键[23-24]。MOFs具有比表面积大、易于改性、结构多样等优点,是电极表面改性的理想材料,能够提高电化学传感性能。为了克服MOFs导电率低、电活性弱等缺点,将MOFs与多功能材料结合,如金纳米粒子(gold nanoparticles,AuNPs)、铂纳米粒子(platinum nanoparticles,PtNPs)、碳纤维等,组装制备成基于MOFs的复合材料,以提高电极的导电性。Hu Mei等[25]将血红素(hemin)封装在Fe-MIL-88NH2中设计了一种以hemin@MOFs/AuPt复合物为信号放大平台的间接竞争电化学免疫传感器(图1A),用于检测食品中的马杜霉素(maduramicin,MD)。在该竞争体系中,以AuNPs为电极修饰剂,其表面固定牛血清白蛋白(bovine serum albumin,BSA)包被抗原,当不存在MD时,抗MD抗体(Ab1)会结合固定的MD-BSA抗原,通过标记辣根过氧化物酶(horseradish peroxidase,HRP)的抗Ab1抗体(Ab2)结合hemin@MOFs/AuPt-Ab2-HRP/HRP生物探针。hemin@MOFs具有催化活性高、稳定性好、比表面积大等优点,可用于负载AuPt纳米颗粒和生物分子(Ab2-HRP),并用HRP封闭,以提高催化活性。生物探针中的hemin@MOFs、AuPt和HRP可协同催化还原H2O2,显著放大电流信号。当存在MD时,与固定的MD-BSA抗原发生竞争免疫反应,生物探针产生的电流信号降低,实现MD的间接竞争检测,该传感器的线性范围为0.1~50 ng/mL,检出限(limit of detection,LOD)为0.045 ng/mL。与传统电化学传感器相比,该方法的灵敏度高,在实际应用中表现出良好的性能。SunYujiao等[26]以科琴碳黑(ketjen black,KB)/二茂铁(ferrocene,Fc)双掺杂MOF(Fc-KB/ZIF-8)为基础研制了一种双信号输出模式的比率型电化学适配体传感平台以选择性检测香兰素。首先在玻碳电极(glassy carbon electrode,GCE)表面制备AuNPs/Fc-KB/ZIF-8@GCE,然后通过Au-S偶联将AuNPs与香兰素DNA适配体结合;在改性GCE时,加入6-巯基-1-己醇(6-hydroxy-1-hexanethiol,MCH)占据没有与香兰素DNA适配体结合的AuNPs其他活性位点,避免非特异性结合。香兰素与附在AuNPs上的适配体结合形成香兰素适配体复合物(图1B)。在复合过程中,香兰素有规律地增加峰值电流强度(Ivan,响应信号),掺杂到ZIF-8中的Fc峰值电流强度(IFc,参考信号)的变化可忽略不计。通过绘制香兰素浓度与比值(Ivan/IFc)的线性关系,可灵敏、高效地检测香兰素,检测线性范围为10~200 nmol/L,LOD为3 nmol/L。这种双信号输出模式的传感器克服了单信号模式检测稳定性低、重复性低的缺点,可校正背景信号的影响,提高了检测的精密度。Hua Yue等[27]首次用硼氢化钠(NaBH4)还原Cu-MOFs制备铜纳米复合材料(copper nanocomposites,Cu-NCs)修饰电极,在Cl-存在下,建立了一种同时测定组胺(histamine,HTA)和组氨酸(histidine,His)的电化学传感器(图1C)。修饰在电极上的Cu-NCs中的Cu0电化学氧化为Cu+,与溶液中的Cl-反应,在电极上形成CuCl固体。CuCl固体被电化学氧化生成CuCl2,在反向阴极电位循环中进一步还原为CuCl。因此在低电位(约-0.10 V)下能显示出稳定的固体CuCl电化学氧化峰。当存在HTA或His时,由于Cu2+与HTA或His的相互作用较强,CuCl转化为CuHTA或CuHis复合物,固体CuCl的电化学氧化峰电流将增加。该传感器可避免背景电活性物质干扰,选择性强,线性范围为0.01~100 μmol/L,LOD为2.5 nmol/L。此外,MOFs还可与介孔Fe3O4@C纳米胶囊(Fe3O4@C nanocapsules,mFe3O4@mC)、共价有机骨架(covalent organic frameworks,COFs)石墨烯气凝胶(graphene aerogel,GAs)、氧化石墨烯(graphene oxide,GO)、金属离子等结合制备成MOFs复合材料修饰电极,应用于电化学传感器对食品污染物进行灵敏检测,如表1所示。
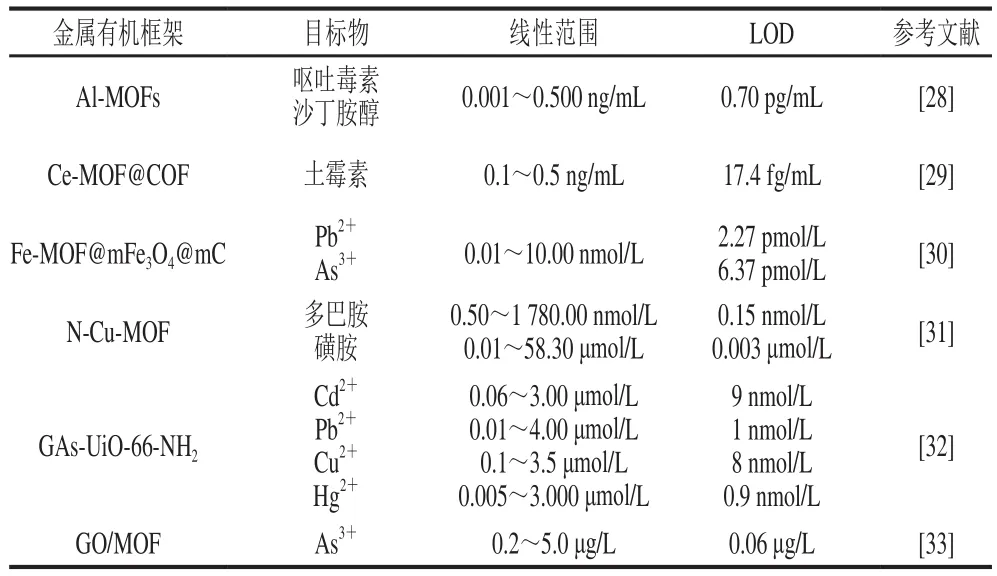
表1 MOFs在电化学传感器食品检测中的应用Table 1 Application of MOFs in electrochemical sensors for food detection

图1 MOFs在电化学传感器中的应用Fig. 1 Application of MOFs in electrochemical sensors
1.2 光学传感器
光学传感器依据光学原理进行检测,因颜色变化易于观察和检测,被认为是最有效的检测方法之一,其中荧光法和比色法是最常用的两种方法[34]。研究人员不断探索MOFs在快速检测食品污染物方面的潜力,开发和研究基于MOFs的荧光和比色传感器检测技术在食品安全和公共卫生领域具有重要意义。
1.2.1 荧光传感器
利用传感器-分析物相互作用引起的荧光响应进行光学传感是一种灵敏的分析方法[35]。MOFs作为一种荧光传感材料具有易于功能化的表面和可调的孔隙率,在荧光传感检测食品污染物中具有潜在的应用前景[36]。污染物与MOFs相互作用引起荧光猝灭从而实现对污染物的检测。一般来说,污染物对MOFs的荧光猝灭机理主要有以下几个方面[37-39]。1)荧光共振能量转移(fluorescence resonance energy transfer,FRET),当荧光团的发射光谱与受体的吸收光谱重叠时,发生FRET。2)光诱导电子转移(photoinduced electron transfer,PET),PET机制取决于MOFs和分析物的最低未占据分子轨道(lowest unoccupied molecular orbital,LUMO)的能级,当MOFs的LUMO能级高于被分析物的LUMO能级时,MOFs的激发电子可以转移到被分析物的LUMO,导致荧光猝灭。3)分析物与MOFs之间激发光的竞争。这种机制的运作依赖于分析物的吸收光谱和MOFs的激发光谱之间的重叠,分析物与MOFs竞争激发光能量,使MOFs发生荧光猝灭。4)动态/静态猝灭机理。MOFs是检测兽药的良好材料,在监测动物源性食品中药物残留方面具有潜在的应用价值。Wang Bin等[37]设计并合成了一种新的化学稳定发光Al-MOF,通过以上4 种荧光猝灭效应实现对6 类15 种常用兽药的高效广谱检测,被测兽药对该MOFs的猝灭效率均在82%以上,LOD低。近些年来,人们在不断探索MOFs在快速检测农药方面的潜力。He Kaiyu等[34]合成了一种具有强吸附性和高发光性的水稳定锆基发光MOF(zirconium luminescent MOF,Zr-LMOF),甲基对硫磷可通过PET猝灭(1,2,4,5-四(4-羧基苯基)苯(1,2,4,5-tetrakis(4-carboxyphenyl)benzene,H4TCPB)配体的荧光,在农产品表面加入Zr-LMOF悬浮液,在紫外光照射下出现视觉信号从而实现甲基对硫磷的快速灵敏原位检测(图2A),该方法检测的线性范围为0.07~5.00 mg/kg,LOD为0.115 μg/kg。Xu Xiaoyu等[40]以羧甲基纤维素(carboxymethyl cellulose,CMC)气凝胶为柔性主体材料、碳量子点(nanosized carbon dots,CDs)和EuMOFs为荧光中心研制一种多信号的可穿戴手套式荧光传感器(图2B),对食品中毒死蜱(chlorpyrifos,CP)进行检测。EuMOFs和CDs对CP有不同荧光响应,CP与EuMOFs的有机配体竞争吸收光源能量,降低能量从配体转移到Eu3+的概率,猝灭Eu3+的荧光,Eu3+的发光强度随CP浓度增加而逐渐降低,而CDs的发光强度不受影响。该传感器检测的线性范围为5~40 μmol/L,LOD为89 nmol/L。这种在食品污染物表面进行定量及定性荧光检测的方法响应速度快(30 s),可实现肉眼检测,且这种便携式装置的检测过程方便、可靠。Lian Xiao等[41]制备了一种以2,2’-联吡啶-5,5’-二羧酸(H2bpydc)为配体的铪基发光MOFs(Eu@UiO-67(Hf)-bpydc),利用Hf12团簇的反应性和Eu3+的发光特性制备传感器并对甲基膦酸(methanephosphonic acid,MPA)进行检测。猝灭是由于分子动态碰撞引起,当激发态发光中心与MPA分子碰撞时,发生电荷转移,并产生一种弱荧光的中间激基复合物,导致荧光猝灭(图2C),该MOFs卓越的传感性能促使传感器能够检测废水中痕量的MPA,LOD为0.4 mg/kg。除此之外,一些非发光MOFs还可作为荧光猝灭剂应用于荧光传感器。Liu Sha等[42]提出了一种6-羧荧光素(6-carboxyfluorescein,FAM)荧光染料标记适配体和锆基-卟啉MOFs(PCN-222)作为荧光猝灭剂的比率荧光传感平台,用于氯霉素(chloramphenicol,CAP)的高效检测。PCN-222吸附FAM标记适配体,通过FRET和PET猝灭FAM荧光,当CAP存在时,FAM标记适配体从PCN-222表面释放出来荧光恢复(图2D)。PCN-222荧光发射不受CAP浓度影响,以此为参考信号建立比率荧光传感器检测CAP,线性范围为10-2~104pg/mL,LOD为0.08 pg/mL。这种生物传感器不仅能够快速、超灵敏、高特异性地检测CAP,而且还具有良好的通用性和多重分析性能。Yang Qian等[43]提出了一种基于2D-MOFs纳米片(Cu-TCPP)的多色荧光适配体纳米探针,据此构建传感器用于检测CAP、催产素(oxytocin,OTC)和卡那霉素(kanamycin,KANA)。探针采用双搅拌棒辅助靶置换(double stirring bar assisted target replacement,DSBTR)系统进行无酶信号放大,在DSBTR系统中,采用了两个带有大量DNA探针的搅拌棒来增强信号,由固定DNA(fixed DNA,fDNA)、辅助DNA(assisted DNA,aDNA)和捕获DNA(captured DNA,cDNA)组装成的Y-DNA固定在搅拌棒1上,单链DNA(single-strand DNA,ssDNA)固定在搅拌棒2上。目标物可触发Y-DNA解体。cDNA在与目标物结合后从杆1上分离,并与杆2上的ssDNA反应以释放目标,之后目标将进入下一个周期从而实现信号放大(图2E)。荧光团(S)标记的ssDNA作为信号探针(P),其发光被Cu-TCPP猝灭,aDNA可与P结合形成双链DNA,Cu-TCPP对双链DNA没有猝灭效应,荧光强度显著增强。该方法对CAP、OTC和KANA样品的LOD分别为1.5、2.4、1.0 pmol/L。2D-MOFs具有大的比表面积、长程荧光猝灭性和生物分子识别性等优点,推动了生物分子探测技术的创新,且相较于普通荧光探针只能改变荧光强度,该探针在探测不同目标时可显示不同颜色的荧光。Mehta等[44]将6 组氨酸标记的有机磷水解酶(hexahistidine-tagged organophosphorus hydrolase,OPH6His)共价固定在UiO-66-NH2上,与游离态相比,酶活力提高了近40%。以酶MOF复合物为生物探针,催化有机磷农药(organophosphorus pesticides,OPPs)水解为对硝基苯酚(p-nitrophenol,PNP)。PNP的形成量与农药浓度成正比,而PNP可通过FRET效应使荧光报告分子香豆素发生荧光猝灭,据此构建荧光传感器对农药进行检测,该传感器可检测到的农药质量浓度非常低,LOD为10 ng/mL。使用过的OPH6His/UiO-66-NH2生物材料易于再生,并可重复使用多次。
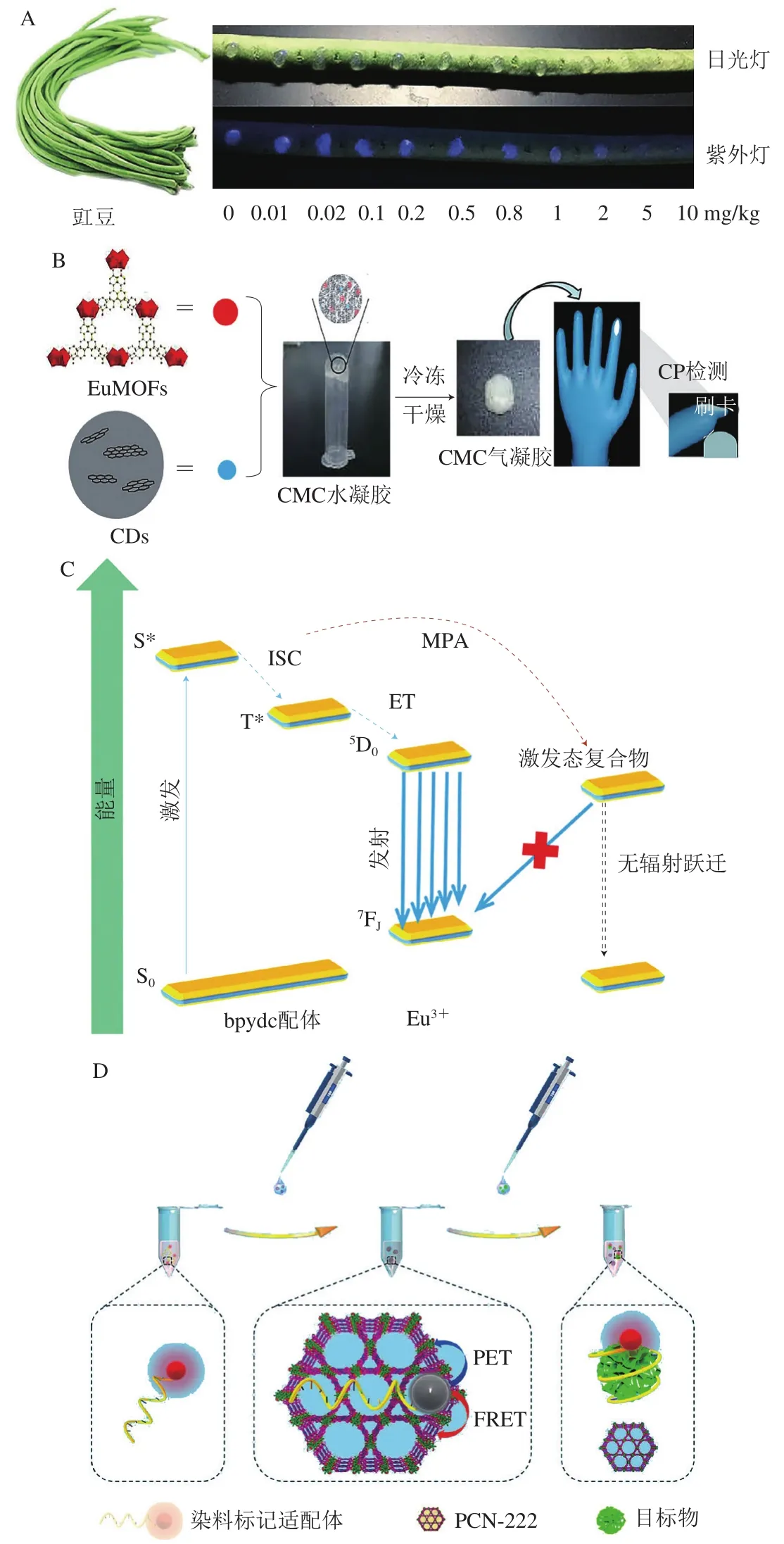
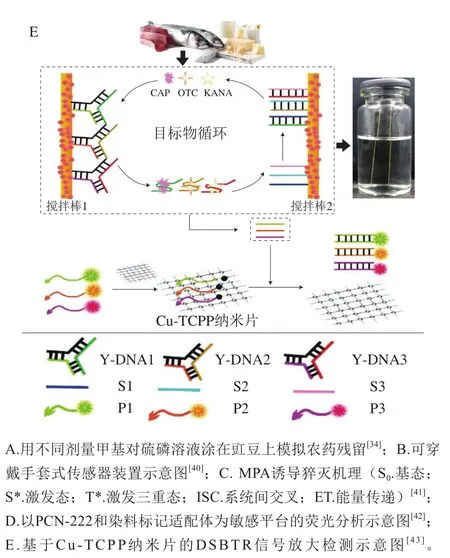
图2 MOFs在荧光传感器中的应用Fig. 2 Application of MOFs in fluorescence sensors
1.2.2 比色传感器
比色传感器因操作简便、易于观察等优点得到广泛应用。酶可以在适当的条件下特异催化化学反应,经常被应用于比色传感器中[45]。但天然酶或一些人工酶存在成本高、稳定性低等缺点,开发新的替代酶受到广泛关注[46]。MOFs材料具有丰富的活性位点和可设计的结构,非常适合作为开发纳米酶的候选材料。一些MOFs因具有类似于酶的特性而成为目前人工酶和分析传感领域的重要材料。目前已探索了多种具有类酶活性的MOFs并应用于水和食品检测。Luo Linpin等[22]报道了一种具有过氧化物酶和氧化酶活性的以混合价铈为金属中心的新型MOFs(Ce-bpydc),据此建立了以3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)为显色剂的比色传感平台用来检测食品中的抗坏血酸(ascorbic acid,AA)。Ce-bpydc催化TMB从无色变为蓝色,蓝色oxTMB可在AA的参与下还原为无色TMB,线性范围为1~20 μmol/L,LOD为0.28 μmol/L。该方法中MOFs合成简单、纳米酶活性高、稳定性好,且具有操作简便、灵敏、准确的优点。同样Tan Hongliang等[47]通过对Cu-MOF前驱体热分解诱导碳化,制备了有过氧化物酶活性的由分散在碳基体中的铜纳米粒子组成的纳米复合材料(Cu-NPs@C),在H2O2存在下催化TMB,构建比色传感平台检测AA,线性范围为10~103μmol/L,LOD为1.41 μmol/L。Li Jie等[48]开发了Fe-MIL-53-适配体-TMB-H2O2比色传感平台,通过计算CAP质量浓度与MOF催化活性降低程度之间的关系来检测水中CAP质量浓度。AuNP强化的抗生素适配体可获得高达86%的信号增量。Fe-MIL-53带正电荷,而CAP-AuNP适配体结合物带负电荷,包覆在Fe-MIL-53表面,抑制其催化H2O2氧化TMB,LOD为8.1 ng/mL。该传感平台具有普遍适用性,通过改变适配体的类型可对其他抗生素进行检测且都显示出较高的灵敏度和选择性。Zhu Nuanfei等[49]设计了一种灵敏的HRP比色免疫传感器用于检测痕量邻苯二甲酸二丁酯(dibutyl phthalate,DBP)。当DBP存在时,与抗DBP抗体(Ab1)结合,该抗原抗体复合物捕获Cu-MOFs标记的抗Ab1抗体(Ab2),Cu-MOFs用于信号放大,在HNO3存在的情况下,Cu-MOFs释放出大量的Cu2+,加入抗坏血酸钠后,Cu2+进一步被还原为Cu+,Cu+与HRP发生反应,破坏HRP的结构,抑制TMB底物的氧化,TMB显色反应发生明显变化(图3A)。在优化条件下,该传感器的LOD为1.0 μg/L,是相同抗体常规ELISA法的1/60。此外,该方法还显示出良好的准确性和重现性。Wang Yi等[50]制备了具有氧化酶活性的氧化铈纳米棒模板金属有机骨架(CeO2NRs-MOF),用于水中Cr6+比色传感检测。MOF在CeO2纳米棒表面的原位生长增强了其氧化酶活性。在微量Cr6+存在下,显著促进CeO2NRs-MOF催化TMB氧化为蓝色oxTMB(图3B),线性范围为0.03~5.00 μmol/L,LOD低至0.02 μmol/L。Li Huaping等[51]制备了具有过氧化物酶活性的PtNP@UiO-66-NH2复合材料,可催化H2O2氧化TMB发生显色反应。该复合材料可吸附Hg2+,Hg2+与PtNP特异性相互作用,抑制了Pt-NP@UiO-66-NH2的过氧化物酶样活性(图3C)。据此开发了灵敏的比色传感系统检测和吸附水中的Hg2+浓度,线性范围0~10 nmol/L,LOD为0.35 nmol/L。该方法将PtNP限制在UiO-66-NH2的骨架内,UiO-66-NH2的均匀多孔结构使PtNPs具有良好的分散性,吸附容量大,反应物和产物易于通过孔进出。Zhang Jianwei等[52]发现两种具有过氧化物酶活性的铁(III)基MOF(MIL-68和MIL-100),可催化氧化不同的过氧化物酶底物,据此建立灵敏比色传感器测定H2O2和AA。当H2O2存在时,MIL-68和MIL-100催化TMB氧化用于H2O2比色测定分析(图3D),AA可有效抑制MOFs对邻苯二胺的催化氧化,使溶液颜色发生改变从而对AA浓度进行检测。基于MIL-68和MIL-100的比色传感器对AA浓度检测的线性范围为30~485 μmol/L,LOD为6 μmol/L。
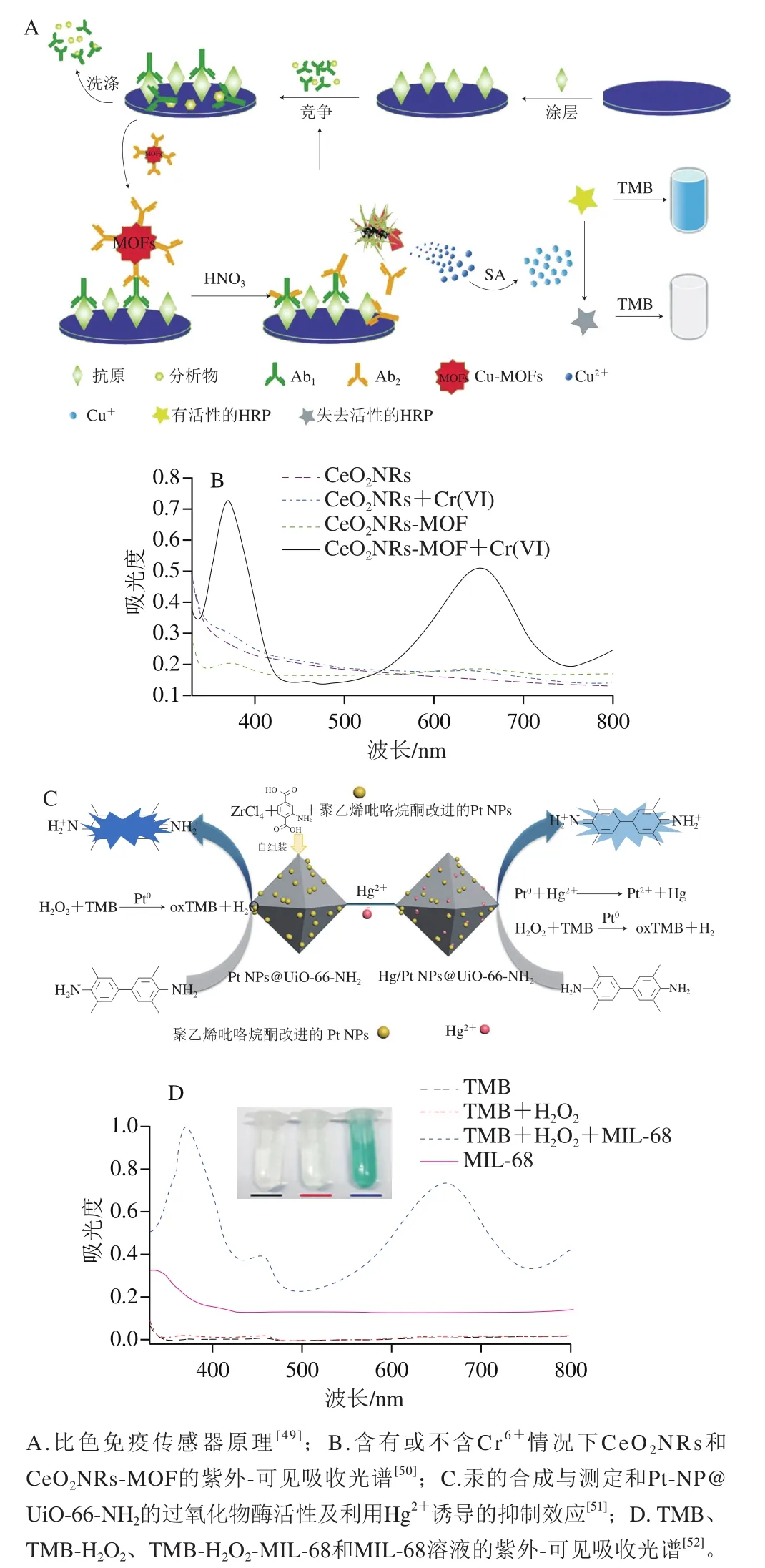
图3 MOFs在比色传感器中的应用Fig. 3 Application of MOFs in colorimetric sensors
2 MOFs在色谱法检测前处理中的应用
除传感器检测法,仪器分析方法因检测灵敏度和准确度高、稳定性好等优点,在食品安全领域得到广泛应用,如气相色谱法(gas chromatography,GC),液相色谱法(liquid chromatography,LC)、高效液相色谱法(high performance liquid chromatography,HPLC)、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)、高效液相色谱-质谱联用法(high performance liquid chromatography-mass spectrometry,HPLC-MS)等[53]。但由于食品基质复杂、污染物在食品中存在浓度低等问题,在仪器分析前对复杂样品基质中痕量或超痕量样品进行适当前处理是关键,因此开发简便快速、提取效率高的样品前处理方法具有重要意义。固相萃取(solid-phase extraction,SPE)因具有操作简单、环境友好、高效富集、回收率高等优点被认为是样品前处理的最佳方法之一。MOFs作为吸附剂已被广泛应用于SPE[54]和由SPE衍生出来的多种新样品前处理技术中,如固相微萃取(solid-phase micro extraction,SPME)[55]、磁性固相萃取(magnetic solidphase extraction,MSPE)[56]、搅拌棒吸附萃取(stir bar sorptive extraction,SBSE)[57]等。以下主要介绍了MOFs及其复合物材料作为吸附剂在色谱法检测样品前处理技术中的应用。
2.1 固相微萃取
SPME是20世纪90年代兴起的一种新颖的样品前处理与富集技术,集采样、萃取、浓缩、进样于一体,溶剂消耗少,在食品分析中得到广泛应用。纤维表面涂覆的SPME涂层是提高萃取性能的关键,MOFs及其复合物作为涂层材料被广泛应用于SPME。金属氮化物框架(metal azolate frameworks,MAF)作为MOFs的一个亚科,因其特殊的结构和显著的吸附选择性,在有机挥发物分析中受到了广泛的关注。Liu Manman等[58]将MAF在不锈钢丝上逐层沉积制备了MAF-66涂层纤维,并采用SPME技术对多环芳烃(polycyclic aromatic hydrocarbons,PAHs)进行提取。MAF-66是一种具有潜在应用前景的PAHs吸附剂,其可透过通道和配位纳米空间使PAHs很容易进入位于空腔内的“选择性活性位点”,且PAHs与MAF-66之间可以形成π-π相互作用和疏水作用,从而对PAHs有较强的吸附作用。在最佳实验条件下,采用GC对提取的PAHs进行分析,线性范围为0.01~100.00 μg/L,LOD为0.1~7.5 ng/L。Lan Hangzhen等[59]报道了原位阴极电沉积法制备(Et3NH)2Zn3(BDC)4(E-MOF-5,BDC为1,4-苯二甲酸酯)薄膜涂层纤维(图4A),用于雌激素的SPME。该方法制备E-MOF-5涂层仅需20 min,且优化后的涂层具有优异的热稳定性和机械耐久性。E-MOF-5纳米级的孔径适合于分子尺寸小于1 nm的雌激素捕获,另外它的表面基团可以与含有苯环和羟基的雌激素相互作用。据此建立SPME-LC法同时检测乳品中的4 种雌激素,LOD为0.17~0.56 ng/mL。其SPME操作重复次数超过120 次,对4 种雌激素的提取选择性和容量均高于常用的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)涂层。Lirio等[60]以MIL-53(Al)和甲基丙烯酸丁酯为原料采用微波辅助聚合法制备了MIL-53(Al)有机聚合物整体柱,该整体柱为其结构提供了一个小的介孔(来源于MOF)和大的通孔(来源于聚合物),其中,小的介孔提供足够的表面积以保持溶质的存在,而大的通孔允许流动相流过固定相。将该聚合物整体柱应用于SPME对青霉素进行提取,提取回收率在90.5%~95.7%之间,通过HPLC法对牛奶中的青霉素进行分析,LOD为0.06~0.26 g/L。Zhang Suling等[61]合成了MOF-199/GO复合材料涂层纤维,将其应用于8 种有机氯农药的SPME,并进行了GC分析,LOD为2.3~6.9 ng/L。该复合材料纤维结合了MOFs高孔隙率的优异性能和GO独特的层状结构,具有良好的热稳定性、高孔隙率和较长的使用寿命(可重复萃取140 次),对农药的吸附亲和力较单独MOF和GO增强。Pang Yachao等[62]在合成NH2-MIL-125过程中引入石墨氮化碳(g-C3N4)作为模板,通过碳化制备了含氮金属有机骨架多孔碳(C-(C3N4@MOF)),以此作为SPME纤维涂层,提取果蔬样品中14 种OPPs(图4B)。Wei Songbo等[63]将MOF纳米片1,4-苯二甲酸铜加入聚酰亚胺树脂中,MOF在聚合物基体中均匀分布形成高效涂层材料,用于SPME对水样中的5 种PAHs进行萃取;通过不同方法制备的MOFs或MOFs复合物纤维涂层具有比表面积大、吸附容量大、热稳定性好、机械稳定性高等优点,已被越来越多地应用于SPME技术中。
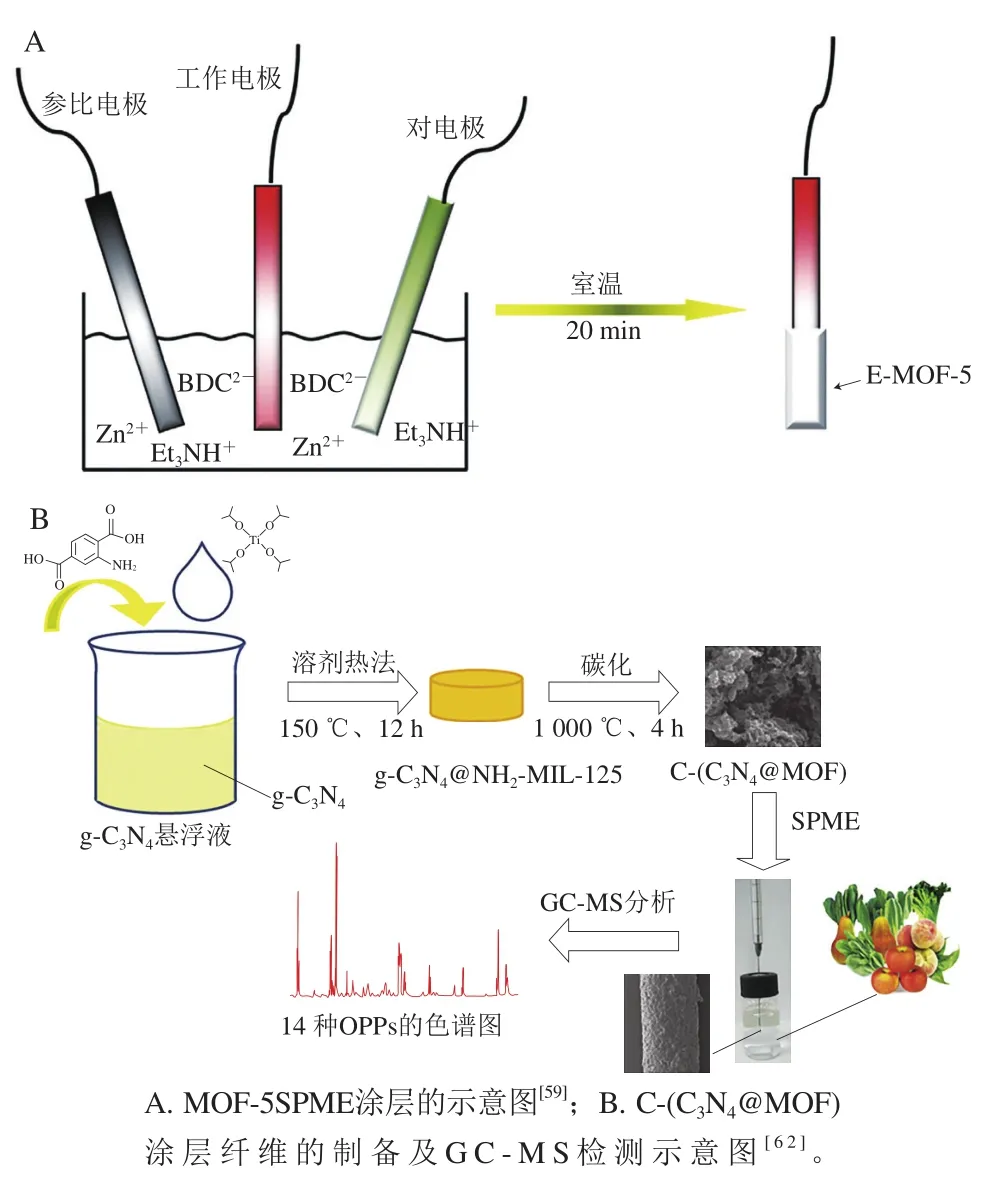
图4 MOFs在固相微萃取中的应用Fig. 4 Application MOFs in solid phase microextraction
2.2 磁性固相萃取
MSPE是以磁性或可磁化材料为吸附剂基质的一种固相萃取技术,被吸附的分析物可通过磁场从样品基质中分离[64]。这种预处理方法是基于磁性吸附剂在液体样品中通过漩涡或摇动的方式分散,增大分析物与吸附剂之间的接触面积,实现快速的物质转移,并在短时间内保证较高的萃取效率[65]。MSPE的优点是分离方便快捷、操作简单,大大缩短了样品预处理时间。MOFs可作为样品前处理材料应用于MSPE。Liu Guangyang等[66]通过在Fe3O4-GO纳米复合材料表面制备MOF层并与β-环糊精(beta-cyclodextrin,β-CD)分子结合,合成了具有超顺磁性和大比表面积的M-MOF/β-CD,以此为磁性多孔吸附剂,用于蔬菜样品中的咪鲜胺和3 种三唑类杀菌剂的MSPE,并采用HPLC-MS/MS分析测定,LOD为0.25~1.0 μg/L,加标回收率为74.13%~119.83%。将MOFs与Fe3O4-GO结合可以提供刚性的纳米支撑界面,从而提高其耐水性和机械强度。此外,MOFs由于具有碳含量高、比表面积大、孔容大等优点,是碳化过程中理想的模板剂和良好的碳前驱体。Li Dandan等[67]以氧化锌纳米颗粒(ZnO-NPs)、Co(OH)2和2-甲基咪唑为原料,采用一步碳化法制备了基于Zn/Co-MOFs的磁性纳米多孔碳(MNPCs)。该MNPCs具有高比表面积以及可控的孔结构和磁性,化学稳定性好,对OPPs具有较高的选择性和提取效率。良好的萃取性能主要归因于MNPCs与OPPs之间的π-π相互作用和疏水作用,且Co-N配位使吸附剂非常稳定,能有效避免由于磁性材料结构不稳定而造成的目标分析物的损失。以MNPCs为吸附剂,GC法分析水果样品中5 种OPPs的含量,LOD为0.018~100.000 μg/L。与单金属MOFs相比,双金属MOFs因具有更高的结构稳定性、更丰富的吸附活性位点、出色的回收稳定性而越来越受到关注。Wang Yang等[68]以Co/Ni-MOF为前体经氮气煅烧,制备三维磁性多孔碳微球(3D-Co/Ni@C),该复合材料对拟除虫菊酯类农药具有优异的萃取能力和分离效率。采用分散磁固相萃取(dispersive magnetic solid-phase extraction ,d-MSPE)-HPLC法测定实际样品中的醚菊酯和联苯菊酯(图5),LOD分别为0.003 8~0.006 7 ng/mL和0.065~0.12 ng/g。但这种方法的应用范围小,在今后的工作中需研究如何提高材料的选择性,使该方法适用于其他复杂样品。Liang Li等[69]合成Fe3O4@SiO2-GO/MIL-101(Cr)并将其用作MSPE吸附剂对7 种三嗪类除草剂进行MSPEHPLC检测,LOD为0.01~0.08 μg/kg。Chen Xiangfeng等[70]将Fe3O4@MIL-100用作水样中痕量多氯联苯(polychlorinated biphenyls,PCBs)的MSPE吸附剂,用GC-MS法对样品进行分析,LOD为1.07~1.57 ng/L。由此可见,通过将磁性纳米复合材料封装到MOFs中或将功能识别分子嫁接到MOF外表面来合成杂化MOFs,再将其应用于MSPE,可提高MOFs对目标物的吸附能力和特异性识别能力。
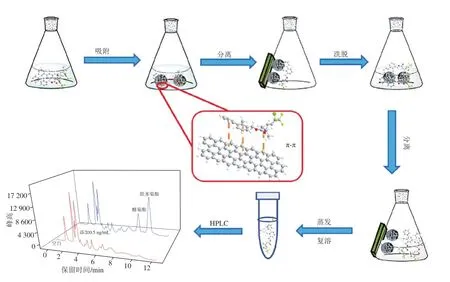
图5 分散磁性固相萃取示意图[68]Fig. 5 Schematic diagram of the dispersive magnetic solid-phase extraction procedure[68]
2.3 搅拌棒吸附萃取
SBSE因灵敏度高、重现性好、不使用有机溶剂等优点越来越受到关注。搅拌棒上的涂层纤维量是SPME纤维的50~250 倍,可显著提高回收率和萃取能力[71]。SBSE技术已广泛应用于食品复杂样品中痕量污染物的富集和测定。然而,市面上可买到的SBSE涂层,如PDMS、乙二醇-有机硅和聚丙烯酸酯等通常对目标具有低选择性,极大地限制了在复杂食品基质中的应用。因此,开发具有选择性涂层的搅拌棒对SBSE富集目标物具有重要意义。MOFs以其独特的结构和性能,如高比表面积、良好的热稳定性、结构多样性等,成为一种合适的搅拌棒涂层材料。Hu Cong等[72]采用水热法合成了Al-MIL-53-NH2,并采用溶胶-凝胶法制备了PDMS与MOFs结合(PDMS/Al-MIL-53NH2)的涂层纤维,PDMS/MOFs包被搅拌棒的制备重复性好,同批内相对标准偏差(relative standard deviation,RSDs)为4.8%~14.9%(n=7),不同批次间RSDs为6.2%~16.9%(n=6)。并建立了一种PDMS/MOFs包被搅拌棒的SBSE-HPLC新方法测定环境水样中PAHs,LOD为0.05~2.94 ng/L。与其他方法相比,本方法萃取时间(20 min)和解析时间(10 min)短,提取效率高,线性范围宽,具有很好的应用潜力。Hu Cong等[73]建立了PDMS/IRMOF-3涂层包被搅拌棒的SBSE-HPLC法检测水体中7 种目标雌激素新方法,LOD为0.15~0.35 μg/L。Lin Saichai等[57]比较了4 种MOFs(MIL-101(Cr)、MOF-5(Zn)、ZIF-8、MOF-5(Fe))的吸附性能(图6),选择MOF-5(Fe)作为SBSE涂层,通过磁吸附法将MOF-5(Fe)固定在搅拌棒上,用于提取PCBs。MOF-5(Fe)涂层对PCBs的高富集性能,可能是由于MOF-5(Fe)的高比表面积和MOF螯合配体(对苯二甲酸)与PCBs芳香环之间的π-π相互作用。据此建立了SBSE-GC-MS联用法检测6 种PCBs,LOD为0.061~0.096 ng/g。但是通常搅拌棒涂层对目标没有选择性,大多数涂层会将分析物与其他共存的不需要的有机污染物一起提取,严重影响定量分析结果。因此开发具有高选择性的搅拌棒涂层具有重要意义。为提高SBSE对分析物的选择性,可将分子印迹聚合物、抗原抗体涂层或适配体引入SBSE。Lin Saichai等[74]研究了一种简单、高选择性的适配体SBSE,能够与GC-MS结合用于对鱼类样品中PCBs的选择性富集和测定。在MOF-5(Zn)上固定识别PCB72和PCB106的适配体能够大量、特异性富集PCBs,方法的线性范围为0.02~250 ng/mL,LOD为0.003~0.004 ng/mL。由此可见,简单地在SBSE纤维上制备功能化涂层是有效提取复杂基体样品中超痕量目标的关键,而MOFs的合成方法简便,将MOFs及其复合物作为搅拌棒涂层材料可显著提高其吸附量和选择性。

图6 不同MOF对PCBs的提取能力[57]Fig. 6 Extraction capacity of different MOFs to polychlorinated biphenyls[57]
3 结 语
MOFs是近些年发展起来的一种新兴材料,具比表面积大、孔隙率高、孔的尺寸可调、表面可修饰等优点,在食品安全、环境监测、生物医学等领域受到重视。MOFs已成功应用于电化学、荧光、比色传感器和色谱法前处理中检测食品污染物,具有操作简单、响应速度快、灵敏度高、成本低等优点。但MOFs在食品检测中的应用仍处于初级阶段,存在一定的不足之处:1)MOFs的导电性差,直接应用其作为电极材料受到限制[32-33];2)MOFs的水稳定性差,大多数报道的发光MOFs容易在其节点或金属配体处水解,水解会产生质子化连接物和氢氧化物金属节点[34],最终导致MOFs的结构坍塌;3)具有酶活性的MOFs作为催化剂对物质进行检测时,其催化活性、选择性低,环境耐受性差[22],以MOFs作为载体将纳米酶固定在MOFs孔隙中可以提高酶的稳定性和催化活性,但这一策略又由于MOFs的孔径小而受到应用限制[75];4)大多数MOF的粒径为亚微米或微米级,直接将MOFs封装到SPE柱中会导致较高的背柱压,限制了MOF在SPE中的发展和应用[17]。上述问题的存在限制了MOFs在食品检测中的应用。因此在未来研究中想要充分利用MOFs优异的性能,使其更广泛应用于食品检测技术中,研究者可致力于以下几个方面的研究:1)精确控制、调节MOF的结构、大小及孔径,制备高质量、高稳定性的MOFs;2)将MOFs与其他材料(如金属纳米颗粒、碳纤维、金属氧化物、量子点、COFs、酶、适配体等)结合制备成MOFs复合材料,从而使MOFs在具有原有优点的基础上获得其他材料导电、发光、磁性、催化等优异性能,这种方法能够克服MOFs自身一些缺点,扩大其应用范围;3)将MOFs材料应用于其他检测技术中,如将MOFs应用于表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)技术中制备SERS基底,可提高食品检测过程中的稳定性和灵敏度,或将其与便携式荧光检测仪、微流控芯片技术、智能手机等设备相结合,开发更加实用且便携的产品,使其能够应用于实际生活中。食品安全一直是热点话题,开发简便、灵敏、快速的现场食品检测方法是大势所趋,而将具有独特结构的MOFs材料与食品快速检测技术结合,能够提高检测的灵敏度,使其在该领域得到更广泛的应用。
