芥末精油包合物对棘孢曲霉的抑菌机理
2021-12-02李燕妮李芬芳李奕星刘石生洪克前冯建成袁德保
李燕妮,李芬芳,陈 娇,李奕星,刘石生,洪克前,冯建成,袁德保,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.中国热带农业科学院海口实验站,海南省香蕉遗传改良重点实验室,海南 海口 571101;3.中国热带农业科学院南亚热带作物研究所,海南省热带园艺产品采后生理与保鲜重点实验室,广东 湛江 524091;4. 海南大学理学院,海南 海口 570228)
红毛丹(Nephelium lappaceumL.)果实风味好且营养价值高,是一种受欢迎的热带水果。红毛丹被联合国粮农组织列为优先推广的“四大水果”之一。泰国是全球红毛丹最大生产国,此外,马来西亚、越南、缅甸、印度尼西亚、菲律宾、澳大利亚、斯里兰卡、南非、美国(夏威夷和波多黎各)和中国也都较大量种植红毛丹。海南是我国唯一适合大面积种植红毛丹的区域,目前拥有我国最大的红毛丹生产基地。红毛丹果实风味独特且外观精致,深受消费者欢迎。然而,红毛丹果实极不耐贮运。一方面,果实表面的软刺气孔密布使果实易出现失水褐变,因此贮运销过程中需保持高湿环境,而高湿情况下更易发生腐烂;另一方面,红毛丹果实软刺极易受损并加速果皮褐变的发生,同时伤口会成为病原菌侵染的通道。李芬芳等[1]分离并鉴定出棘孢曲霉(Aspergillus aculeatus)为海南产红毛丹果实褐斑病的主要致病菌。
芥末精油是从芥菜中提取的天然植物油,其主要成分是异硫氰酸烯丙酯(allyl-isothiocyanate,AITC)。芥末精油或AITC常被用作天然的抑菌剂[2]。10 μL/L芥末精油熏蒸处理能较好抑制冬枣采后病原菌(青霉菌、灰霉菌和链格孢菌)[3];2 µL/L芥末精油熏蒸能完全抑制芒果炭疽病菌和蒂腐病菌,而5~10 µL/L熏蒸处理能明显抑制上述病原菌在芒果果实上的生长[4];1 μL/L AITC能有效降低草莓果实的腐烂率[5]。综上可见芥末精油或AITC对果实采后致腐病原菌有很强的抑制活性。然而,芥末精油或AITC存在挥发性强、抑菌作用时间短、储存以及使用不方便等问题,而且在较高浓度下对果实会产生药害(植物精油存在的共性问题)。因此,研发既能充分发挥上述抑菌剂的抑菌作用,同时又能规避对果实产生药害的精准保鲜技术尤为重要。针对上述抑菌组分开展精准缓释控制有望解决上述问题。目前已有一些关于其缓释控制的研究,如硅酸盐凝胶缓释控制[6]、膜材料缓释控制[7]。李奕星等采用β-环糊精对芥末精油进行了微胶囊化,能实现芥末精油的缓释控制[8]并在一定程度上能规避其对果实产生药害。
虽然芥末精油或AITC呈现较好的抑菌作用,然而芥末精油或AITC的β-环糊精包合物的抑菌活性鲜有研究,且其抑菌机制鲜有报道。因此,本研究以海南产红毛丹果实褐斑病的病原菌棘孢曲霉为研究对象,考察芥末精油包合物对其抑菌活性和抑菌机制;抑菌机制分别从菌丝、分生孢子和孢子顶囊形态、菌丝细胞超微结构和转录组分析方面开展。研究将为植物精油特别是芥末精油在果蔬采后贮运中的精准保鲜提供理论和技术支撑。
1 材料与方法
1.1 菌株、材料与试剂
棘孢曲霉(Aspergillus aculeatus)为本实验室从腐烂的红毛丹果皮中分离并鉴定,保藏于中国热带农业科学院海口实验站采后生物学与技术课题组;PDA、PDB培养基 青岛海博生物技术有限公司。
芥末精油(食品级,AITC质量分数约为99%)河北省平乡县天邦调味食品有限公司;β-环糊精(分析纯,纯度98%) 上海麦克林生化科技公司;E.Z.N.A.TMFungal RNA Kit试剂盒 广州Omega Bio-Tek公司;MonScriptTMRTIII All-in-One Mix with dsDNase试剂盒、MonAmpTMSYBR®Green qPCR Mix(Low ROX)试剂盒武汉莫纳生物科技有限公司。
1.2 仪器与设备
85-2数显磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;TM 4000Plus扫描电子显微镜(scanning electron microscope,SEM)、120 kV HT7700透射电子显微镜(transmission electron microscope,TEM) 日本日立株式会社;StepOnePlusTM荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司;Novaseq 6000测序平台 美国Illumina公司;OSE-260微量分光光度计 北京天根生化科技有限公司;GY-CJ-1F无菌操作台 上海永归电子有限公司;1704486琼脂糖凝胶电泳槽 美国Bio-Rad公司。
1.3 方法
1.3.1 芥末精油包合物制备及对棘孢曲霉的抑制率测定
参考李奕星等[8]方法制备芥末精油包合物。具体方法如下:精确称取一定量的β-环糊精加入已预热至60 ℃的去离子水中并磁力搅拌,制备成β-环糊精饱和水溶液(呈透明状);向β-环糊精饱和水溶液中缓慢滴入芥末精油-乙醇混合液(乙醇和芥末精油的体积比为1∶1),磁力搅拌使芥末精油被完全包合(控制β-环糊精与芥末精油的质量比为6∶1)。50 ℃磁力搅拌2.5 h后,溶液体系在4 ℃下静置24 h,将析出的沉淀过滤并在60 ℃下真空干燥24 h,得到白色的芥末精油包合物。
将10 mL适温的PDA培养基分别倒入三格无菌培养皿(三格无菌培养皿的总体积为63 mL)中的两格(每格5 mL),待培养基冷却凝固备用。无菌条件下,用接种环从棘孢曲霉菌种斜面挑取孢子接种到PDA平板中央,然后用封口膜封住培养皿边缘并置于28 ℃恒温培养箱中培养。培养3 d后,在霉菌菌落边缘用打孔器取直径为0.6 cm的菌碟并置于三格培养皿中的PDA培养基中央;分别将0、0.02、0.04、0.06、0.08、0.10 g芥末精油包合物和1 mL无菌水放入空格中,对应的质量浓度分别为0(即对照组)、0.385、0.769、1.155、1.540、1.925 g/L(计算方法为芥末精油包合物的质量除以三格培养皿中的剩余空间即52 mL)。三格培养皿盖上盖子并用封口膜密封,置于28 ℃培养60 h。采用十字交叉法测量菌落直径/cm,并按下式计算抑制率。

1.3.2 芥末精油包合物对棘孢曲霉菌丝、分生孢子以及孢子顶囊影响的观察
参照1.3.1节接种方法,棘孢曲霉固体培养3 d后,在霉菌菌落边缘取直径为0.6 cm的菌碟并置于三格培养皿中PDA固体培养基中央。根据1.3.1节结果计算出半最大效应浓度(concentration for 50% of maximal effect,EC50)并添加该质量浓度的芥末精油包合物为处理组,未添加为对照组。生长60 h后取下表面菌丝,参考任亚峰[9]的方法进行前处理。使用体积分数2.5%的戊二醛固定液进行固定(4 ℃放置24 h),取出菌丝用0.1 mol/L pH 7.4的磷酸缓冲液清洗3 次;依次用体积分数50%、70%、80%、90%、95%乙醇溶液进行脱水,然后再用无水乙醇脱水两次后浸入乙酸异戊酯,并用临界干燥仪进行干燥;将干燥样品用导电胶黏贴置入标本台上,进行SEM观察,并采集图像进行分析。
1.3.3 芥末精油包合物对棘孢曲霉菌丝细胞超微结构影响的观察
处理组和对照组菌丝培养同1.3.2节。菌丝用体积分数4%的戊二醛溶液固定,接着用0.1 mol/L pH 7.2磷酸缓冲漂洗3 次且每次15 min;然后用锇酸固定3 h并用0.1 mol/L pH 7.2磷酸缓冲液冲洗3 次;依次用不同体积分数(30%、50%、70%、80%、90%)乙醇溶液脱水,然后用无水乙醇脱水两次后再用100%丙酮进行脱水,切片并固定于铜网上;置于TEM下观察并采集图像进行分析。
1.3.4 转录组测序与分析
棘孢曲霉在PDA培养基上培养72 h后,接种一环棘孢曲霉及其孢子至装于三角瓶中的100 mL PDB培养基。添加体积分数为0.005%的芥末精油为处理组;未添加芥末精油为对照组。培养60 h后,将菌体使用无菌水清洗并冷冻离心,然后用液氮速冻并用干冰封装,送至上海美吉生物公司采用Illumina Novaseq 6000测序平台进行转录组测序分析。处理组和对照组分别设置3 个重复。
转录组测序后获得原始读段(raw reads),通过数据过滤获得高质量读段(clean reads)。利用BLASTX对获得的序列进行NR注释(NCBI非冗余蛋白质数据库)。使用DEGseq对组间的差异表达基因(differentially expressed genes,DEGs)进行分析,并根据差异倍数(fold change,FC)≥2和P≤0.05筛选出DEGs。采用基因本体论(gene ontology,GO)(http//www.geneology.org)对DEGs进行GO功能富集分析。通过京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Gnomes,KEGG)(http://www.genome.jp/kegg/)进行KEGG代谢通路显著性富集,以确定DEGs参与的最主要生化代谢途径和信号转导途径。
1.3.5 实时荧光定量PCR分析
使用E.Z.N.A. Fungal RNA Kit提取试剂盒进行RNA提取;采用微量分光光度计检测RNA纯度(OD260nm/OD280nm比值)以及RNA浓度,并用1%琼脂糖凝胶电泳检测RNA的质量。采用MonScript RTIII All-in-one Mix试剂盒对质量合格的RNA反转录合成cDNA。选取β-actin为内参基因,采用Primer express 5.0软件Applied biosystem程序设计引物(表1)。使用StepOnePlusTMReal-Time PCR System、MonAmp SYBR Green qPCR试剂盒进行实时荧光定量PCR分析,根据试剂盒说明步骤进行具体实验及相对定量结果分析。

表1 转录组DEGs验证引物列表Table 1 Primer sequences used for RT-qPCR in this study
1.4 数据分析与处理
实验设置3 个重复,采用Excel软件进行数据分析,结果用平均值±标准差表示,采用Sigmaplot软件绘制标准曲线并求得回归方程和相关系数,用R语言包和Sigmaplot软件作图。
2 结果与分析
2.1 芥末精油包合物对棘孢曲霉的抑菌活性
从图1可知,随着质量浓度的增加,芥末精油包合物对棘孢曲霉的抑制率急剧升高。芥末精油对应的抑制率回归方程为y=42.557x+8.362 4,R²=0.938 9。50%抑制率对应的芥末精油包合物质量浓度为1.00 g/L,即EC50为1.00 g/L。多项研究表明植物精油对致病菌有显著抑制作用且呈现明显的量效关系[10-11]。Lu Hao等[12]研究表明,桉树油对假单胞菌和铜绿假单胞菌的EC50分别为1.04、1.27 g/L;Jing Changliang等[10]研究表明,丁香酚对链格孢菌的最低抑菌浓度(minimum inhibitory concentration,MIC)为0.15 g/L;Aguilar-González等[13]研究表明丁香精油和芥末精油对灰葡萄孢菌有较好的抗菌活性,丁香精油的MIC为92.56 µL/L,而芥末精油的MIC为15.42 µL/L。本实验结果明确了芥末精油包合物依然具有良好的抑菌活性且存在明显量效关系。

图1 芥末精油包合物质量浓度对棘孢曲霉菌的抑制率Fig. 1 Inhibitory effect of mustard essential oil inclusion complex at different concentrations against Aspergillus aculeatus
2.2 芥末精油包合物对棘孢曲霉菌丝和分生孢子形态以及孢子顶囊的影响
SEM结果显示,处理组和对照组存在明显差异(图2)。对照组孢子顶囊呈现较规则的球形,分生孢子分布均匀且长势良好;处理组孢子顶囊不匀称且呈畸形,孢子分生不规整(图2A、D)。对照组菌丝较粗且形态饱满,菌丝上布满分生孢子;处理组菌丝较细且发生皱缩(图2B、E)。对照组孢子顶囊的数量显著多于处理组,且处理组孢子顶囊形态发生了明显变化(图2C、F)。Shao Xingfeng等[14]的SEM观察结果表明,0.7 mL/L的茶树油使灰霉菌菌丝形状产生畸形或塌陷。张宽朝等[15]发现肉桂醛、柠檬醛使黑曲霉菌丝体和孢子囊的形态结构均发生变化。Gong Liang等[11]的SEM观察结果表明,丁香酚-β-环糊精包合物能使荔枝霜疫霉菌的孢子囊和孢囊梗呈现异形,包括表面收缩、部分变形和皱缩。李路等[16]的SEM观察结果表明,2.24 g/Lp-茴香醛能使柑橘酸腐病菌菌丝体表面出现明显褶皱、不规则扭曲和干瘪状。整体来讲,本实验结果与前人研究结果一致。本实验结果表明EC50浓度的芥末精油包合物使棘孢曲霉的菌丝、分生孢子以及孢子顶囊的形态出现异常并使孢子顶囊数量明显减少。
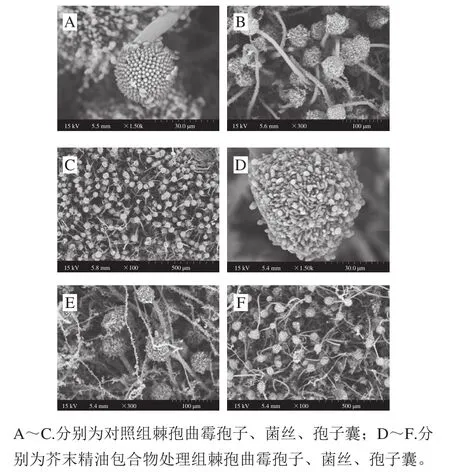
图2 扫描电子显微镜观察不同处理棘孢曲霉的孢子、菌丝以及孢子囊的形态Fig. 2 SEM observation of morphology of spores, hyphae and sporangia of Aspergillus aculeatus treated with mustard essential oil inclusion complex
2.3 芥末精油包合物对棘孢曲霉菌丝细胞超微结构的影响
TEM结果显示,对照组菌丝细胞饱满、双层膜结构明显,可见内质网、核糖体以及正在进行跨膜运输的囊泡等细胞器(图3A);处理组菌丝细胞不再充盈、细胞壁变薄、细胞膜边界模糊、细胞内部发生严重的溶解现象(图3B)。Shao Xingfeng等[14]通过TEM观察发现,1.5 mL/L茶树油可以使灰霉菌细胞的质壁分离、质膜破裂且从细胞壁剥离、细胞内成分损伤严重。Li Yonghua等[17]通过TEM观测到2.0 mL/L茶树油使灰质芽孢杆菌细胞的线粒体严重受损,主要表现在基质丢失和线粒体数量不规则性增加。Shao Xingfeng等[18]的TEM观察结果表明质量分数0.5%壳聚糖中加入12 mL/L丁香精油可使柑橘绿霉菌菌体细胞质膜分离、线粒体等细胞器消失、液泡增加、细胞质丧失,同时细胞壁发生严重皱缩。Lu Hao等[12]通过TEM观察结果发现2.0 g/L桉树油可破坏铜绿假单胞菌细胞,如细胞出现明显的孔洞或皱褶。本实验结果与前人研究结果总体一致,即EC50的芥末精油包合物使棘孢曲霉菌丝细胞的细胞壁、细胞膜以及细胞器出现异常。
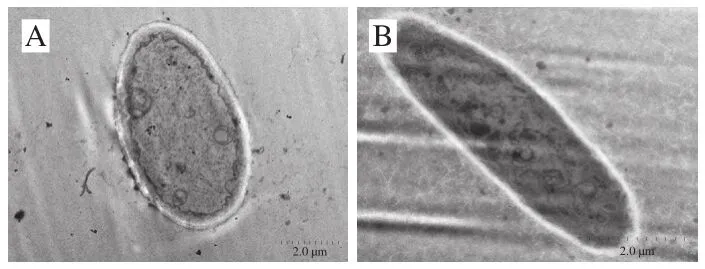
图3 TEM观察对照组(A)和处理组(B)棘孢曲霉菌丝细胞的超微结构Fig. 3 TEM observation of ultrastructure of Aspergillus aculeatus hyphal cells not treated (A) and treated (B) with mustard essential oil inclusion complex
2.4 棘孢曲霉差异表达基因的分析
为进一步探究精油的抑菌机制,一些文献通过转录组学手段研究了精油对真菌DEGs的影响[19-22]。对处理组和对照组样品的转录组测序数据进行标准化处理,然后对所有基因的表达量绘制散点图(图4A)。灰色部分表示差异不显著的DEGs;红色和绿色部分分别表示DEGs中的上调基因和下调基因。由图4B可知,DSGs中上调基因和下调基因分别为528 个和529 个。由图4C可知,DEGs的GO功能富集主要集中在生物过程(14 条)、细胞组成(12 条)和分子功能(15 条)3 个方面。1 057 个DEGs中,有743 个基因成功归类到3 个部分中的41 个组别中(图4C)。在生物过程方面,DEGs主要参与了“代谢过程”“细胞过程”“本土化”“生物调节”等过程;在细胞组成方面,DEGs主要参与了“膜部分”“细胞区域”“细胞器”“蛋白复合物”等;在分子功能方面,DEGs主要参与了“催化活性”“结合”“转运活性”“翻译调节活性”等。进一步分析DEGs的KEGG途径分类,主要归于“代谢”“遗传信息处理”“环境信息处理”“细胞转化”“有机体系统”“人类疾病”6 类(图4D);共有392 个DEGs归类到29 条KEGG途径,主要涉及“碳水化合物代谢”“氨基酸代谢”“能量代谢”“折叠、分类和降解”“翻译”“信号转导”“运输和分解代谢”“环境适应”等(图4D)。前人研究发现,相比对照,肉桂醛和柠檬醛协同处理扩展青霉后出现1 713 个DEGs,有793 个基因下调和920 个基因上调,大多数DEGs参与了次生代谢产物的生物合成、氨基酸代谢和氧化还原过程等[21]。

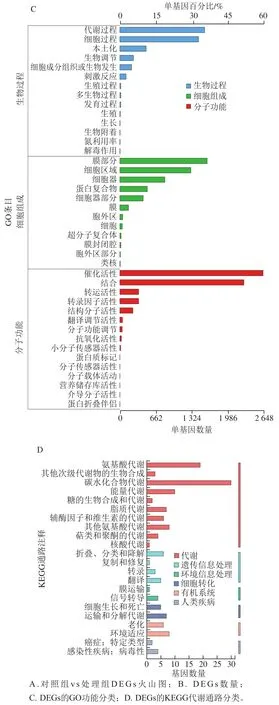
图4 转录组DEGs分析结果Fig. 4 Transcriptomic analysis of differentially expressed genes
2.5 实时荧光定量PCR验证实验结果
基于GO和KEEG富集分析,选取各条目和代谢通路中显著变化且表达量较多的8 个差异基因,利用实时荧光定量PCR对选取的基因差异表达情况进行验证。选取基因主要参与编码ATP合成酶、NADPH结合酶以及细胞色素c氧化酶亚基1等。虽然转录组测序结果和实时荧光定量PCR分析结果的log2FC有差异,但差异表达的变化趋势基本一致(表2),说明转录组测序数据的可靠性;表达倍数的差异可能是由于仪器、算法等不同造成的。经NCBI数据库比对,本研究中选择的8 个差异基因分别属于ABC、HSP、CAT、RP、NADPH、COX、COX、FADH基因家族(表2)。ABC属于质膜转运基因,是一种重要的耐药基因,与药物外排诱导机制相关[23];热休克蛋白(heat shock protein,HSP)是重要的应激蛋白,在生物体遭受外界胁迫时其表达将大量上调[24];过氧化氢酶(catalase,CAT)是一种重要的抗氧化酶与生物体的应激反应及活性氧的水平密切相关[22];核糖体蛋白(ribosomal protein,RP)是核糖体亚基的重要组成部分,涉及细胞周期进程、凋亡和DNA损伤反应[25];还原型辅酶II(nicotinamide adenine dinucleotide phosphate,NADPH)、还原型黄素腺嘌呤二核苷酸(reduced flavin adenine dinucleotide,FADH)和细胞色素氧化酶(cytochrome c oxidase,COX)是三羧酸循环的重要组成部分,参与线粒体的能量代谢、功能和呼吸链传递[26-27]。芥末精油包合物处理棘孢曲霉上调了ABC、HSP、CAT和RP基因的表达量,下调了NADPH、COX和FADH基因的表达量(表2)。线粒体的主要功能是通过三羧酸循环和氧化磷酸化产生细胞的能量货币ATP[28]。茶树精油和柠檬醛通过影响灰霉菌或指状青霉细胞的线粒体形态和功能从而实现其抑菌性能[17,28];茶树精油组分松油醇能阻断灰霉菌细胞线粒体功能和呼吸链相关基因的表达,而线粒体功能失调触发了氧化应激反应[22];肉桂醛和柠檬醛使扩展青霉中能量代谢相关的基因出现下调[21];柠檬醛能下调指状青霉的NADPH和COX基因表达水平[27]。本实验研究结果与上述研究结果一致,即芥末精油包合物加速了线粒体功能失调和呼吸链紊乱,而线粒体功能障碍进而引发了氧化应激反应(如CAT表达上调)。

表2 转录组DEGs验证结果Table 2 Verification of differentially expressed genes in transcriptome
2.6 基于转录组数据的芥末精油包合物抑制棘孢曲霉机制分析
2.6.1 芥末精油包合物对参与细胞结构基因表达的影响
线粒体膜相关的基因中出现6 个显著上调、13 个显著下调;线粒体内膜相关的基因中出现4 个显著上调、11 个显著下调;细胞器内膜相关的基因中出现4 个显著上调、11 个显著下调(表3)。控制生物膜形成的基因显著下调,说明膜的完整性遭到破坏[29]。编码线粒体内膜蛋白复合物的基因中出现2 个上调,7 个下调(表3)。生物膜成分的改变可能造成膜流动性和通透性的变化[30]。水芹烯和壬醛会严重破坏青霉菌细胞膜完整性,从而导致细胞组分和钾离子的渗漏[31]。茶树精油能导致葡萄孢菌胞外电导率的增加,间接反映细胞膜完整性遭到破坏[32]。6 个调控细胞成分运动的基因都显著下调,说明细胞成分改变;细胞外区域有关的基因均发生显著变化;细胞骨架相关的5 个基因显著下调;肌动蛋白丝运动的调控与细胞骨架相关,对应的6 个基因全部下调(表3)。因此,芥末精油包合物处理导致线粒体膜等生物膜受损、细胞成分改变、细胞骨架等细胞器的形成和功能发生变化。上述研究结果与2.3节TEM观察结果一致。
2.6.2 芥末精油包合物对参与DNA/RNA合成代谢、运输能力以及有丝分裂的影响
核酸结合转录因子活性相关基因出现39 个上调、34 个下调;转录因子活性(序列特异性DNA结合)相关基因出现39 个上调、34 个下调;RNA聚合酶II转录因子活性(序列特异性DNA结合)相关基因出现38 个上调、32 个下调(表4)。上述结果表明芥末精油包合物处理对棘孢曲霉DNA和RNA的生物合成和代谢造成了显著影响,进而使蛋白质合成[33]和功能受限[34]。跨膜转运相关基因出现40 个上调、31 个下调;无机阳离子跨膜转运相关基因出现10 个上调、15 个下调;单价无机阳离子跨膜转运相关基因出现7 个上调、13 个下调;氢离子跨膜转运相关基因出现7 个上调、12 个下调(表4)。综上可知,芥末精油包合物处理显著影响了棘孢曲霉体内跨膜运输调节,跨膜信号转导紊乱进一步影响细胞的正常生理功能。由表4可知,与细胞有丝分裂相关的基因整体呈现下调。与有丝分裂细胞动力学过程相关基因出现4 个下调;收缩环收缩相关基因出现3 个下调;有丝分裂肌动球蛋白收缩环收缩相关基因出现3 个下调;肌动球蛋白收缩环收缩相关基因出现3 个下调(表4)。此外,钙离子结合相关基因出现11 个下调(表4)。钙离子通过与特定钙受体或者钙结合蛋白绑定实现其生物学功能,调控细胞信号传导和细胞生命周期(包括细胞分裂、分化和凋亡)等过程[35]。因此,芥末精油包合物处理显著抑制了棘孢曲霉细胞有丝分裂过程,从而抑制体细胞产生。上述研究结果特别是有丝分裂部分与2.2节SEM观察结果部分一致,即处理组菌丝直径和孢子囊数量显著小于对照组。
2.6.3 芥末精油包合物对酶活性相关基因表达的影响
糖苷水解酶活性相关基因出现22 个上调、17 个下调(表5)。5 种α-葡萄糖苷酶活性相关基因都出现显著下调,说明显著抑制了葡萄糖的产生;α-1,6-甘露糖基转移酶相关基因出现3 个下调,β-果糖呋喃糖苷酶相关基因也出现3 个下调;丝氨酸型内肽酶相关基因出现2 个上调、7 个下调,说明氨基酸的生物合成受到影响;与呼吸电子传递链相关的几种酶(包括ATPase复合物、细胞色素c氧化酶、ATP合酶复合物和血红素-铜端氧化酶)相关基因整体上呈现下调,说明菌体能量代谢呈现异常;氧化还原酶活性的相关基因出现3 个显著上调、13 个显著下调(表5)。综上可知,芥末精油包合物处理对棘孢曲霉体内酶活性相关的基因转录水平产生了显著影响,酶活性的变化直接或间接影响了生物大分子的功能、代谢反应的发生、细胞进程的改变。
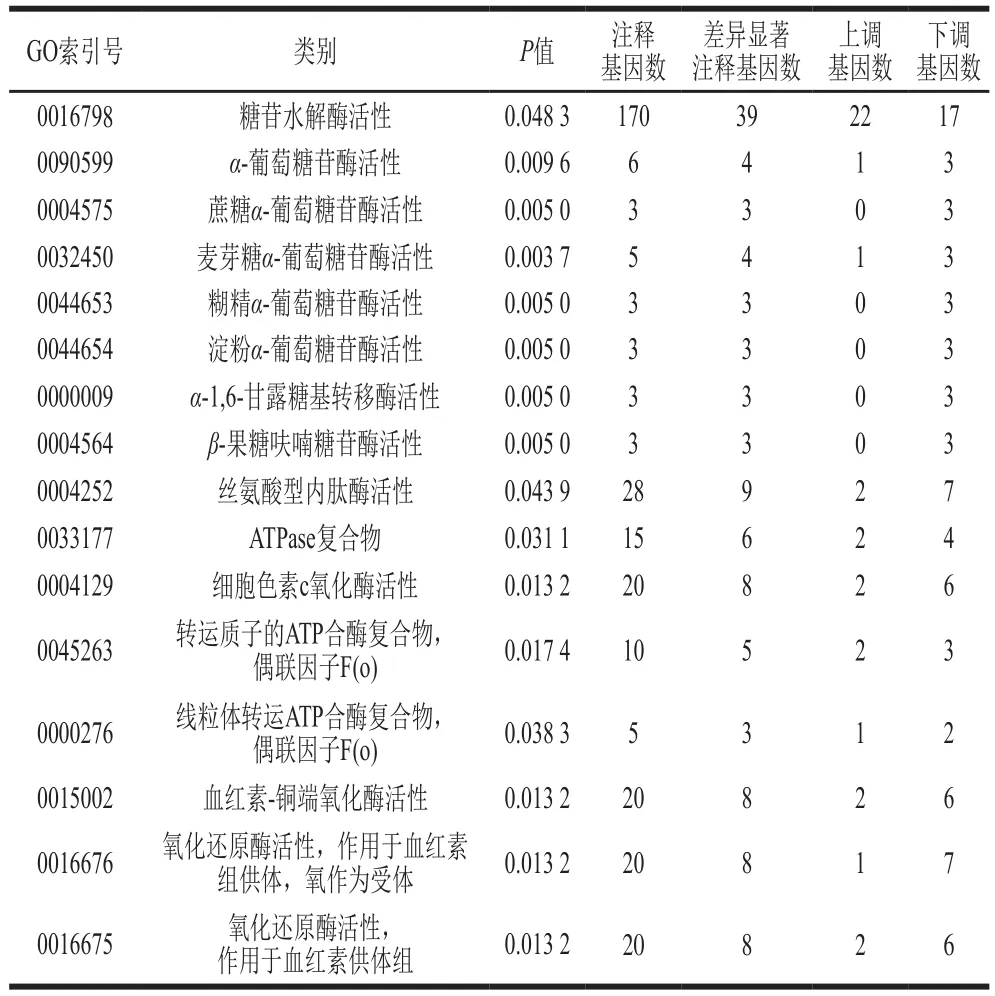
表5 部分与酶活性相关的差异基因转录水平Table 5 Transcription levels of differentially expressed genes related to enzymatic activities
2.6.4 芥末精油包合物对呼吸电子传递链相关基因表达的影响
黄素腺嘌呤二核苷酸结合相关基因出现30 个上调、15 个下调;呼吸电子传递链相关基因出现4 个上调、9 个下调;需氧呼吸相关基因出现2 个上调、5 个下调;细胞呼吸相关基因出现2 个上调、5 个下调;氧化磷酸化相关基因出现1 个上调、3 个下调;细胞色素复合物相关基因出现2 个上调、6 个下调;线粒体呼吸链复合物相关基因出现1 个上调、3 个下调;质子转运两扇区相关基因出现1 个上调、3 个下调(表6)。此外,肌球蛋白是真核细胞内的一类ATP依赖型分子马达[36]。肌球蛋白结合相关3 个基因全部下调。上述结果与2.6.3节中与呼吸电子传递链相关的几种酶相关基因出现整体下调结果一致。综上,芥末精油包合物处理显著抑制了呼吸电子传递链及能量代谢水平,从而影响细胞的正常生理功能。
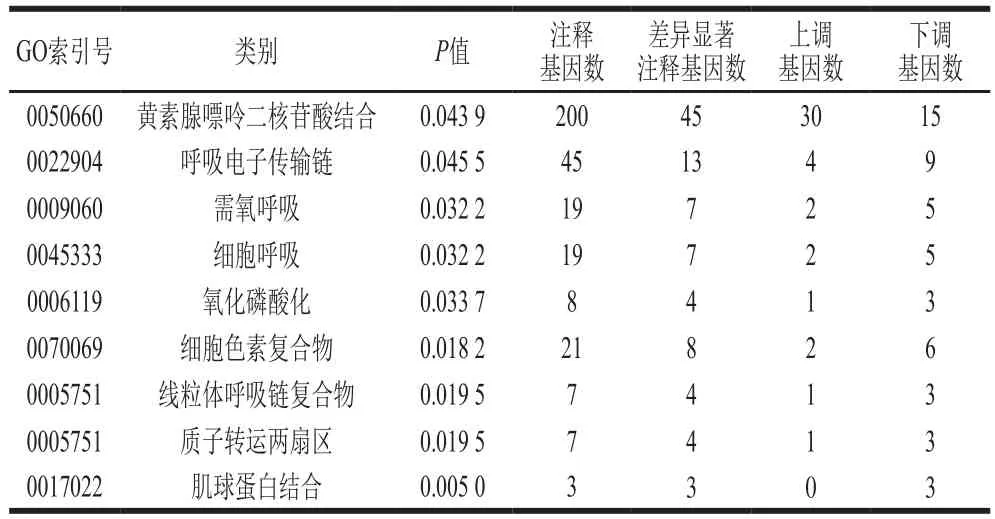
表6 部分与呼吸电子传递链相关的差异基因转录水平Table 6 Transcription levels of differentially expressed genes related to respiratory electron transport chain
3 结 论
芥末精油包合物具有抑制棘孢曲霉的良好活性且存在明显量效关系,其EC50为1.00 g/L;SEM观察发现EC50下芥末精油包合物使棘孢曲霉菌丝、分生孢子及孢子形态发生明显变化且孢子顶囊数量大幅减少;TEM观察结果表明EC50的芥末精油包合物使棘孢曲霉菌丝细胞的细胞壁、细胞膜以及细胞器出现异常。芥末精油包合物处理后,1 057 个DEGs中有528 个上调基因和529 个下调基因;采用实时荧光定量PCR对8 个差异基因进行验证,得到与转录组测序结果一致的基因表达量变化趋势;综上,芥末精油包合物处理后,棘孢曲霉线粒体膜等生物膜受损、细胞成分改变、细胞骨架等细胞器形成和功能发生变化;DNA和RNA的生物合成和代谢受到显著影响;酶活性相关基因、跨膜运输调节相关基因受到显著影响;有丝分裂过程受到严重抑制从而抑制体细胞产生;呼吸电子传递链及能量代谢水平受到显著抑制。
