circPVT1在子宫腺肌病内膜组织和细胞中的表达及临床意义
2021-12-01王祎祎汪沙段华
王祎祎,汪沙,段华*
作为“基底膜内陷”致病学说的直接证据[1-2],目前普遍认为子宫腺肌病(adenomyosis,ADS)发生与有活性的在位内膜向子宫肌层内陷、生长,并异位增生、存活有关,尤其凸显在位子宫内膜细胞异常增殖与凋亡、黏附、侵袭等在ADS发生发展中的影响。环状RNA(circular RNA,circRNA)的异常表达可诱导肿瘤、心血管、神经内分泌等多种人类良恶性疾病发生[3]。Hsa_circ_PVT1(circPVT1)是位于癌症易感基因座8q24的circRNA,已有众多研究揭示其在胃癌、非小细胞肺癌、头颈部鳞癌及急性淋巴细胞白血病等多种恶性肿瘤组织和细胞中过表达,以“癌基因”形式介导细胞增殖、侵袭、迁移等生物学行为,与肿瘤生长及转移等过程密切相关[4]。然而,ADS在位内膜在一定程度上呈现类似恶性肿瘤细胞的生物学特征,而circPVT1与ADS发生是否存在关联,以及能否通过介导ADS内膜细胞异常增殖、侵袭进而影响ADS的致病和表现,目前尚不清楚。本研究拟通过检测circPVT1在ADS内膜组织和细胞中的表达,分析其与ADS临床特征的相关性,评价干扰circPVT1后ADS内膜细胞增殖与侵袭力的变化,探讨其在ADS发生发展中可能的作用。
1 资料与方法
1.1 临床资料
选取2018年6月至2019年2月于首都医科大学附属北京妇产医院妇科微创中心因ADS行全子宫切除术的45例患者入ADS组,ADS确诊采用美国生育协会的病理诊断标准:据基底层子宫内膜下至少一个低倍镜(100倍)视野深处,可见子宫内膜腺体与间质。同期宫颈上皮内瘤变Ⅲ级(cervical intraepithelial neoplasia Ⅲ,CINⅢ)或宫颈癌IA1~IB1期行全子宫切除的患者45例入对照组。排除内膜病变、绝经和(或)年龄≥50岁、术前3个月激素类药物应用史或宫内节育器置入史、合并严重内外科疾病及盆腔炎症性疾病、临床病历资料不完整者。入组病例均知情同意,本研究获医院伦理委员会批准。两组一般情况比较详见下页表1。
1.2 实验试剂
RNAisoPlusRNA提取试剂盒(TaKaRa,日本),PrimeScript RT试剂盒和SYBR Green PCR试剂盒(TaKaRa,日本),DMEM/F12培养基(Hyclone,美国)、胎牛血清FBS(BD,美国),CCK-8(Dojindo,日本),transwell侵袭小室(Costar,美国),慢病毒载体目的质粒(吉凯基因,中国上海),lipofectamine 3000(Invitrogen,美国)。
1.3 实验方法
1.3.1 组织取材 手术室中离体子宫立即由专人无菌操作“Y”形剖开,刮取宫腔内暴露的子宫内膜组织5~10 g至无菌培养管(内容5 mL的1%青链霉素的生理盐水)用作原代子宫内膜细胞分离培养,另留取内膜组织于-80°C冻存,用于后续总RNA提取。
1.3.2 原代子宫内膜上皮及间质细胞分离培养 无菌PBS清洗离体子宫内膜组织2~3遍后,组织剪剪碎至肉末状,3~5倍体积的0.2%胶原酶I和0.005% DNA 酶振荡消化45~60 min,100 um滤网过滤弃去残渣,低速离心(760 rpm,3 min),40 um滤网过滤并收集滤液A,原沉淀以含10% FBS的DMEM/F12重悬获得细胞悬液B,再次离心A和B(1 200 rpm,3 min)后弃去上清,B管沉淀重悬接种至6 cm2细胞培养皿;A管再次离心后沉淀重悬接种。置于37°C/5% CO2的培养箱中培养至细胞融合80%以上,1∶2消化传代。对P1代细胞进行电镜或免疫荧光鉴定,确定A、B来源细胞分别为子宫内膜间质细胞(endometrial stromal cells,ESC)和子宫内膜上皮细胞(endometrium epithelial cell,EEC)。
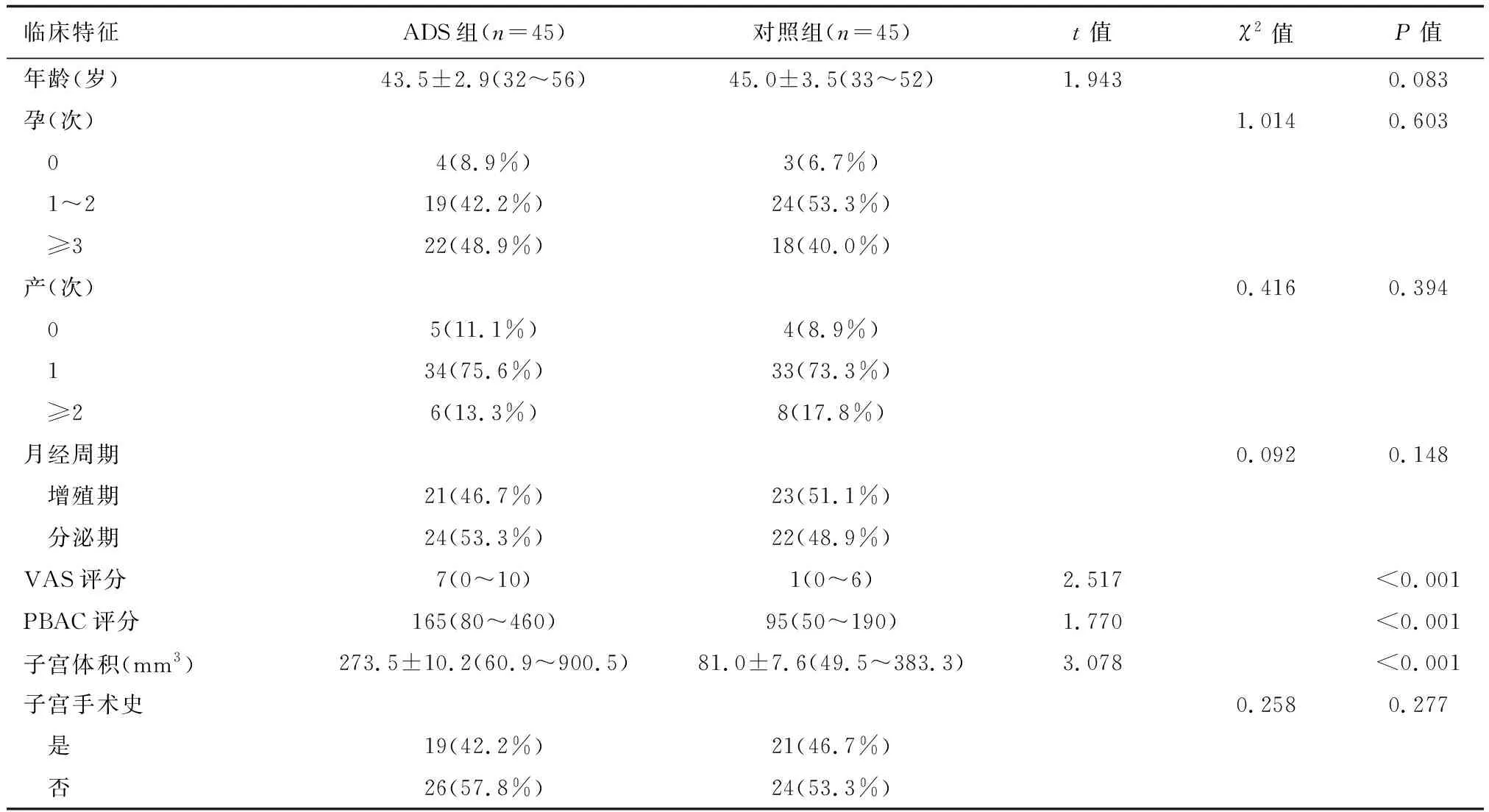
表1 两组患者临床特征比较
1.3.3 qRT-PCR检测circPVT1表达 按照试剂盒说明提取内膜组织和细胞总RNA,反转录合成cDNA,并进行PCR反应扩增。引物设计和合成由中国上海生工生物科技公司完成。相应引物序列如下:目的基因circPVT1上游序列:5′-CGACTCTTCCTGGTGAAGCATCGAT-3′,目的基因circPVT1下游序列:5′-TACTTGAACGAAGCTCCATGCAGC-3′;内参基因GAPDH上游序列:5′-GGACCTGACCTGCCGTCTAG-3′,内参基因GAPDH下游序列:5′-TAGCCCAGGATGCCCTTGAG-3′。采用2-ΔΔCT法计算相对表达量,独立重复3次实验。
1.3.4 细胞转染和筛选 原代培养人ADS在位内膜上皮细胞(ADS_EEC)及间质细胞(ADS_ESC)并传代培养至P2。向细胞内转染慢病毒载体目的质粒sh-circPVT1及干扰阴性对照Sramble,同时每组设置正常培养未经转染的细胞作为完全阴性对照组NC。转染过程为:接种ADS_EEC和ADS_ESC于不同6 cm2细胞培养皿中培养至细胞融合度达50%~60%时,按照lipofectamine 3000说明书操作,次日更换培养基,72 h后加入1μg/μL嘌呤霉素筛选并利用qRT-PCR技术对转染效率进行验证。
1.3.5 CCK-8细胞增殖实验 细胞转染72 h经筛选后以4 000个/孔密度接种于96孔板,每孔设3个复孔,置于37°C/5% CO2的培养箱中分别培养24 h/48 h/72 h/96 h,更换培养基后每孔加入CCK-8试剂10 μL,培养箱中孵育1 h,酶标仪检测每孔于450 nm处吸光度(OD值)。独立重复实验3次。
1.3.6 Transwell侵袭实验 以无血清的DMEM/F12培养基按1∶8稀释基质胶后,加入50 uL/孔于transwell上室,置于37°C培养箱铺板30 min。转染后的细胞以5×105个/孔密度接种至上室,并加入200 μL无血清DMEM/F12。下室加入600 μL含10% FBS的培养基培养48 h后,以4%多聚甲醛固定下室细胞、并以0.1%结晶紫染色。倒置显微镜下随机选择5个视野观察拍照。
1.4 视觉模拟评分及月经失血评分图评分标准
视觉模拟评分(visual analog scale,VAS):0分为无痛;3分以下为轻度疼痛;4~6 分为中度疼痛;7~10 分为重度疼痛。月经失血评分图(Pictorial blood loss assessment chart,PBAC):根据每条卫生巾月经血染面积及使用卫生巾数量来计算,面积≤整个卫生巾1/3计为1分,1/3~3/5计为5分,大于3/5计为10分。
1.5 统计学处理
2 结果
2.1 circPVT1在子宫腺肌病内膜组织和细胞中的表达检测
qRT-PCR结果显示:与正常子宫内膜组织(Con_En)相比,circPVT1的相对mRNA水平在ADS在位内膜(ADS_Euc)及异位内膜组织(ADS_Ec)中均显著升高(P<0.001),但ADS在位与异位内膜组织相比,circPVT1表达水平差异无统计学意义(P>0.05),见下页图1A;circPVT1在ADS_EEC及ADS_ESC中表达水平均高于正常内膜上皮(Con_EEC)及间质细胞(Con_ESC)(P<0.001),并且其在ADS_ESC中的相对表达量要高于ADS_EEC(P<0.001),见下页图1B。
2.2 circPVT1表达水平与子宫腺肌病患者痛经程度及月经量的关系
Pearson相关性分析结果显示:circPVT1在ADS在位内膜组织中的表达水平与患者PBAC评分呈中等程度正相关(r=0.539,P=0.017);circPVT1在ADS异位内膜的表达水平与患者痛经程度VAS评分呈强正相关(r=0.614,P=0.009)。
2.3 干扰circPVT1表达后对子宫腺肌病内膜上皮和间质细胞增殖力的影响
在ADS内膜上皮和间质细胞中转染sh-circPVT1后利用qRT-PCR作干扰效率验证。结果显示,与未转染组(NC组)及转染阴性对照组(Scramble组)相比,转染sh-circPVT1后细胞内circPVT1表达水平显著下降,差异均有统计学意义,见图2A。随后CCK-8细胞增殖实验结果显示,干扰circPVT1表达(sh-circPVT1组)后的ADS_EEC和ADS_ESC增殖能力显著低于未转染组(NC组)和转染阴性对照组(Scramble组);NC组和Scramble组间比较,ADS_EEC及ADS_ESC细胞增殖活性均无明显差异,见图2B,2C;培养96 h后测得细胞活力百分比值在sh-circPVT1组显著降低,见图2D。

A.circPVT1在ADS和正常子宫内膜组织中的表达;B.circPVT1在ADS和正常子宫内膜上皮及间质细胞中的表达。****P<0.0001;***P<0.001;**P<0.01;NSP>0.05。图1 circPVT1在子宫腺肌病内膜组织和细胞中的mRNA表达水平
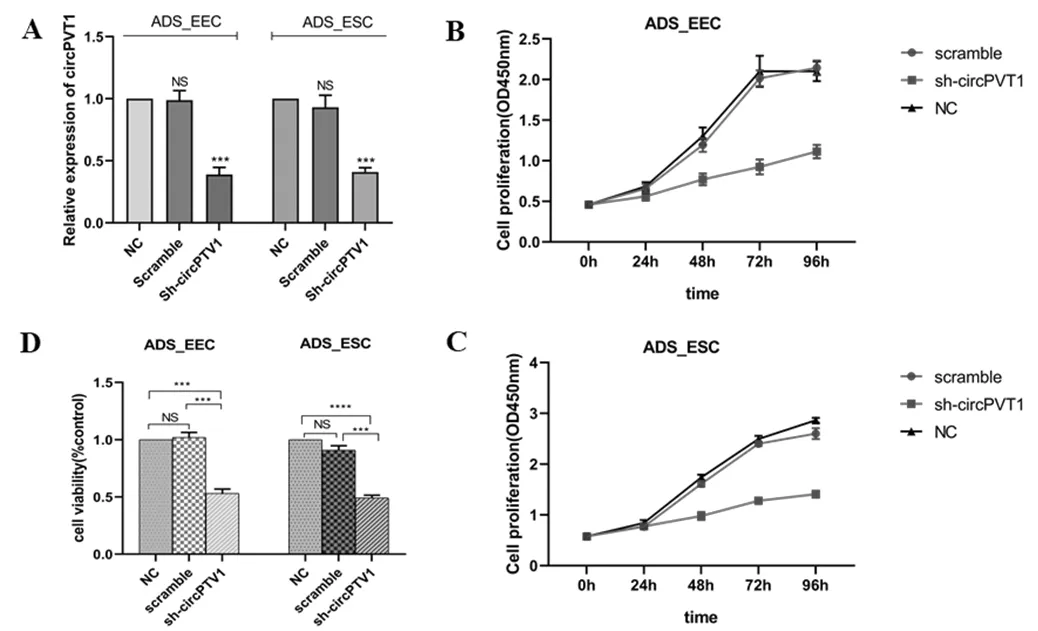
A.qRT-PCR检测ADS_EEC及ADS_ESC细胞转染Sh-circPVT1后circPVT1表达水平,行转染效率验证;B.干扰circPVT1表达后ADS_EEC增殖OD值;C.干扰circPVT1表达后ADS_ESC增殖OD值;****P<0.0001;***P<0.001;**P<0.01;NSP>0.05。图2 干扰circPVT1后子宫腺肌病内膜细胞体外培养不同时间OD值(CCK8)及 96 h后细胞活力检测
2.4 干扰circPVT1表达后对子宫腺肌病内膜上皮和间质细胞侵袭力的影响
Transwell侵袭小室实验结果显示,与转染circPVT1阴性对照组(Scramble组)相比,干扰组(sh-circPVT1组)侵袭穿透至下室的ADS_EEC显著减少,提示干扰circPVT1表达后ADS_EEC侵袭能力减弱,见图3A、3B(见彩插1);类似地,干扰circPVT1表达后,ADS_ESC在sh-circPVT1组的侵袭能力较Scramble组亦显著降低,见图3C、3D(见彩插1)。
3 讨论
3.1 子宫腺肌病发生与在位内膜组织和细胞异常生物学行为改变
ADS的发生机制至今尚未完全阐明,目前普遍支持由有活性的在位子宫内膜向肌层内陷、侵袭生长,并异位增殖导致腺肌病发生,是为ADS本质。近年来,随着对ADS在位内膜参与ADS致病机理研究的拓展和深入,发现ADS在位内膜存在诸多分子和代谢异常,尤其突出表现为内膜细胞增殖力强化、凋亡抵抗明显,即认为在位内膜细胞异常的增殖、凋亡是后续诸多生物学行为改变的基础和前提[5-6]。大量研究证实,促进ADS在位内膜间质细胞增殖、抑制其凋亡,可能诱导子宫内膜向肌层异位种植的发生,并且细胞中呈现低表达的凋亡相关基因GRIM-19可通过抑制STAT3磷酸化诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)合成,促进内膜组织中生成新生血管,进一步为ADS病灶的异位存活、生长提供物质基础[7]。另一方面,在位内膜细胞的局部黏附、迁移、侵袭能力增强则是ADS内膜向子宫肌层浸润生长的关键环节。本课题组前期研究显示局部黏着斑激酶(focal adhesion kinase,FAK)在ADS内膜组织和细胞中表达均上调,并进一步揭示其可能通过增强在位内膜间质细胞的侵袭力参与ADS发生[8-9]。
3.2 环状RNA介导子宫腺肌病在位内膜致病机理的潜在可能
circRNA为缺乏5’3’末端的连续共价闭环,80%以上来源于基因反向剪接的外显子。由于其环状闭合结构的可靠稳定性、丰度高、种类多、时空特异性表达、序列高度保守等特性[10-11],使其在RNA研究领域显出独有优势。在妇科领域,circRNA与多种女性生殖系统疾病关联密切[12],包括:与宫颈癌HPV感染致病相关、通过miRNA-靶基因轴调节宫颈癌细胞的生物学行为、影响宫颈癌细胞的放疗抵抗过程;介导卵巢癌发生发展的生物学调控、作为卵巢癌预后的评估指标;参与子宫内膜癌的早期诊断;以及作用子宫内膜蜕膜化过程、改变内膜容受性、介导女性不孕症发生等。近年来,国内外学者在卵巢子宫内膜异位症(endometriosos,EMs)中初步构建了circRNA差异化表达模式及相关调控网络,并分析EMs内膜中表达失调的circ_103470、circ_101102等通过mTOR 、Hippo、HIF-1等多条信号通路影响EMs发生[13-15]。ADS在发病机制和疾病特点等方面与EMs存在共通之处,但circRNA与ADS病因病机的相关研究罕有报道。本研究利用qRT-PCR技术揭示了circPVT1在ADS与正常子宫内膜组织和细胞中的差异化表达模式,并进一步分析提示ADS内膜中高表达的circPVT1与患者典型临床特征痛经程度、月经量异常密切相关,结果初步表明环状RNA这一类非编码家族新成员可能介导ADS的致病机理,并影响疾病进展或转归的潜在可能。
3.3 干扰circPVT1表达可抑制子宫腺肌病在位内膜细胞异常增殖与侵袭
CircPVT1是源自浆细胞瘤多样异位基因1(plasmacytoma variant translocation,PVT1)的外显子-2剪接形成的环状RNA,在胃癌、肝细胞癌、非小细胞肺癌、骨肉瘤、头颈部鳞癌、淋巴细胞白血病等多种人类恶性肿瘤组织中表达升高,发挥“癌基因”作用,通过靶向多种miRNA介导肿瘤细胞异常增殖、侵袭、转移、上皮间质转化等过程,其本身的转录合成可受经典的TP53-YAP-TEAD复合体靶向正调节[16-18]。此外,本课题组前期研究发现在ADS中呈现异常表达的miR-let7b也被证实可受circPVT1负调控,介导衰老抑制因子表达,延缓细胞衰老与凋亡[19-20]。本研究在对circPVT1组织表达水平检测的基础上,进一步利用体外培养的人ADS在位内膜上皮和间质细胞,对细胞内的circPVT1表达进行干预,结果显示ADS内膜细胞的增殖明显受抑,侵袭力也显著降低,提示circPVT1可在体外调控ADS在位内膜细胞异常增殖与侵袭,这可能是其介导子宫内膜向肌层浸润、增生及异位存活的关键环节之一。
综上所述,环状RNA circPVT1在ADS内膜组织和细胞中的表达水平均升高,可能通过介导ADS在位内膜上皮及间质细胞异常增殖、侵袭参与ADS致病机制,并与ADS患者的痛经程度和月经量改变等临床特征密切相关,因而有可能成为ADS诊断的新型标志物和潜在干预靶标。但是,ADS的发生是涉及多因素、多环节的复杂过程,有关circPVT1在ADS疾病进程中的确切作用和具体机制仍需更多的后续研究阐明。
