BKM120对紫杉醇耐药卵巢癌细胞的抑制作用*
2021-12-01林城江
林城江,陈 冰
(上海交通大学医学院附属瑞金医院药剂科,上海 200025)
卵巢癌为女性常见恶性肿瘤,Ⅲ~Ⅳ期卵巢癌患者 经过手术及化学治疗(简称化疗)后,5年生存率仅20%~30%[1-5]。其常规化疗一线药物主要为紫杉醇类与铂类药物。多药耐药性(MDR)是细胞对一种药物产生耐药性的同时,对其他结构和作用靶点类似或不相同的抗肿瘤药物也产生耐药性[6-8]。P-糖蛋白(P-gp)过表达是研究最多的一种多药耐药机制,它是三磷酸腺苷(ATP)依赖性“药泵”,多种多药耐药细胞均可过度表达P-gp,其水平与耐药程度有关。YANG等[9]发现,P-gp和抗凋亡相关蛋白的过表达与卵巢癌细胞对紫杉醇的耐药相关。磷脂酰肌醇-3-激酶(PI3K)信号通路具有调节细胞增殖、分化、凋亡等多种功能,并参与肿瘤的多药耐药[10-12]。BKM120属口服泛Ⅰ型PI3K抑制剂,作用于p110α,p110β,p110δ和p110γ,抑制细胞内Akt的磷酸化,在体内外抑制多种肿瘤细胞的生长[13-16]。紫杉醇耐药卵巢癌细胞是以大剂量紫杉醇长期作用于卵巢癌A2780细胞后建立的具有稳定紫杉醇耐药性细胞株,即A2780/Taxol细胞。虽有报道称BKM120对卵巢癌A2780细胞增殖有明显的抑制作用[17],但尚无紫杉醇耐药卵巢癌A2780/Taxol细胞的作用报道。本研究中探讨了BKM120对A2780/Taxol细胞的抑制作用及作用机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
1.1.1 仪器
CX23型光学倒置显微镜(日本Olympus公司);371型气套式CO2恒温培养箱(美国Thermo Electron公司);FACSCalibur型流式细胞仪(美国Becton Dickinson公司);Sp-100UV型紫外分光光度计(英国Unicam公司);Power Pac 200/MINI型通用电泳仪、MINI-Protean型电泳槽、Trans-Blot SD型半干转膜仪(美国Bio Rad公司);BX43型荧光正置显微镜(日本Olympus公司);Tanon 4600型凝胶成像分析仪(中国上海天能科技有限公司);1-14K型台式低温高速冷冻离心机(德国Sigma公司);SW-CJ-1B型净化工作台(中国苏州净化设备厂)。
1.1.2 试药
BKM120(美国MCE公司);顺铂(DDP,齐鲁制药有限公司);青霉素(河南新乡华星药厂);链霉素(吉林济邦药业有限公司);紫杉醇(哈尔滨三联药业股份有限公司);DMEM培养液、RPMI-1640培养液(美国Gibco公司);胎牛血清(FBS,天津市灏洋生物制品科技有限公司);二甲基亚砜(DMSO)、碘化丙啶(PI,美国Sigma公司);MTT试剂盒、TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司);P-Akt抗体、Akt抗体、Bcl-2抗体、Pro-caspase 3抗体、P-gp抗体、β-actin抗体(美国Santa Cruz Biotechnology公司);SDS溶液(北京索莱宝科技有限公司)。
1.1.3 细胞
卵巢癌A2780细胞、紫杉醇耐药卵巢癌细胞A2780/Taxol(南京凯基生物科技发展有限公司)。
1.2 方法
1.2.1 细胞培养
取A2780细胞适量,培养于含10%FBS、100 U/mL青霉素、100μg/mL链霉素的DMEM培养液中;取A2780/Taxol细胞适量,培养于含10%FBS、100 U/mL青霉素、100μg/mL链霉素、800 ng/mL紫杉醇的RPMI-1640培养液中。2种细胞均在37℃及5%CO2培养箱中培养。每周进行2次传代处理。
1.2.2 BKM120对细胞增殖的影响
采用MTT法。取对数生长期的2种细胞,分别制成密度为105mL-1的细胞悬液,接种于96孔板中,每孔0.1 mL,设溶剂对照组和实验①、②、③、④、⑤、⑥、⑦组。分别置37℃及5%CO2培养箱中培养24 h后加入经RPMI-1640培养液稀释的BKM120,其终浓度分别为0,0.1,0.3,1.0,3.0,10.0,30.0,100.0μmol/L。药物作用24,48,72 h后,每孔加入10μL 0.5%MTT溶液,继续培养4 h。每孔加入100μL 10%SDS溶液,置37℃及5%CO2培养箱中培养过夜。采用酶联免疫吸附检测仪在570 nm波长处检测吸光度值(OD)。平行操作3次,计算细胞增殖抑制率[(1-OD实验组)/OD对照组×100%]。并计算半数抑制浓度(IC50)。
1.2.3 BKM120对细胞周期的影响
取对数生长期的2种细胞,分别接种到无菌6孔板中,培养过夜,贴壁。设溶剂对照组和实验A,B,C,D组及DDP组,分别以终浓度为0,0.3,1.0,3.0,10.0μmol/L的BKM120和10.0μmol/L DDP培养液作用24 h,收集细胞,用预冷的磷酸盐缓冲液(PBS)洗涤3次,并用70%乙醇在-20℃下固定过夜。离心,弃去固定液,然后用PBS洗涤细胞后重悬浮于含100μg/mL的PI,50μg/mL的RNA酶,0.1%的Triton X-100的PBS中,37℃,避光,染色30 min。采用流式细胞仪检测,每份样本采集105个细胞,结果用ModFit软件进行分析。平行操作3次。
1.2.4 BKM120对细胞凋亡的影响
取2种细胞(3.5×105个/孔),分别接种于含高压灭菌盖玻片的6孔培养板中贴壁过夜。分组方法同1.2.3项下,加入不同浓度(0,0.3,1.0,3.0,10.0μmol/L)的BKM120和10μmol/L DDP,作用24 h后弃去培养液。PBS洗1次,加入4%多聚甲醛固定45 min,0.1%Triton X-100冰浴2~3 min,PBS洗涤2次,加入50μL TUNEL检测液,37℃避光孵育60 min,以50%甘油封片,显微镜下放大200倍观察细胞形态并拍照。平行操作3次。
1.2.5 BKM120对细胞中相关蛋白表达的影响
采用Western blot法。将2种细胞(106个/孔)接种于6孔板中过夜。分组方法同1.2.3项下,加入不同浓度(0,0.3,1.0,3.0,10.0μmol/L)BKM120和10μmol/L DDP处理24 h。吸除培养液,PBS冲洗,吸净PBS,每孔加入100μL Trizol,冰上裂解20 min,收集细胞,置1.5 mL EP管中,4℃下12000 g离心5 min,取上清液,以Lowry法检测蛋白含量。各组取50μg上样,根据蛋白分子量以8%或12%SDS-PAGE电泳后半干转,转至PVDF膜上,5%脱脂奶粉(含0.1%吐温20)室温封闭1 h,加入一抗4℃封闭孵育过夜,TBST清洗4次,每次8 min。加入辣根过氧化物酶标记的二抗,室温振摇2 h,回收二抗,用含0.1%吐温20的TBST清洗4次,每次8 min。加入ECL化学发光试剂,将PVDF膜放入暗盒中,压上X胶片,取出胶片后显影、定影、清洗。以凝胶成像仪扫描,分析目的条带与内参条带的灰度比值,即为各目的蛋白相对表达水平。
1.3 统计学处理
2 结果
2.1 BKM120对细胞增殖的抑制作用
用0.1~100μmol/L的BKM120处理A2780细胞和A2780/Taxol细胞24,48,72 h,1μmol/L BKM120作用24 h有明显的增殖抑制作用,且随着时间的延长作用增强。BKM120对A2780细胞的IC50为(2.25±0.13)μmol/L,对A2780/Taxol细胞的IC50为(4.17±0.43)μmol/L。详见表1。
表1 各组细胞增殖抑制率比较(±s,%,n=3)Tab.1 Comparison of the inhibition rate of cell proliferation in each group(±s,%,n=3)

表1 各组细胞增殖抑制率比较(±s,%,n=3)Tab.1 Comparison of the inhibition rate of cell proliferation in each group(±s,%,n=3)
注:与溶剂对照组比较,*P<0.05,**P<0.01。下表同。Note:Compared with those in the solvent control group,*P<0.05,**P<0.01,as well as the following tables.
A2780细胞 A2780/Taxol细胞组别浓度(μmol/L)00.10.31.03.010.030.0100.0溶剂对照组实验①组实验②组实验③组实验④组实验⑤组实验⑥组实验⑦组24 h 00.00±0.000.43±2.4814.50±9.96**27.92±3.10**39.25±6.55**34.72±4.22**41.09±5.40**48 h 06.08±3.8716.31±3.71*30.25±1.58**58.58±1.86**78.18±1.87**76.24±1.40**81.29±2.05**72 h 00.90±1.013.20±3.5426.57±14.70**62.94±11.61**86.02±6.65**81.15±7.88**88.92±6.42**24 h 00.80±0.803.01±4.277.12±0.37*14.71±1.02**11.49±5.83*10.81±5.11**25.02±5.07**48 h 02.81±1.419.68±3.84*19.80±3.81**42.73±6.56**58.15±3.26**55.20±1.30**64.66±4.36**72 h 00.80±1.011.10±1.3413.52±4.41**51.53±9.50**70.83±0.72**73.73±1.60**79.58±1.78**
2.2 BKM120对细胞周期的影响
A2780细胞和A2780/Taxol细胞在BKM120作用24 h后出现G1期细胞减少,G2期阻滞,且具有剂量依赖性。从3.0μmol/L开始,实验组与溶剂对照组G2期细胞数有显著差异(P<0.01)。详见表2、图1。
表2 各组细胞周期阻滞情况比较(±s,%,n=3)Tab.2 Comparison of cell cycle arrest in each group(±s,%,n=3)

表2 各组细胞周期阻滞情况比较(±s,%,n=3)Tab.2 Comparison of cell cycle arrest in each group(±s,%,n=3)
组别溶剂对照组实验A组实验B组实验C组实验D组DDP组浓度(μmol/L)00.31.03.010.010.0 A2780细胞 A2780/Taxol细胞G184.67±3.6687.47±0.9691.23±1.2646.61±5.81**49.30±5.40**56.63±8.34**S S 9.72±1.698.02±0.615.08±0.71*12.45±6.05*10.33±2.3340.31±6.83**G25.60±2.824.51±0.893.69±0.5640.93±3.71**40.38±6.12**3.06±1.52 G151.11±6.3151.03±7.6356.33±11.6621.72±8.10**21.17±7.84**25.50±5.87**29.14±6.5031.43±5.4928.18±7.1618.19±4.84**8.53±1.54**53.15±15.84**G219.75±9.8617.54±8.5315.50±6.4260.09±6.23**70.29±6.30**21.37±10.42
2.3 BKM120对细胞凋亡的诱导作用
BKM120作用于A2780细胞和A2780/Taxol细胞24 h后,细胞基因组DNA发生断裂,末端3′-OH显露出来,可在末端脱氧核苷酸转移酶作用下添加荧光素标记的dUTP,显微镜下观察呈现绿色荧光(见图2)。BKM120诱导细胞凋亡呈剂量依赖性,经LSD-t检验,从0.3μmol/L开始,实验组与溶剂对照组间有显著差异(P<0.01)。详见表3。
表3 各组细胞凋亡率比较(±s,%,n=3)Tab.3 Comparison of the apoptosis rate in each group(±s,%,n=3)

表3 各组细胞凋亡率比较(±s,%,n=3)Tab.3 Comparison of the apoptosis rate in each group(±s,%,n=3)
组别溶剂对照组实验A组实验B组实验C组实验D组DDP组浓度(μmol/L)00.31.03.010.010.0 A2780细胞1.56±0.6615.09±3.34*23.76±3.78**42.00±3.84**43.28±2.22**19.92±2.14**A2780/Taxol细胞4.50±1.5912.29±6.07**18.20±3.55**29.58±4.33**30.79±4.54**17.69±2.03**
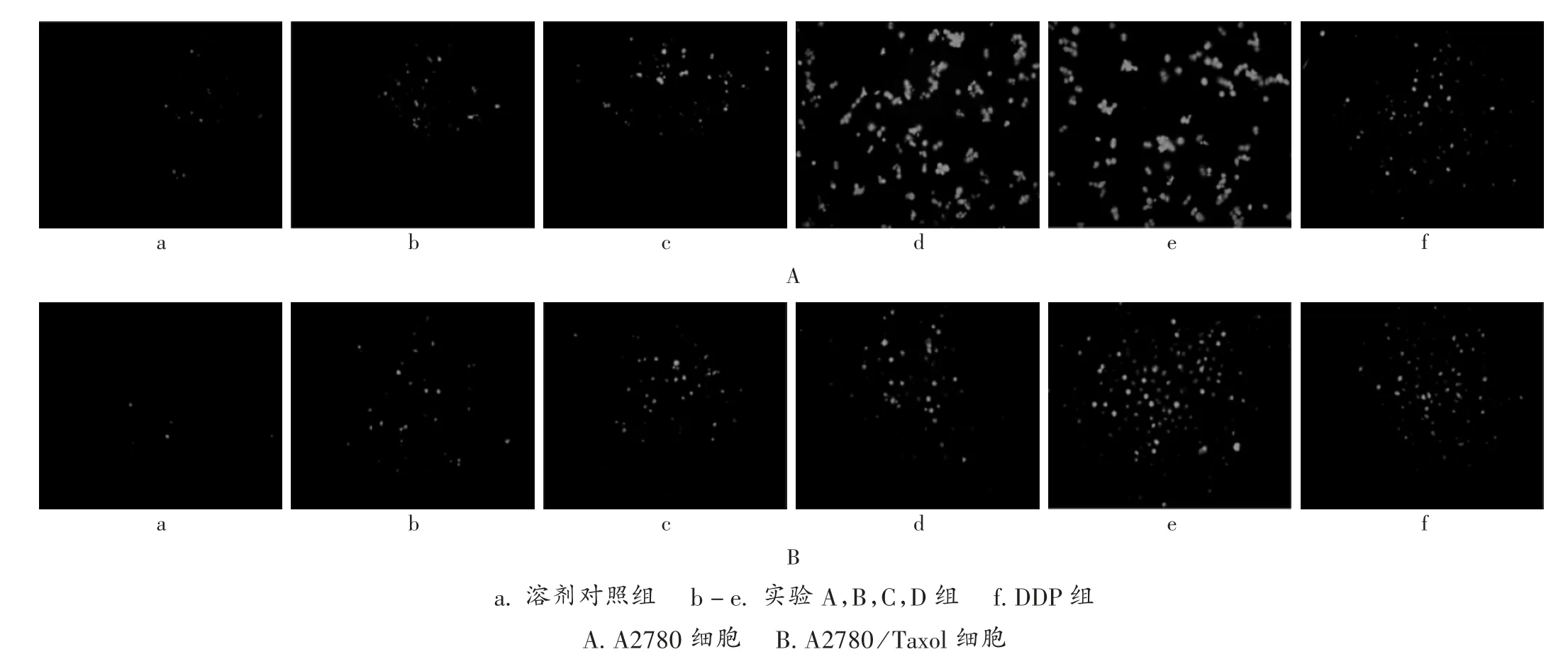
图2 细胞光镜图a.solvent control group b-e.experiment groups A,B,C and D f.DDP group A.A2780 cells B.A2780/Taxol cellsFig.2 Light micrograph of cells
2.4 BKM120对细胞中相关蛋白表达的抑制作用
BKM120可下调P-Akt蛋白的表达,并呈浓度依赖性。3μmol/L BKM120作用于A2780细胞和A2780/Taxol细胞24 h能显著降低P-Akt蛋白表达水平,但对Akt蛋白表达水平无影响;BKM120可显著降低Bcl-2和Pro-caspase 3蛋白表达水平,说明BKM120能抑制Bcl-2蛋白表达,促进caspase 3蛋白表达。详见图3、表4。
2.5 BKM120对A2780/Taxol细胞中P-gp蛋白表达的抑制作用
BKM120下调P-gp蛋白的表达,并呈浓度依赖性。3μmol/L BKM120作用于A2780/Taxol细胞24 h能显著下调P-gp蛋白表达。详见图3、表4。
表4 各组蛋白表达水平比较(±s,%,n=3)Tab.4 Comparison of the expression levels of protein in each group(±s,%,n=3)

表4 各组蛋白表达水平比较(±s,%,n=3)Tab.4 Comparison of the expression levels of protein in each group(±s,%,n=3)
组别溶剂对照组实验A组实验B组实验C组实验D组DDP组浓度(μmol/L)00.31.03.010.010.0 A2780细胞 A2780/Taxol细胞P-Akt/Akt 100.00±0.0080.24±4.0584.77±6.9667.67±5.21**43.20±3.74**82.57±3.28 Bcl-2100.00±0.0098.57±2.7685.68±3.1775.79±2.09*63.64±3.46*60.38±8.64**Pro-caspase 3100.00±0.0097.94±1.2696.99±1.7781.74±2.31*73.19±4.31**81.33±7.34*P-Akt/Akt 100.00±0.00102.10±6.6497.60±5.9654.26±2.16**46.15±1.46**84.44±2.98 Bcl-2100.00±0.0094.78±1.04102.80±1.7274.37±2.20*72.81±1.57**89.77±1.49 Pro-caspase 3100.00±0.0095.62±2.5188.15±2.6175.24±0.64**79.36±1.92**77.82±2.14**P-gp 100.00±0.0097.02±1.3398.19±1.7083.12±2.31*81.59±3.45*80.44±3.30*

图3 蛋白电泳图a.solvent control group b-e.experiment groups A,B,C and D f.DDP group A.A2780 cells B,C.A2780/Taxol cellsFig.3 Protein electrophoresis
3 讨论
PI3K为一种由调节亚单位p85或p101和催化亚单位p110组成的脂激酶,通过催化PIP2,使其发生磷酸化,转化为PIP3,激活下游Akt等[18]。Akt磷酸化活化使许多蛋白质磷酸化,调节细胞活动。研究表明,PI3K/Akt信号通路在多种恶性肿瘤中表达异常,如卵巢癌、乳腺癌、肝细胞癌、肾癌、前列腺癌、淋巴瘤等。在PI3K/Akt信号通路中涉及多个基因,如PIK3CA,Akt1,PTEN等发生突变[19-23]。
本研究结果表明,BKM120抑制A2780细胞和A2780/Taxol细胞的增殖,其作用呈剂量和时间依赖性,IC50均较低,说明其起始有效作用浓度较低,预示有较好的安全性;细胞周期检测结果表明,BKM120可使大部分A2780细胞和A2780/Taxol细胞阻滞于G2期,降低肿瘤细胞的增殖速率;TUNEL荧光染色结果显示,BKM120诱导A2780细胞和A2780/Taxol细胞的凋亡,并呈剂量依赖性,可显著杀伤肿瘤细胞;Western blot实验结果表明,BKM120下调了Akt蛋白磷酸化水平,转运蛋白P-gp和抗凋亡蛋白Bcl-2在A2780/Taxol细胞中表达水平降低。另外,caspase 3的活化在凋亡发生的过程中发挥着重要作用。研究发现,BKM120下调了Pro-caspase 3的蛋白表达,表明BKM120通过抑制Akt蛋白的磷酸化,Bcl-2的表达和激活caspase 3诱导A2780/Taxol细胞凋亡,同时还有效抑制了转运蛋白P-gp的表达,显著减少了紫杉醇耐药肿瘤细胞的药物外排作用,为之后的联合用药提供了很好的条件。
综上所述,BKM120可抑制A2780细胞和A2780/Taxol细胞的增殖,并通过下调Akt蛋白的磷酸化水平和抑制转运蛋白P-gp的表达,降低Bcl-2蛋白表达水平,激活caspase 3诱导细胞凋亡。本研究为未来临床使用BKM120治疗耐药卵巢癌提供了一定的理论依据。
