全球肿瘤疫苗临床转化现状分析*
2021-12-01范云满杨潇逸欧阳昭连
卢 岩,范云满,杨潇逸,张 婷,欧阳昭连
(中国医学科学院医学信息研究所,北京 100020)
世界卫生组织(WHO)《疾病和有关健康问题的国际统计分类》第10次修订本(ICD-10)中将肿瘤分为良性肿瘤、原位肿瘤、恶性肿瘤和不确定或未知肿瘤四大类[1]。癌症泛指所有类型的恶性肿瘤,是全球各国的主要死亡原因,也是延长人类预期寿命的重要障碍。全球癌症负担迅速增长,预计到2040年,全球新发癌症病例将达2840万例,比2020年的1930万例增长47%[2]。针对癌症的有效防治措施的研究应纳入国家层面的卫生计划,以减少全球罹患癌症人数,减轻疾病负担[2-4]。
目前,肿瘤治疗方式包括手术、化学治疗(简称化疗)、放射治疗(简称放疗)等传统治疗手段,以及免疫治疗、靶向治疗、激素治疗等生物疗法。生物疗法在肿瘤的综合治疗中越来越重要,肿瘤疫苗作为生物疗法的重要手段,是近年来研究的热点,进展迅速[5]。临床应用方面,肿瘤疫苗主要作为手术、放疗和化疗后的辅助治疗,帮助预防癌症的复发与转移,另外,已有作用较好的预防性肿瘤疫苗投入了大规模使用,如人乳头瘤状病毒(HPV)疫苗[6]。临床研究方面,已开展大量关于肿瘤疫苗单用或与其他生物疗法联用的临床试验,临床试验数据库ClinicalTrials.gov中与疫苗相关的临床试验约1/3与肿瘤疫苗相关[5]。临床试验是旨在发现或验证某种试验药物疗效与安全性的系统性试验,是药品获得药监部门批准进入临床使用的必要条件,可在一定程度上体现基础研究向临床转化的活跃程度[7-8]。本研究中基于Clinical Trials.gov中注册的肿瘤疫苗临床试验数据,从临床试验注册概况和注册内容两方面分析全球肿瘤疫苗的临床转化现状,为我国加速肿瘤疫苗的临床转化、布局肿瘤疫苗技术路线和实现疫苗产业创新提供参考。
1 资料与方法
1.1 数据来源
临床试验数据库:ClinicalTrials.gov是由美国国立卫生研究院(NIH)和美国食品和药物管理局(FDA)共同开发的临床试验注册和结果数据库,涵盖美国50个州及其他220个国家/地区的约38万项临床试验数据,注册、查询免费,信息更新及时,是目前全球最大、国际认同度最高、使用最普遍的临床试验数据库[9-11]。
检索策略:以“Cancer OR Tumor OR Tumour OR Neoplasm OR Oncolog OR Carcinoma”和“Vaccine”为检索词,在ClinicalTrials.gov的“Condition or disease”和“Intervention/treatment”字段中检索,纳入所有国家/地区的数据,检索日期为2021年1月28日。
纳入标准:受试者为肿瘤患者,疫苗起治疗肿瘤作用;受试者为健康人群,疫苗起预防肿瘤作用。
排除标准:受试者为肿瘤患者,但接种疫苗并非治疗肿瘤;受试者为健康人群,但临床试验目的并非评估疫苗的有效性、安全性或免疫原性,而是评估提高疫苗接种率的某项措施等;其他不符合纳入标准的临床试验。
1.2 方法
采用文献计量学方法,从临床试验数量与时间变化趋势、国家分布、申办者分布及构成、临床试验机构分布、研究类型与方法、临床试验分期、适应证等角度,分析全球肿瘤疫苗领域的临床转化现状。
2 结果
2.1 检索结果
按临床试验检索策略,初始获得肿瘤疫苗相关临床试验2080项,最终纳入1772项。
2.2 临床试验注册概况
数量与时间变化趋势:随着肿瘤疫苗领域科学研究不断取得进展,全球肿瘤疫苗相关临床试验呈增长趋势,详见图1(受制于检索时间且数据库收录存在延迟,图中展示的为近30年数据;“中国肿瘤疫苗领域临床试验”是指在中国开展,即有中国医疗机构参与的肿瘤疫苗临床试验)。全球肿瘤疫苗领域临床试验共1772项,第1项(试验号NCT00002454)开展于1971年,近50%(846项,47.74%)开展于近10年;1995年前,临床试验注册数量一直为个位数;1996年(15项)后总体逐渐增多,至2020年增至87项。中国肿瘤疫苗领域临床试验共102项,占全球的5.76%,第1项(试验号NCT00122681)开展于2004年,大多数(84项,82.35%)开展于近10年;临床试验数量一直较少,年均临床试验注册数量仅5.94项,近3年临床试验数量超过10项。
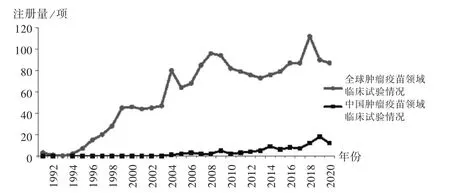
图1 全球和中国肿瘤疫苗领域临床试验注册数量年度分布Fig.1 Distribution of the annual number of clinical trial registrations of tumor vaccines in the worldwide and China
国家分布:全球共72个国家开展了肿瘤疫苗相关临床试验,按注册数量排名前10的国家依次为美国、德国、中国、英国、加拿大、荷兰、法国、比利时、日本和西班牙,详见图2(图中“国家”指临床试验开展地)。其中,美国引领全球,有1102项;德国、中国处于第二梯队,分别有109项、102项;排名前10位国家中后9位数量总和刚过美国临床试验数量的50%(608项比1102项)。

图2 全球肿瘤疫苗领域临床试验注册数量排名前10的国家Fig.2 Top 10 countries in the worldwide in terms of the number of clinical trial registrations of tumor vaccines
申办者分布及构成:申办者是指负责临床试验的发起、管理和提供临床试验经费的个人、组织或机构[8]。肿瘤疫苗领域临床试验申办者数量排名前5的国家分别为美国、中国、德国、英国和日本,详见图3。全球申办者类型以企业最多见,详见图4A。中国申办者类型以医疗机构最多见,详见图4 B。在全球肿瘤疫苗领域,美国国立癌症研究所、美国国立卫生研究院临床中心、默沙东公司、纪念斯隆-凯特琳癌症中心、葛兰素史克公司和约翰斯·霍普金斯大学Sidney Kimmel综合癌症中心表现突出,申办临床试验的数量均不少于40项(见表1)。此外,在此次新冠疫苗开发中表现突出的BioNTech公司(11项)、辉瑞公司(3项)和Moderna公司(2项)均有申办肿瘤疫苗相关临床试验。在中国肿瘤疫苗领域,表现突出的申办者为广州复大肿瘤医院、厦门大学、军事医学科学院附属医院(307医院)和上海泽润生物科技有限公司(见表2)。

图3 全球肿瘤疫苗临床试验申办者主要国家分布Fig.3 Distribution of main sponsor′s countries applying for clinical trials of tumor vaccines

图4 全球和中国肿瘤疫苗临床试验申办者类型构成A.The whole world B.ChinaFig.4 Types and composition of the sponsors applying for clinical trials of tumor vaccines in the worldwide and China

表1 全球肿瘤疫苗领域临床试验注册数量排名前10的申办者Tab.1 Top 10 sponsors in the worldwide in terms of the number of clinical trial registrations of tumor vaccines

表2 中国肿瘤疫苗领域临床试验的主要申办者(注册量≥3项)Tab.2 Main sponsors applying for clinical trials of tumor vaccines in China(number of registrations≥three items)
临床试验机构分布:临床试验机构是新药各期临床试验的实施主体[12]。肿瘤疫苗领域临床试验机构数量排名前10的国家分别为美国、德国、法国、英国、西班牙、意大利、波兰、加拿大、中国和俄罗斯,详见图5。其中,美国医疗机构2294个,中国医疗机构97个(包括中国台湾的14个,中国香港的5个)。在全球肿瘤疫苗领域,临床试验注册数量排名前10的临床试验机构均为美国的医疗机构,这些医疗机构不仅参与了相关临床试验的开展,在多中心临床试验中常为组长单位(牵头单位)。其中,排名前5的分别为丹娜法伯癌症研究院、纪念斯隆-凯特琳癌症中心、MD安德森癌症中心、美国国立卫生研究院临床中心和梅奥医学中心(见表3)。在中国肿瘤疫苗领域,表现突出的临床试验机构为广州复大肿瘤医院、江苏省疾病预防控制中心、中国医药大学附设医院(中国台湾)、成功大学医学院附设医院(中国台湾),详见表4。

表3 全球肿瘤疫苗领域数量排名前10的临床试验机构Tab.3 Top 10 clinical trial institutions in the worldwide in the term of the number of tumor vaccines

表4 中国肿瘤疫苗领域主要临床试验机构(注册量≥3项)Tab.4 Main clinical trial institutions of tumor vaccines in China(number of registrations≥three items)

图5 全球肿瘤疫苗领域临床试验医疗机构国家分布Fig.5 Distribution of countries of clinical trial institutions researching the tumor vaccines in the worldwide
2.3 临床试验注册内容
研究类型与方法:按干预措施是否由研究者决定和分配,临床研究可分为试验性研究和观察性研究[13]。全球肿瘤疫苗领域临床试验中,绝大多数为试验性研究(1740项,98.19%);剩余32项临床试验中,30项为观察性研究,2项为扩展访问试验,其具体研究类型及方法见表5。依据医学研究证据分级,随机对照研究(RCT)证据级别高[13-14],有552项;其次为队列研究(cohort study)、病例对照研究(case control study),分别有20项和4项。与全球情况基本一致,中国肿瘤疫苗领域临床试验也以试验性研究为主(98项,96.08%),余4项为观察性研究(见表5)。其中,证据级别较高的RCT、队列研究和病例对照研究分别有53,3,1项。

表5 全球和中国肿瘤疫苗临床试验研究类型及方法(项)Tab.5 Types and methods of clinical trials of tumor vaccines in the worldwide and China(item)
临床试验分期:全球肿瘤疫苗领域临床试验中,处于0期的有37项(2.09%),均与治疗性肿瘤疫苗相关;处于Ⅰ期的有588项(33.18%),处于Ⅰ期/Ⅱ期或Ⅱ期的有877项(49.49%),以上两部分临床试验大多数与治疗性肿瘤疫苗相关,仅少部分与预防性肿瘤疫苗相关;进入Ⅱ期/Ⅲ期或Ⅲ期的有171项(9.65%),超过50%的与治疗性肿瘤疫苗相关;进入Ⅳ期的有35项(1.98%),约90%与预防性肿瘤疫苗相关,详见图6。中国肿瘤疫苗领域临床试验中,处于0期的有1项,处于Ⅰ期的有27项(26.47%),处于Ⅰ期/Ⅱ期或Ⅱ期的有42项(41.18%);进入Ⅲ期的有24项(23.53%),进入Ⅳ期的有1项。以上临床试验中,有18项与预防性肿瘤疫苗相关,均处于Ⅲ期,评估不同厂家HPV疫苗的功效、免疫原性、安全性和免疫持久性;其余与治疗性肿瘤疫苗相关。

图6 全球及中国肿瘤疫苗领域临床试验分期Fig.6 The phase of clinical trials of tumor vaccines in the worldwide and China
适应证:在全球肿瘤疫苗领域,临床试验注册数量排名前10的肿瘤见图7(由于有些临床试验有多个适应证,因此图中数据存在重叠,图8同),黑色素瘤有448项,淋巴瘤/白血病和乳腺癌/肿瘤均有347项。因疾病谱存在差异,中国肿瘤疫苗临床试验适应证与全球情况有所不同,中国肿瘤疫苗临床试验常见于宫颈上皮内瘤变(22项)、宫颈癌/肿瘤(18项)和胶质母细胞瘤/胶质瘤(15项),详见图8。

图7 全球肿瘤疫苗领域临床试验注册数量排名前10的适应证Fig.7 Top 10 indications of tumor vaccines in the terms of the number of clinical trial registrations in the worldwide

图8 中国肿瘤疫苗领域临床试验注册数量排名前10的适应证Fig.8 Top 10 indications of tumor vaccines in the terms of the number of clinical trial registrations in China
3 讨论
1991年,Threrry Boon实验室发现首个人类肿瘤特异性抗原(TSA)MAGE-1,被认为是肿瘤免疫学和肿瘤免疫治疗学的“里程碑”[5]。经过20余年的积累,基础研究不断取得突破,推动肿瘤疫苗技术逐渐成熟。2010年4月,FDA批准Provenge(Sipuleucel-T)用于治疗晚期前列腺癌,标志着该技术正式进入临床应用[15]。本研究结果表明,基于新的技术路线或针对新适应证的肿瘤疫苗不断进入临床阶段,相关临床试验集中开展于近10年。
临床试验注册概况:1)国家分布。美国境内肿瘤疫苗领域临床试验最活跃,德国和中国较活跃。2)申办者分布和构成。全球临床试验申办者以企业、高校及科研院所为主,美国申办者数量最多;中国临床试验申办者超过50%为医疗机构。3)临床试验机构分布。全球肿瘤疫苗领域美国临床试验机构数量最多,临床试验注册数量排名前20位的临床试验机构均为美国医疗机构,丹娜法伯癌症研究所、纪念斯隆-凯特琳癌症中心和MD安德森癌症中心处于领先地位;中国开展肿瘤疫苗相关临床试验的医疗机构中,广州复大肿瘤医院、江苏省疾病预防控制中心处于领先地位。
临床试验注册内容:1)研究类型与方法。全球肿瘤疫苗领域临床试验几乎全为实验性研究,证据级别较高的RCT占31.15%;与全球情况相同,中国该领域临床试验也以实验性研究为主,RCT占51.96%。2)临床试验分期。全球肿瘤疫苗领域临床试验大多处于临床试验Ⅰ期和Ⅱ期,离正式上市尚早,中国情况相同。3)适应证。全球肿瘤疫苗领域临床试验最常见的适应证为黑色素瘤、淋巴瘤/白血病、乳腺癌/肿瘤、肺癌/肿瘤、前列腺癌/肿瘤;因疾病谱存在差异,中国该领域临床试验适应证与全球情况有所不同,主要包括宫颈上皮内瘤变、宫颈癌/肿瘤、胶质母细胞瘤/胶质瘤。
肿瘤疫苗作为近年新兴的一种免疫疗法,临床应用频率落后于其他几类免疫治疗方法,同时在技术层面也面临着挑战。但总体而言,目前已有的绝大多数肿瘤疫苗的安全性和反应原性良好,随着临床标准的不断完善和技术层面的突破,有望在未来成为肿瘤精准医疗大趋势下的一类重要的肿瘤治疗方式[16]。
本研究的局限性是所依据的临床试验数据集未能包含实际开展的所有肿瘤疫苗相关临床试验,原因为ClinicalTrials.gov仅为全球临床试验注册数据平台之一,且企业开展以产品上市为目的的临床试验可能未注册,因此其注册登记的临床试验数量少于实际开展的数量。但本研究对肿瘤疫苗领域的临床转化现状进行了全面分析,对研究肿瘤疫苗的临床应用、调整肿瘤疫苗的技术储备及实现产业创新具有一定参考价值。
