代偿期乙肝肝硬化进展为慢加急性肝衰竭的危险因素分析和预测模型的构建
2021-12-01徐晶冯慧芬封爽郑珊
徐晶,冯慧芬,封爽,郑珊
(郑州大学第五附属医院 消化内科,河南 郑州 450052)
肝衰竭是临床常见的严重肝病综合征,病死率高。慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)表现为基础慢性肝病快速恶化及多器官功能障碍综合征,短期病死率高,是我国常见的肝衰竭类型[1]。ACLF的诊断标准尚未统一,目前对ACLF的定义多采用2019年亚太肝病研究协会的共识[2]:ACLF是一种急性肝损伤,表现为4周内伴有临床腹水和(或)肝性脑病的慢性肝病/肝硬化患者出现黄疸和凝血功能障碍。中华医学会肝病学分会根据不同慢性肝病基础将ACLF分为3型:A型,即在慢性非肝硬化肝病基础上发生的ACLF;B型,即在代偿期肝硬化基础上发生的ACLF,通常在4周内发生;C型,即在失代偿期肝硬化基础上发生的ACLF[3]。不同基础肝病进展的ACLF在疾病的临床表现、发展、预后等方面存在差异[4]。本研究主要探讨在代偿期乙肝肝硬化基础上发生的ACLF。ACLF是肝病患者常见的死亡原因,具有起病急、进展快、病情重等特点,及时采取适当的干预措施可以改善患者预后[5]。本研究旨在筛选ACLF的危险因素,建立预测模型并评估其在预测代偿期乙肝肝硬化进展为ACLF中的应用价值。
1 资料与方法
1.1 研究对象收集2013年1月至2021年5月郑州大学第五附属医院诊治的代偿期乙肝肝硬化患者的临床资料,参阅《肝硬化诊治指南》[6]和《肝衰竭诊治指南(2018年版)》[3]。本研究通过郑州大学第五附属医院医学伦理委员会审核批准(批准号Y2021018)。
1.2 纳入与排除标准
1.2.1纳入标准 代偿期乙肝肝硬化纳入标准如下。(1)目前HBsAg阳性,或HBsAg阴性,抗-HBc阳性且有明确的慢性乙型肝炎病毒感染史(既往HBsAg阳性>6个月)并除外其他病因。(2)组织学、内镜或影像学检查提示肝硬化或门静脉高压特征,如无上述检查者,符合以下检查指标异常(符合其中2条):①血小板(platelets,PLT)<100×109L-1;②血清白蛋白(albumin,Alb)<35 g·L-1;③国际标准化比值(international normalized ratio,INR)>1.3或凝血酶原时间(prothrombin time,PT)延长;④血小板比率指数(谷草转氨酶与PLT比率指数)>2。(3)同时满足以上2条。ACLF纳入标准如下。(1)存在慢性肝病基础,发病4周内合并肝性脑病和(或)腹水。(2)黄疸迅速加深,血清总胆红素(total bilirubin,T-Bil)≥10×ULN或每日上升≥17.1 μmol·L-1。(3)有出血表现,凝血酶原活动度(prothrombin activity,PTA)≤40%(或INR≥1.5)。(4)同时满足以上 3条。所有纳入本研究的患者均签署知情同意书。
1.2.2排除标准 (1)合并其他嗜肝病毒感染;(2)合并脂肪性、药物性、自身免疫性、酒精性等因素造成的肝损害;(3)合并肝癌或其他恶性肿瘤;(4)合并严重的心、脑、肺等重要器官疾病或中枢神经系统疾病;(5)病历资料不完整;(6)入院前进行人工肝、肝移植治疗。
1.3 研究方法收集患者临床资料,包括年龄、性别、饮酒史、血清生化指标[白细胞(white blood cell,WBC)、PT、纤维蛋白原(fibrinogen,Fib)、结合胆红素(conjugated bilirubin,CB)、Alb、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)、总胆汁酸(total bile acid,TBA)、肌酐(creatinine,Cr)、血清钠离子(serum sodium ion,Na+)]。参阅《肝硬化诊治指南》[6]和《肝衰竭诊治指南(2018年版)》[3],根据入院后4周内是否进展为ACLF,分为Non-ACLF组和ACLF组。以入院为研究起点,Non-ACLF组以入院4周后肝功能基本恢复(T-Bil≤3×ULN且PTA≥70%)为研究终点,ACLF组以入院后4周内发生ACLF为研究终点。
2 结果
2.1 一般情况共纳入390例患者,其中Non-ACLF组287例,ACLF组103例。Non-ACLF组男229例,女58例;ACLF组男67例,女36例。两组性别比较,差异有统计学意义(P<0.05)。见表1。
2.2 单因素分析结果ACLF组的WBC、PT、CB、ALT、GGT、TBA水平均高于Non-ACLF组(P<0.05);ACLF组的Fib、Alb、Na+水平均低于Non-ACLF组(P<0.05)。见表1。

表1 ACLF组与Non-ACLF组临床资料特征比较
2.3 模型构建经单因素分析,两组年龄、Cr比较,差异无统计学意义(P>0.05),以是否进展为ACLF为因变量(Y),以性别、WBC、PT、Fib、CB、Alb、ALT、GGT、TBA、Na+为自变量(X)做logistic回归分析,P<0.05的指标为PT、CB、Alb、TBA,根据其回归系数建立回归方程:
Y=-13.828+0.690×XPT+0.075×XCB-0.224×XAlb+0.107×XTBA。
式中,Y为是否进展为ACLF,X为PT、CB、Alb、TBA。见表2。
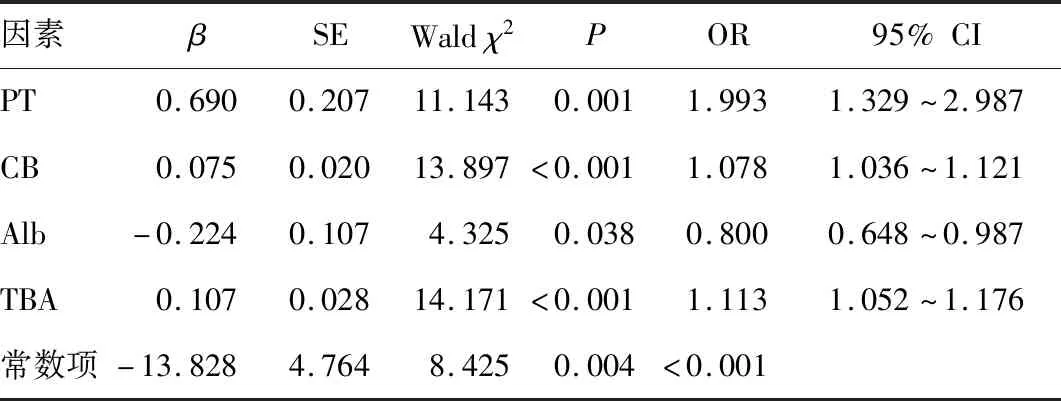
表2 logistic多因素分析结果
2.4 模型的评价采用ROC曲线对建立的模型进行分析,评价其预测ACLF的诊断价值。见图1。

ACLF为慢加急性肝衰竭;AUC为曲线下面积;ROC为受试者工作特征。
图1 预测ACLF的ROC曲线
3 讨论
ACLF内科综合治疗病死率达50%~90%[7]。目前ACLF的内科治疗尚缺乏特效药物和手段,肝移植是最有效也是提高患者生存率的根本方法,但肝移植手术由于难度较大、供体紧缺、费用昂贵等原因无法在临床广泛应用[8]。因此原则上强调早期诊断,早期治疗,采取相应的病因治疗和综合治疗措施,并积极防治并发症[3]。目前国内外对ACLF的研究主要集中在对预后相关因素的探讨,但对ACLF预警的相关研究相对较少,已有的预后指标对ACLF的发生是否具有预测效应也需进一步探讨。因此,建立预测模型,早期筛选ACLF的危险因素,及早进行临床干预,对降低患者病死率、改善预后具有重要意义。
线性回归分析模型logistic回归可用于分析引发疾病的危险因素。在大量ACLF相关危险因素的研究中,大部分在选择变量指标时将T-Bil、INR、PTA纳入回归分析,考虑到这些变量指标与ACLF诊断标准相关,可能导致过度拟合,所以本研究将这些指标剔除,构建回归模型进行分析,研究表明PT、CB、Alb、TBA是预测ACLF发生的独立危险因素。
从筛选出的预测变量来看,凝血功能指标PT是预测ACLF的独立危险因素。邓永东等[9]研究表明,从慢性乙型肝炎到肝硬化、肝衰竭的过程中,PT、活化部分凝血活酶时间逐渐延长。刘慧敏等[10]研究也证实,PT、PTA、INR的最大变化速率是ACLF前期的预警指标,加强上述指标的监测有助于判断病情变化。在ACLF阶段,大量肝细胞受损或坏死,凝血因子几乎无法合成,从而导致PT延长[11]。目前许多研究也发现凝血功能障碍与ACLF的发生有关[12-13],证实了本研究的结论。
胆红素是反映肝功能的重要指标,肝功能减退时,结合胆红素、非结合胆红素均升高,提示肝功能逐渐恶化。目前有关ACLF预警指标的研究主要涉及T-Bil,认为在慢性肝病进展为ACLF的过程中,T-Bil有较好的预测效应[14-15]。为避免过度拟合,本研究未将T-Bil纳入回归模型,得出的结论为CB为代偿期乙肝肝硬化进展为ACLF的危险因素。有研究对754例乙型肝炎病毒相关慢性肝病急性恶化患者(670 例合并肝硬化)进行回顾性分析,得出T-Bil、CB/T-Bil比值是进展为ACLF的独立危险因素[16],这与本研究的结论较为一致。
Alb是反映肝合成功能的重要指标。肝实质损害时,血清Alb水平持续下降,常提示肝细胞坏死进一步加重,同时,TBA清除率降低,血中TBA水平升高。有研究证实,血清Alb和TBA水平可作为判断慢加急性乙型肝炎肝衰竭预后较为敏感的实验室指标[17],但关于二者对ACLF是否有预警作用的研究较少。常城[18]研究表明,在肝炎后肝硬化患者中,随着肝功能损伤等级的升高,TBA水平逐渐升高,Alb水平逐渐降低。Huang等[19]报道前白蛋白水平的下降与肝损伤的严重程度呈正相关。本研究通过构建回归模型进行分析,认为Alb降低、TBA升高是ACLF的危险因素。
综上所述,PT延长、CB升高、Alb降低、TBA升高是乙肝后代偿期肝硬化患者进展为ACLF的独立危险因素。本研究建立的logistic回归模型能较好地预测ACLF的发生,为临床医生早期诊断、治疗ACLF提供理论支持,且这4项指标检测费用较低,操作简便易行,作为ACLF的预测指标,有较好的实用价值。本研究尚存在一些不足之处,纳入样本量较小,可能存在回归模型的拟合偏差,期待课题组继续收集相关患者的临床资料,进一步行大样本、多中心的探索研究。
