社区获得性和医院获得性耐甲氧西林金黄色葡萄球菌的差异
2021-12-01胡玥刘心伟张小倩刘冬梅李永伟
胡玥,刘心伟,张小倩,刘冬梅,李永伟
(河南省中医院/河南中医药大学第二附属医院 检验中心,河南 郑州 450002)
自1961年英国学者Jevons发现耐甲氧西林的金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)以来,MRSA已成为院内感染的重要病原菌之一,因此也习惯被称为医院获得性MRSA(hospital acquired MRSA,HA-MRSA)[1]。近年来,MRSA感染的流行病学发生了明显的变化。有研究发现,在相当长的一段时间内,HA-MRSA的感染能相对保持稳定,但社区获得性MRSA(community acquired MRSA,CA-MRSA)的感染却在逐年增加,并超过HA-MRSA,成为常见的MRSA感染的病因,引起了全世界的广泛关注[2]。因为一旦感染了MRSA,将对青霉素类、β内酰胺类复合药物、头孢烯类(具有抗MRSA活性的头孢菌素除外)和碳青霉烯类药物耐药,给临床治疗带来很大的困难。而Panton-Valentine杀白细胞素(Panton-Valentine leucocidin,PVL)基因被认为是MRSA发展成侵袭性感染的重要因素,因此也可能成为抗生素治疗的潜在靶点。本文根据美国疾病预防控制中心对HA-MRSA和CA-MRSA的筛选标准,对河南省中医院分离出的MRSA菌株进行初步筛选,并对二者的标本来源、耐药性和PVL基因的携带情况进行分析,为MRSA发展成侵袭性感染的预防和精准治疗提供实验数据支持。
1 材料与方法
1.1 材料
1.1.1菌株来源 收集2015年1月至2018年12月河南省中医院分离的214株耐甲氧西林的金黄色葡萄球菌,依据美国疾病预防控制中心对CA-MRSA的筛选标准[2]进行筛选:(1)患者在门诊或入院48 h之内分离到的MRSA菌株;(2)1 a内无住院或医疗机构接触史;(3)无留置各种导管及其他穿透皮肤的医用装置。结合2001年卫生部颁布的《医院感染诊断标准(试行)》进行诊断[3],共筛选出116株CA-MRSA,98株HA-MRSA。所有菌株均采用VITEK2-Compact全自动微生物鉴定仪及相应的配套试剂进行鉴定和药敏试验。
1.1.2主要试剂与仪器 (1)试剂:VITEK2-Compact全自动微生物鉴定卡GP和药敏卡GP67购自法国BioMérieux公司,哥伦比亚血平板、MH琼脂平板购于安图生物科技有限公司,头孢西丁纸片购自英国Oxoid公司,聚合酶链反应(polymerase chain reaction,PCR)Mix、DNA Marker、4s Red plus和琼脂糖均购自上海生工生物工程有限公司。(2)仪器:基因扩增仪、电泳仪和凝胶成像仪均购自美国Bio-Rad公司,低温高速离心机购自德国Eppendorf公司,洁净工作台购自济南鑫贝西生物技术有限公司,恒温水浴箱购自上海一恒科学仪器有限公司。
1.1.3质控菌株 质控菌株为金黄色葡萄球菌ATCC25923和ATCC29213,购自卫生部临床检验中心。PVL基因阳性的金黄色葡萄球菌由同济大学附属上海市肺科医院余方友教授惠赠,本实验室保存。
1.2 操作方法
1.2.1菌株鉴定和药敏试验 采用法国生物梅里埃VITEK2-Compact全自动微生物鉴定和药敏仪及配套的GP和GP67检测卡进行细菌鉴定和药敏试验。对于MRSA菌株,用头孢西丁纸片法进行复核。药敏试验的结果均根据当年最新的美国临床和实验室标准协会标准来判断。
1.2.2MRSA菌株的筛选 根据美国临床和实验室标准协会对MRSA的定义(对苯唑西林耐药的金黄色葡萄球菌称为MRSA)进行筛选。
1.2.3CA-MRSA和HA-MRSA的筛选 根据美国疾病预防控制中心对CA-MRSA的筛选标准[2]和2001年卫生部颁布的《医院感染诊断标准(试行)》进行初步筛选[3]。
1.2.4PVL基因筛选PVL基因引物由上海生工生物工程技术服务有限公司合成,PVL基因的引物序列:PVL F为5’-ATCATTAGGTAAAATGTCTGGACATGA-3’,PVL R为5’GCATCAATGTATTGGATAGCAAAAGC-3’。细菌基因组DNA提取使用上海生工Ezup柱式细菌基因组DNA抽提试剂盒,操作按照说明书进行。反应体系为50 μL,其中Mix混合液25 μL,正向、反向引物各1 μL,模板1 μL,以ddH2O补足体积。扩增条件:预变性95 ℃,5 min,变性95 ℃,30 s,退火52 ℃,30 s,延伸72 ℃,60 s,持续35个循环,最后一步延伸,72 ℃,10 min,1%凝胶成像,拍照保存。
1.2.5数据分析方法 采用WHONET 5.6和SPSS 20.0统计软件处理数据。定性资料CA-MRSA与HA-MRSA标本来源、构成比及PVL基因检测差异的组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料2015年1月至2018年12月,河南省中医院共分离出536株金黄色葡萄球菌,其中MRSA 214株,占40%。MRSA的标本来源中,脓液标本 66株(30.8%),其次是痰液58株(27.1%),耳分泌物42株(19.6%),前列腺液15株(7.0%),全血14株(6.5%),肺泡灌洗液9株(4.2%),引流液8株(3.7%),尿液2株(0.9%)。
2.2 菌株来源差异分析在214株MRSA中,初步筛选出CA-MRSA 116株及HA-MRSA 98株。其中CA-MRSA主要来自于甲状腺乳腺外科的化脓性乳腺炎、耳鼻喉科的化脓性中耳炎和泌尿系统的化脓性炎症的脓液分泌物,HA-MRSA主要来自于下呼吸道感染和血流感染。二者标本来源的构成比比较,差异有统计学意义(P<0.001)。标本来源的区别见表1。

表1 CA-MRSA与HA-MRSA标本来源及构成比[n(%)]
2.3 CA-MRSA与HA-MRSA对常用抗菌药物的耐药性CA-MRSA与HA-MRSA对常用抗菌药物的耐药率见表2。从表中的数据可以看出,2种MRSA均对3种以上常用抗菌药物耐药。2种MRSA对万古霉素、利奈唑胺、奎奴普丁/达福普汀、替加环素和呋喃妥因均100%敏感,对红霉素、克林霉素的耐药率均高于80%,CA-MRSA甚至达到了100%,但是CA-MRSA对环丙沙星、左氧氟沙星和庆大霉素的耐药率低于HA-MRSA(P<0.05)。
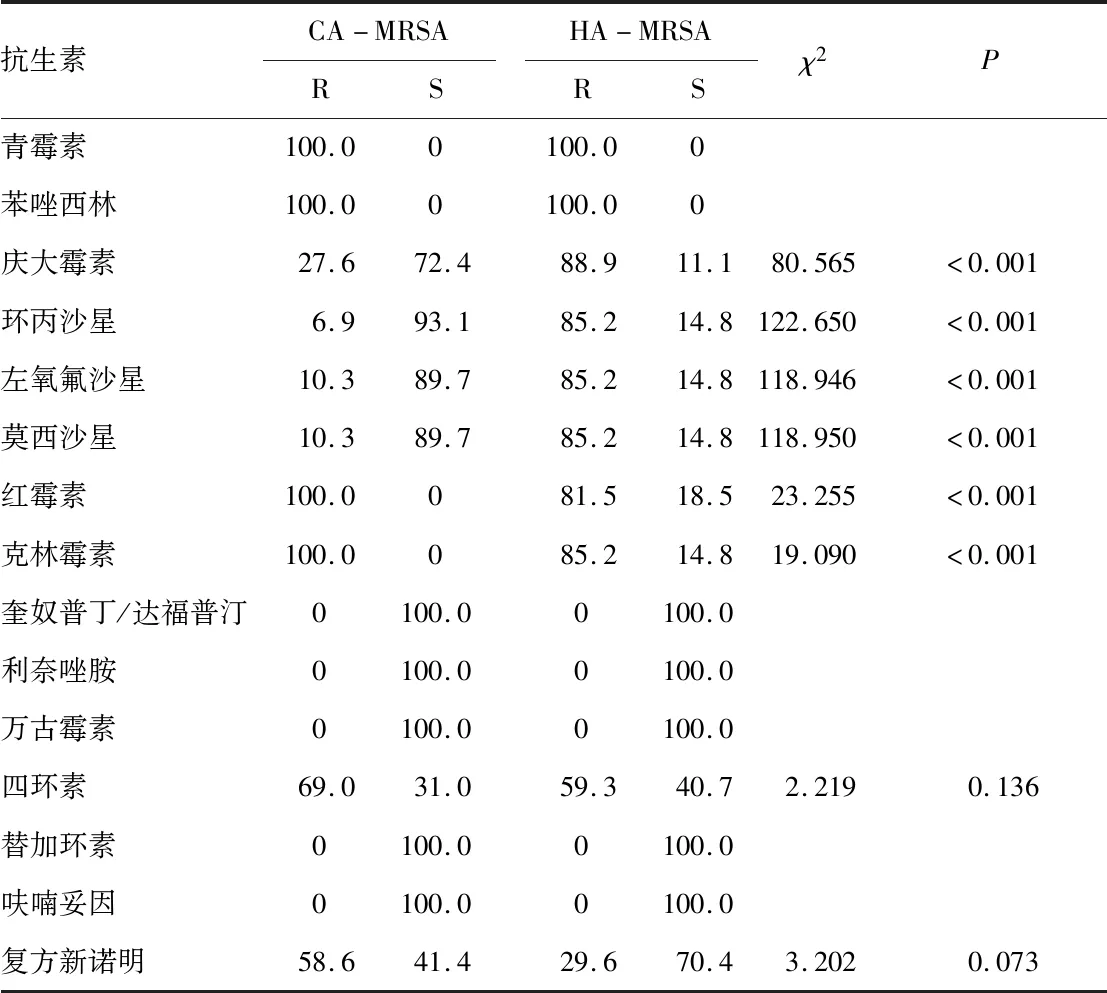
表2 CA-MRSA与HA-MRSA对常用抗菌药物耐药率的比较(%)
2.4PVL基因扩增产物电泳结果本次试验对116株CA-MRSA和98株HA-MRSA进行了PVL基因的检测,部分扩增产物的电泳结果见图1。PVL基因扩增产物长度为433 bp,条带清晰,特异性好。116株CA-MRSA中,有85株携带PVL基因,占73.6%;98株HA-MRSA中,有25株携带PVL基因,占25.5%。CA-MRSA中PVL基因的携带率高于HA-MRSA,差异有统计学意义(P<0.05)。见表3。
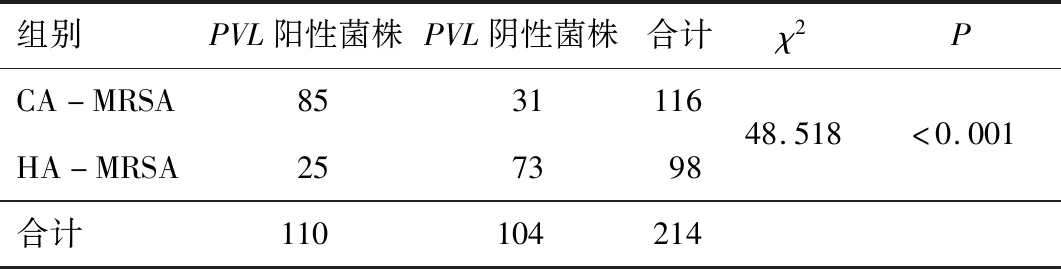
表3 CA-MRSA与HA-MRSA PVL基因检测差异比较

MRSA为耐甲氧西林的金黄色葡萄球菌;PVL为Panton-Valentine杀白细胞素;PCR为聚合酶链反应。
图1 部分PVL基因阳性MRSA PCR电泳图
3 讨论
抗菌药物的大量使用导致耐药细菌的检出呈逐年上升趋势,其中MRSA引发的耐药问题尤为突出。在河南省中医院2015—2018年分离出的214株MRSA菌株中,116株为CA-MRSA,占比54.2%,多来自耳鼻喉科和乳腺外科的皮肤软组织感染, 98株为HA-MRSA,占比45.8%,多来自重症医学科和肺病科的呼吸系统感染和血流感染。CA-MRSA的检出率高HA-MRSA将近10个百分点,且二者标本来源不同,说明二者引起的感染类型不同。就耐药特点及用药选择而言,2种MRSA对红霉素和克林霉素的耐药率达80%以上,CA-MRSA甚至达到了100%,但对万古霉素、利奈唑胺、奎奴普汀/达福普汀、替加环素和呋喃妥因100%敏感。因此,在治疗由MRSA导致的全身严重性感染时,首选糖肽类药物。二者耐药特点的最大区别在庆大霉素和喹诺酮类药物上,CA-MRSA的耐药率远低于HA-MRSA,这与国内外的相关报道一致[4-6]。本研究和全国细菌耐药监测网(Chinese Antibiotic Resistance Surveillance System,CARSS)的耐药数据一致,在耐药性较弱的CA-MRSA的用药选择上,可以选用万古霉素以外的药物来治疗,如氨基糖苷类或喹诺酮类药物,以减少药物的毒副作用。而美国感染病学会(Infectious Diseases Society of America,IDSA)目前推荐克林霉素、甲氧苄啶/磺胺甲噁唑、强力霉素或利奈唑胺类药物经验性治疗疑似CA-MRSA皮肤和软组织感染[7],可减轻万古霉素的选择压力,延缓万古霉素非敏感菌株的出现。鉴于二者耐药特点的差异,在用药选择上也应有所区别。对CA-MRSA引起的感染,可选用氨基糖苷类或喹诺酮类作为糖肽类的替代用药,而对HA-MRSA引起的感染,糖肽类依然是首选。
MRSA可以大量分泌破坏宿主细胞的毒力因子,介导致病性和钝性免疫防御。其中PVL被认为是MRSA发展成侵袭性感染的重要因素,是抗菌治疗的潜在靶点[8]。PVL是一种可引起白细胞破坏和组织坏死的细胞毒素,属于synergohymenotropic毒素家族,由lukS-PV和lukF-PV这两个基因编码共同转录。PVL以八聚体形式在宿主巨噬细胞、单核细胞和多形核细胞的细胞膜上形成孔道,损伤细胞膜,导致细胞溶解死亡和炎症[9]。因此,PVL基因阳性金黄色葡萄球菌致病能力更强,可引起严重的组织坏死,易出现暴发性起病,病死率高。本研究针对2种MRSA的PVL基因检测结果显示,近80%的CA-MRSA都携带有PVL基因,而HA-MRSAPVL基因携带率不足30%,CA-MRSA菌株PVL基因的携带率高于HA-MRSA,这与目前国内外相关报道一致[10-11]。CA-MRSAPVL基因的高携带率使PVL基因曾一度被认为是CA-MRSA的标志性毒力基因,PVL基因在CA-MRSA所导致的皮肤和软组织感染中起重要作用,与严重的社区获得性坏死性肺炎密切相关[12]。近年来一些国家的研究报告也显示,PVL基因阳性的CA-MRSA导致的感染呈上升趋势,与当地MRSA的社区流行和医院感染有关。而且,PVL基因阳性的CA-MRSA感染并引起并发症如坏死性筋膜炎、肺炎、脓毒症甚至死亡的发生率更高[13]。因此比较2种MRSA的PVL基因携带情况,尤其关注CA-MRSA的携带情况,对于预测是否易发展成侵袭性感染具有重要意义。对于PVL基因阳性的CA-MRSA,临床应高度重视,不可因其耐药性弱而掉以轻心,应进行早期干预,避免局部感染的扩散,减少并发症的发生。
综上所述,通过对CA-MRSA与HA-MRSA的感染部位、耐药情况及PVL基因的携带情况进行实验研究和回顾性分析,可更好地让临床医生掌握河南省中医院或本区域内的流行情况,更加重视PVL基因阳性的CA-MRSA,客观评估其感染程度。PVL基因阳性的CA-MRSA更容易发展成严重的侵袭性感染,可能成为抗CA-MRSA治疗的潜在靶点,为抗MRSA药物的研发提供新的思路。另外在临床工作或是社区医疗工作中,加强宣教,对于皮肤软组织感染要引起足够的重视,及时处理,避免发展成侵袭性感染。
