12 073例奥沙利铂用药患者相关变态反应的发生特征及风险因素分析*
2021-11-30刘思源郭代红孔祥豪于承暄朱雨
刘思源,郭代红,孔祥豪,2,于承暄,朱雨
(1.中国人民解放军总医院医疗保障中心药剂科,北京 100853;2.重庆医科大学药学院,重庆 400016)
变态反应是化疗药物常见的药品不良反应(adverse drug reaction,ADR),一般表现为轻微的皮肤症状,常常被忽视,但某些药物引起的变态反应,如铂类、紫杉烷类,不仅发生率较高,且严重变态反应(drug-induced anaphylaxis)占比较高,甚至危及患者生命[1-3]。奥沙利铂属于第3代铂类化合物,通过抑制DNA和蛋白质合成,从而抑制肿瘤生长[4-5],目前已成为治疗结直肠癌和其他胃肠道肿瘤的主要药物之一,此外,在胃癌和胰腺癌中的疗效也得到证实[6-7]。随着其临床应用日益广泛[8],相关变态反应发生率随之增高[9]。据文献报道,奥沙利铂相关变态反应发生率为8.9%~24.3%,严重变态反应发生率为1%~3%[1,10-12],且具有潜在致命性[13-14]。变态反应已成为奥沙利铂停药的主要原因之一,间接影响患者预后[15]。但目前关于风险因素和预防用药的研究结果并不一致[8,16-20]。本研究依托“临床药物不良事件主动监测与智能评估警示系统-Ⅱ”(active surveillance and assessment system of adverse drug events,ADE-ASAS-Ⅱ)[21],筛选中国人民解放军总医院住院人群中发生奥沙利铂相关变态反应的病例,深入分析发生特征,探究风险因素,为临床用药提供参考。
1 资料与方法
1.1数据来源 依托ADE-ASAS-Ⅱ与医院信息系统(hospital information system,HIS)对接,回顾性监测总医院2012年 1月1日—2019年12月31日期间所有使用奥沙利铂的住院患者,经系统智能报警、双人逐一甄别,确定阳性病例,对于有争议的病例,提请专家做最终评判。根据阳性病例中患者的肿瘤类型(如结肠癌、直肠癌等),于阴性用药患者(用奥沙利铂后未发生变态反应)中逐一提取对应肿瘤类型人群,再根据各类型的阳性病例数量,于对应人群中以1:4的比例进行随机抽样,抽样时借助Excel中“RAND”函数,最后汇总所有抽样人群,获得对照组。
采用卡氏功能状态评分标准[22](karnofsky performance status scale,KPS)评估患者健康状态。正常,无症状和体征为100分;能进行正常活动,有轻微症状和体征为90分;勉强进行正常活动,有一些症状或体征为80分;生活能自理,但不能维持正常生活和工作为70分;生活能大部分自理,但偶尔需要别人帮助为60分;常需要人照料为50分;生活不能自理,需要特别照顾和帮助为40分;生活严重不能自理为30分;病重,需要住院和积极的支持治疗为20分;重危,临近死亡为10分;死亡为0分。
1.2判定标准 参照我国《药品不良反应报告和监测管理办法》,判定评价结果为“肯定”“很可能”“可能”的为阳性病例。人工评价时对用药后仅表现为恶心、呕吐、腹泻的病例予以剔除,因其由变态反应导致的可能性较小。
结合患者病史和用药情况,用药后发生以下任一临床症状即判定为发生变态反应[23]:①皮肤症状(潮红、血管性水肿等);②呼吸症状(呼吸困难、胸闷等);③喉部症状(发紧、水肿等);④心血管症状(心动过速、低血压等);⑤胃肠道症状(恶心、呕吐等);⑥神经肌肉症状(头痛、意识丧失等);⑦全身症状(发热、寒战)。其中一般变态反应大多为局部反应或仅累及一个系统,症状较轻微,如皮疹、瘙痒等皮肤症状。但有的变态反应可累及多个系统,发展迅速,症状较为严重,根据《严重变态反应急救指南》推荐意见[24],判定严重变态反应病例并进行严重程度分级:接触可疑致敏药物后,①皮肤系统症状和胃肠系统症状同时出现,判定为Ⅰ级。②出现明显呼吸系统症状或血压下降判定为Ⅱ级。③出现以下任一症状:神志不清、嗜睡、意识丧失、严重的支气管痉挛和(或)喉头水肿、发绀、重度血压下降(收缩压<80 mmHg或比基础值下降>40%)、大小便失禁等,判定为Ⅲ级。④发生心跳和(或)呼吸骤停,判定为Ⅳ级。
2 结果
2.1人群基本信息 经系统筛选和人工甄别,12 073例(41 495例次)奥沙利铂用药患者中,各项信息齐全的变态反应阳性病例为94例(105例次);关联性评价为“肯定”11例(11.70%),“很可能”64例(68.09%),“可能”19例(20.21%);其中严重过敏53例(56.38%),其中Ⅰ级3例,Ⅱ级43例,Ⅲ级7例。比较阳性组与对照组、严重组与一般组各项信息,结果显示,严重组的女性比例(56.60%)高于一般组(29.27%),P=0.008;阳性组的年龄(59.55岁)比对照组(61.96岁)小(P=0.046);其他基本信息,如过敏史、合并高血压等,各组间无显著差异。阳性组和对照组共有470例,52.13%发生肿瘤转移,各组中均以肝转移频次最高。阳性组中发生肿瘤转移病例的占比(68.09%)显著高于对照组(48.14%),P=0.001;其他转移情况在各组间差异无统计学意义,见表1。
2.2阳性患者用药情况 阳性组中,发生变态反应疗程的中位剂量为200 mg,中位累积剂量为900 mg;有奥沙利铂化疗间断的病例占比为36.17%、间断时间中位数为12.5个月、联用单克隆抗体类药物的病例占比为27.66%,均显著高于对照组(P<0.05);预防给药病例占比为40.43%,主要药物为地塞米松,最高剂量10 mg。化疗方案以XELOX方案(38例,40.43%)和FOLFOX方案(15例,15.96%)为主。严重组和一般组间的各项信息均差异无统计学意义,见表2。
2.3变态反应临床表现 一般组中,主要累及皮肤系统,共涉及临床表现81频次。严重组中,累及系统以呼吸系统为主,皮肤系统次之,共涉及临床表现186频次,主要有喘憋(24例,12.90%)、胸闷(21例,11.29%)、潮红(12例,6.45%),见表3。
2.4变态反应发生情况 发生变态反应的中位周期为第6周期,最长周期为第16周期,第8周期例数(17例)最多,第1周期(15例)和第2周期(12例)次之,其中第2周期和第8周期中的严重反应占比最多,分别达到83.33%和70.59%,见图1。有化疗间断的34例阳性患者中,16例(47.06%)发生于间断后第2周期,见图2。
用药过程中发生的变态反应占比74.47%,其中严重反应占比67.14%,显著高于用药后24 h内的严重反应占比(25.00%)(P<0.001)。发生过敏后,采取抗过敏对症治疗的有85例(90.43%);严重组全部予以对症治疗,涉及用药104频次,主要有地塞米松(46例,44.23%)、苯海拉明(30例,28.85%)、异丙嗪(16例,15.38%),肾上腺素仅有2例;一般组中,32例(78.05%)予以对症治疗,涉及用药56频次,主要有地塞米松(24例,42.86%)、苯海拉明(18例,32.14%)、氯雷他定(9例,16.07%)。所有患者经对症治疗、停药或降低滴注速度等措施后均好转。见表4。

表1 人群基本信息
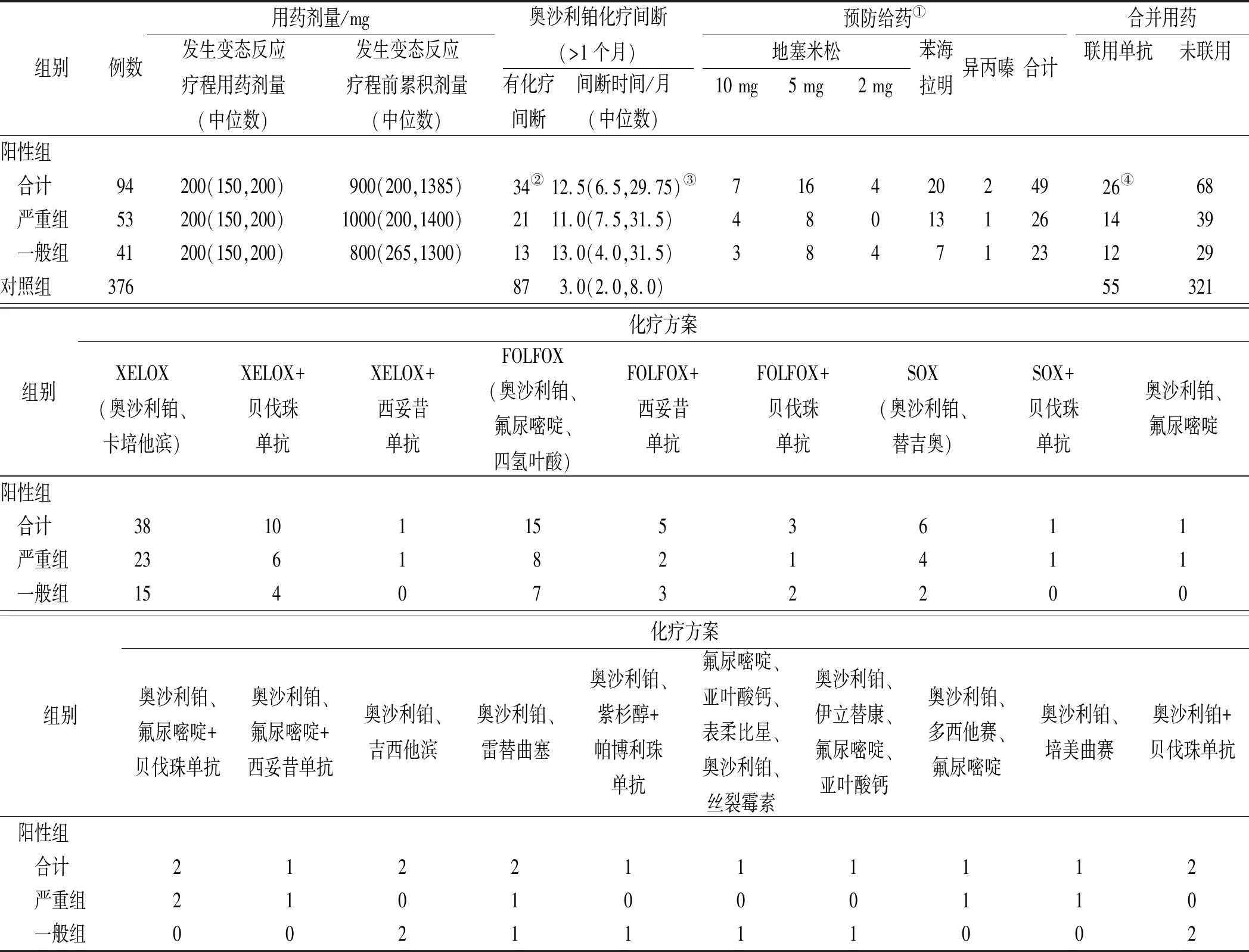
表2 组间用药情况比较
2.5再激发情况 发生变态反应后,50%患者因过敏而停药(其中22例给予了预防用药),18.09%因其他原因(如疗程结束、其他ADR等)停药;42.55%(40例)再次使用奥沙利铂的患者当中,有11例(27.50%)再次出现过敏且其中预防给药占比较高(63.64%),而其他29例中未预防给药的占比更高(65.52%)。40例再激发病例中,预防组和未预防组的发生率差异无统计学意义(P=0.153)。见表5。
2.6风险因素分析 阳性组和对照组的单因素比较发现,年轻、有肿瘤转移、有化疗间断和联用单抗为风险因素(P<0.05),将其纳入多因素逻辑回归,结果显示,有肿瘤转移为独立风险因素(OR)1.864,95%CI(1.100,3.159),见图3。
3 讨论
3.1发生周期分布及用药方案 经组间比较,并未发现单次剂量、累积剂量的显著差异,与相关文献结果基本一致[8,17,25-28]。发生中位周期为第6周期,周期范围1~16,也与文献报道结果基本一致[1,8,11,16-18,25-31]。大多研究中只有多次用药后的一个发生高峰期,但本研究中,发现两个高峰期(初始治疗和多次用药后),有相关研究得到类似结果[1,13,32],这可能与奥沙利铂相关变态反应存在多种机制有关,也可能与铂类间交叉过敏有关,有待进一步研究。此外,有化疗间断的阳性患者中,47.06%发生于间断后再次用药的第2周期。MORI等[12]的研究结果也显示,发生于间断后再次用药的第2或第3周期的占比高达84%。因此,临床应重点关注高发时期,用药前做好充分预防,密切关注患者症状,及时采取措施。

表3 阳性病例累及系统及临床表现

图1 变态反应发生周期
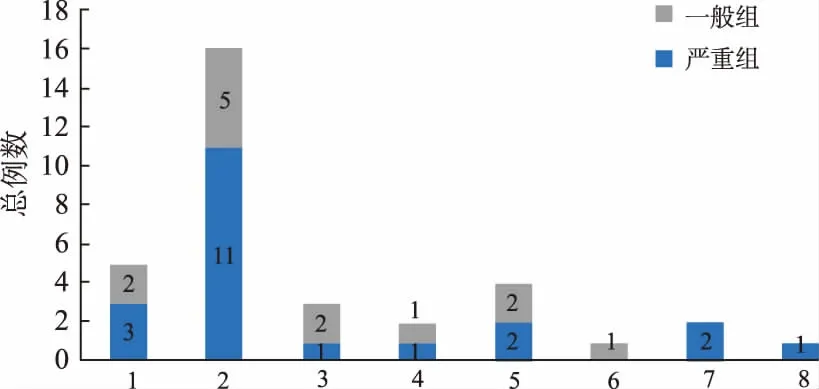
图2 有化疗间断患者的发生周期
本研究获得的阳性病例中,变态反应多发生在用药过程中,并经停药和对症治疗后均好转,提示患者基础疾病和联用抗肿瘤药物等的因果关联性相对较小。阳性病例中,XELOX和XELOX+贝伐珠单抗两种方案的严重程度差异无统计意义。FOLFOX和FOLFOX+西妥昔单抗两种方案的严重程度也差异无统计学意义。可见,联用单抗可能对变态反应的严重程度影响较小。但比较阳性组和对照组间联用单抗情况时,单因素结果显示其为风险因素,而多因素结果中风险信号消失。有相关研究报道[16,33-34],奥沙利铂相关变态反应与化疗方案无关,与联用贝伐珠单抗无关。
3.2变态反应临床表现和发生机制 本研究中,74.47%变态反应属于急性发作。一般组中,累及皮肤系统占比最多。而严重组中,累及呼吸系统最多,皮肤系统次之,与文献报道基本一致[25,27];心血管系统累及较少,但症状较为严重且表现多样。根据以上特征,奥沙利铂相关变态反应与IgE介导的I型变态反应特征最为吻合,与文献报道一致[1,35]。还有少部分患者仅表现为寒战、发热,这些反应可能由非免疫机制介导,可能与细胞因子风暴有关[36-37]。

表4 变态反应发生情况

表5 发生过敏后再激发情况

图3 多因素逻辑回归结果
3.3停药与再激发情况 阳性患者中,50%因过敏而停药,与相关文献报道的21%~58%基本一致[1,26]。本研究的停药患者中,有18例仅发生一般变态反应,临床为避免其进一步发展,也采取了停药措施,显示出变态反应在一定程度上影响着奥沙利铂的临床使用。
再激发患者中,27.50%再次出现变态反应。据报道,在充分预防情况下,再激发后变态反应发生率为28.6%~83.0%[11,13,17-18,20,25-26,38]。鉴于再激发后的高发生率,对于阳性患者,应在评估患者确有必要再次用药后,在充分预防的前提下给药并予以密切关注。
3.4预防给药效果分析 本次研究结果显示,预防给药效果并不显著。文献报道预防给药效果以及预防方案仍存在争议。KIDERA等[34]就大剂量地塞米松对于奥沙利铂相关变态反应的预防效果进行了研究,对比常规预防方案(地塞米松8 mg)与加强预防方案(地塞米松20 mg),结果显示加强方案不仅降低了发生率(7%和20%),还延长了中位周期(12和9),同时并未出现大剂量激素相关的ADR。其他研究结果也显示预防给药效果良好[20],但尚无标准的预防给药方案[28]。然而在有些研究中并未发现预防给药的显著效果[16,18]。KIM等[29]研究显示,预防用地塞米松少于20 mg反而为风险因素。本研究中,地塞米松最大剂量仅为10 mg,效果不显著可能与剂量较小有关,仍需进一步探究。
3.5风险因素分析 比较严重组和一般组,发现女性的严重程度更高,与CHAY等[39]的结果一致。还有研究显示女性为奥沙利铂相关变态反应的风险因素[16-17,38],这可能与女性对铂类制剂的敏感性较高有关[17]。
比较阳性组与对照组,发现年轻、肿瘤转移、化疗间断、联用单抗为风险因素,其中肿瘤转移为独立风险因素[OR1.864,95%CI(1.100,3.159)]。阳性组人群较为年轻,与文献结果一致[38]。化疗间断为风险因素,与文献报道一致[12,38]。MORI等[12]研究,在超过6个奥沙利铂用药周期的患者中,有无化疗间断的变态反应发生率分别为41.0% 和20.6%,化疗间断为独立风险因素。临床应重点关注高风险人群,提前做好预防措施,减轻变态反应危害。
4 结束语
本研究针对奥沙利铂相关变态反应开展了大样本真实世界研究,综合分析了ADR发生特征,结果显示阳性患者的中断治疗比例高、有两个高发时期、女性和肿瘤转移为高风险人群,对于临床早期识别重点人群、预防给药以减少ADR发生具有可靠的参考价值。
