雌二醇共晶的研究*
2021-11-30郭爱鑫巩孝芳何佳璘郭一鸣宁丽峰陈晓锋徐娟郭颖志王慧萍
郭爱鑫,巩孝芳,何佳璘,郭一鸣,宁丽峰,陈晓锋,徐娟,郭颖志,王慧萍,
(1.北京协和医学院研究生院,北京 100730;2.国家卫生健康委科学技术研究所,北京 100081)
据统计,每年通过临床试验申请上市的药物中,约57%的药物因溶解度和生物利用度低在上市不久即被淘汰。溶解性和生物利用度问题成为严重制约药物研发和应用的瓶颈[1]。药物共晶因为可以有效改善药物理化性质、提高药物的治疗效果而成为新的研究热点。
雌二醇(estradiol,E2)分子式为C18H24O2,化学名:雌甾-1,3,5(10)-三烯-3,17-二醇,是最主要也是活性最强的雌性激素。在临床上主要用于避孕、激素代替疗法以及更年期和绝经后症状[2-9]。雌二醇在生物药剂学分类系统属于Ⅱ类[10],在水中的溶解度为0.2~5 g·mL-1[11],并且溶出较慢,相应的生物利用度很低(在人体的生物利用度大概是为10%)。所以,采用切实可行的方法提高其溶解性,是提高雌二醇生物利用度常用策略。
本研究利用多种方法筛选雌二醇共晶,并进行评估,以获得优势共晶,改善雌二醇的生物利用度,增进药物临床疗效。
1 材料与方法
1.1实验主要试剂 药物活性成分(API):雌二醇(华润紫竹,批号:20160712,含量:99.90%)。溶剂:异丙醇(麦克林,批号:c10475860,含量:99.5%);乙腈(麦克林,批号:c10392267,含量:99.0%);正丁醇(国药集团化学试剂有限公司,批号:20150914,含量:99.5%);正丙醇(西陇化工股份有限公司,批号:1301021,含量:99.0%);乙酸乙酯(北京化工厂,批号:20160309,含量:99.5%);正己烷(北京化工厂,批号:20170612,含量:95%);三氯甲烷(北京化工厂,批号:20150202,含量:99.0%);环己烷(麦克林,批号:10511344,含量:99.5%);二甲苯(国药集团化学试剂有限公司,批号:20150930,含量:99.0%);二甲亚砜(天津福晨化学试剂厂,批号:20150907,含量:99.1%);四氢呋喃(北京化工厂,批号:20190215,含量:99.8%);二氧六环(国药集团化学试剂有限公司,批号:20160902,含量:99.5%);无水乙醇(北京化工厂,批号:20160612,含量:99.7%);甲醇(天津科密欧化学试剂有限公司,批号:p1460625,含量:99.9%);石油醚(北京化工厂,批号:20170316,含量:99.7%);丙酮(北京化工厂,批号:20151102,含量:99.5%);95%乙醇(北京东方事博精细化工有限公司,批号:20170116,含量:95.0%);二氯甲烷(北京化工厂,批号:20150407,含量:99.5%);吡啶(北京化工厂,批号:20091203,含量:99.5%);苯(北京化工厂,批号:20140909,含量:99.5%)。
共晶形成物 (cocrystal formation,CCF):尿素(国药集团化学试剂有限公司,批号:20171108,含量:99.0%);乙酰胺(天津大茂化学试剂厂,批号:20170801,含量:98.5%)。
1.2主要实验仪器 Smart Apex Ⅱ型X-射线单晶衍射仪(美国Bruker公司);D/max-2250型粉末X射线衍射分析仪(日本Rigaku公司);TGA/DSC-1型热重分析仪(瑞士Mettler Toledo公司);DSC-1 500型差示扫描量热分析仪(瑞士Mettler Toledo公司);红外光谱仪(美国Perkin Elmer 公司);Agilent1260型高效液相色谱仪(美国安捷伦公司);RC806D型溶出仪(天津大学);Delta320型pH计(瑞典梅特勒公司);MS-H-Pro LCD型综合药品稳定性试验箱(上海菁海仪器有限公司);MS-H-Pro LCD型紫外-可见分光光度计(上海元析);FA2104N型电子天平(上海菁海仪器有限公司,感量:0.1 mg)。
1.3实验方法
1.3.1溶解性试验 称取样品定容于(25±2) ℃溶剂,间隔5 min剧烈振摇30 s;观察30 min内样品的溶解情况。
1.3.2制备方法 ①研磨法:按摩尔比1:1的比例将API和CCF加入球磨罐(研钵)中,加入一定量溶剂,研磨一定时间。②混悬法:按摩尔比1:1的比例将API和CCF投料,加入溶剂和搅拌子,搅拌一定时间,取少量样品置于滤纸上干燥,PXRD检测晶相。③蒸发结晶法:按摩尔比1:1的比例把API和CCF(配体)溶解在溶剂中,通过溶剂的缓慢蒸发而获得共晶。④降温析晶法:按摩尔比1:1的比例把API和CCF溶解在溶剂中,加热到一定温度后,缓慢降温得到共晶。
1.3.4共晶单晶培养及测试 ①混悬后的溶液离心或滤过后,滤液置于小烧杯中,封口膜封好,针扎数小孔,任其挥发。②取过量的API和CCF,加入EP管中,加入能混悬出共晶的溶剂(一般3~4 mL),超声振荡10~20 min,使API和CCF充分溶解,过滤,挥发。
1.3.5小量制备样品 确定合适溶剂,按摩尔比1:1的比例投料,反应一定时间后样品测PXRD,若共晶中没有原料药和CCF的峰,过滤(水泵抽滤),用原溶剂洗涤除去母液(小心洗涤,2或3次),干燥。干燥后的样品测PXRD,如没有杂峰,进行纯度表征(磁共振谱和元素分析)。
1.3.6晶型样品表征 ①粉末X射线衍射法(PXRD):精密称取原料药和晶型样品各50 mg,进行实验。②单晶X射线衍射(SCXRD):石墨单色器,Mo-K 射线(γ=0.710 73 Å);温度:295(2)K;电压:20 kV;电流:5 mA[12]。③差示扫描量热法(DSC):称取晶型样品适量,采用程序升温法对样品进行DSC表征,温度范围为:30~200 ℃。④热重分析法(TG):采用热重分析法,对共晶样品晶型进行进一步表征研究,确定是否含有溶剂,升温速率为10 K·min-1。⑤熔点法(MP):用熔点法对晶型样品进行表征,每个晶型平行测定3次,取平均值。雌二醇的熔点是:175~180 ℃。⑥磁共振(Nuclear magnetic resonance,NMR):本实验采用磁共振氢谱,以DMSO为溶剂。
1.3.7稳定性研究 ①高温实验:将晶型样品置于60 ℃温度条件下10 d,并于放置的第0天、第5天和第10天分别取样。②高湿实验:将晶型样品置于25 ℃相对湿度(90±5)%条件下放置10 d,并于放置的第0天、第5天和第10天分别取样。③光照实验:将晶型样品置于光照箱10 d,光照强度设置为(4500±500)lx,于放置的第0天、第5天和第10天分别取样。
1.3.8溶解度实验 溶解曲线测定采用桨法,溶出介质:水、pH值1.2的盐酸-氯化钠缓冲液、pH值4.5醋酸盐缓冲液、pH值6.8的磷酸盐缓冲液、0.2%SDS溶液、0.5%SDS溶液;体积:600 mL;温度:37 ℃;转速:100 r·min-1。参照溶解度的测定方法进行测定。称取共晶样品120 mg,置于100 mL三角锥形瓶中,定量移取100 mL溶液加入,摇匀后加入溶出仪的溶杯中再加至600 mL,分别在计时开始后的5,15,30,60,120,240,300和360 min用注射器抽取样品,滤过,将滤液照紫外-可见分光光度法,波长为280 mm处测定其吸光度。利用吸光度数据对样品溶解的质量百分比进行计算,以时间为横坐标,溶解的样品的相对量为纵坐标分别绘制溶解度曲线[13]。
2 结果
2.1原料药表征结果 雌二醇原料药的PXRD、IR、TGA-DSC、NMR图谱分别如图1所示。雌二醇原料药的DSC数据见表1,雌二醇原料药熔点:初熔169.2 ℃,终熔179.2 ℃,熔距10 ℃,放置时间久,原料药中可能含有水分导致熔距增大。
2.2溶解性实验结果 结果表明,雌二醇是一种不易溶于水且也不易溶于有机试剂的化学物质,在24种溶剂中的溶解性质主要分为3类:①溶解溶剂(13种):丙酮、乙酸乙酯、二氧六环、乙腈、四氢呋喃、吡啶、三氯甲烷、二氯甲烷、DMF、DMSO、苯、甲苯、二甲苯;②微溶溶剂(7种):甲醇、乙醇、95%乙醇、正丙醇、异丙醇、正丁醇、乙醚;③不溶溶剂(4种):水、正己烷、环己烷、石油醚。
2.3共晶单晶样品制备 实验共得到雌二醇共晶样品2种:共晶Ⅰ(雌二醇-尿素共晶);共晶Ⅱ(雌二醇-乙酰胺),其中共晶Ⅱ为首次发现。制备方法:共晶Ⅰ:雌二醇和尿素按照摩尔比1:1混合置于5 mL棕色玻璃瓶中后加入丙酮2~3 mL,磁力搅拌器转速800 r·min-1,搅拌10 h,抽滤后滤液室温下自然挥发溶剂培养单晶。共晶Ⅱ:雌二醇和乙酰胺摩尔比1:1混合后加入乙酸乙酯2~3 mL,磁力搅拌转速800 r·min-1,搅拌10 h,抽滤后滤液室温下自然挥发溶剂培养单晶。
2.4晶型表征
2.4.1PXRD结果 共晶在API雌二醇于2θ=11.67°,13.26°,18.28°,26.68°处的强衍射峰消失,在CCF尿素2θ=24.94°,29.61°,31.98°,35.86°,40.78°的特征峰消失,但是共晶在2θ=16.37°,21.42°,22.29°等处出现了新的衍射峰,这些衍射峰不属于API和CCF,所以判定出现了不同于两者的新的物质。见图2。制得的共晶在API雌二醇于2θ=11.66°,13.26°,14.59°处的衍射峰消失,在CCF乙酰胺2θ=25.01°,26.948°,31.09°处的特征峰消失,但是共晶在2θ=14.31°,16.04°,20.16°,21.13°等处出现了新的衍射峰,判定出现不同于两者的新的物质。见图3。
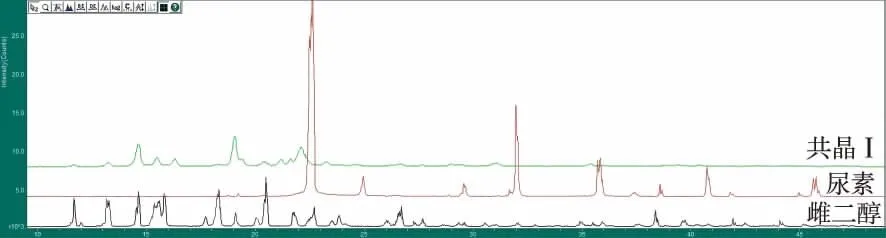
图2 共晶ⅠPXRD对比图
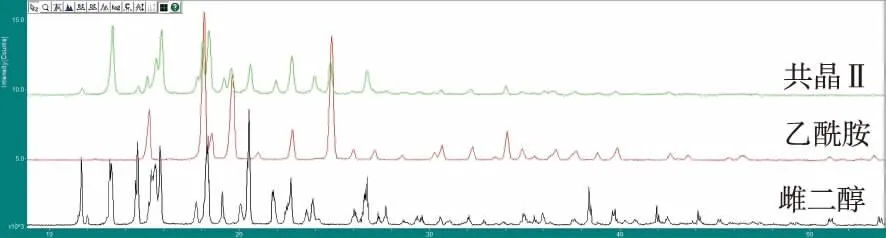
图3 共晶ⅡPXRD对比图
2.4.2NMR分析结果 共晶Ⅰ在化学位移5.4 ppm的位置出现了峰面积为4的新峰,而原本雌二醇中化学位移为2.1 ppm处的氢原子峰面积为2,2.2 ppm处峰面积为1的峰,现在是成了化学位移2.2 ppm处峰面积3的峰。见图4。
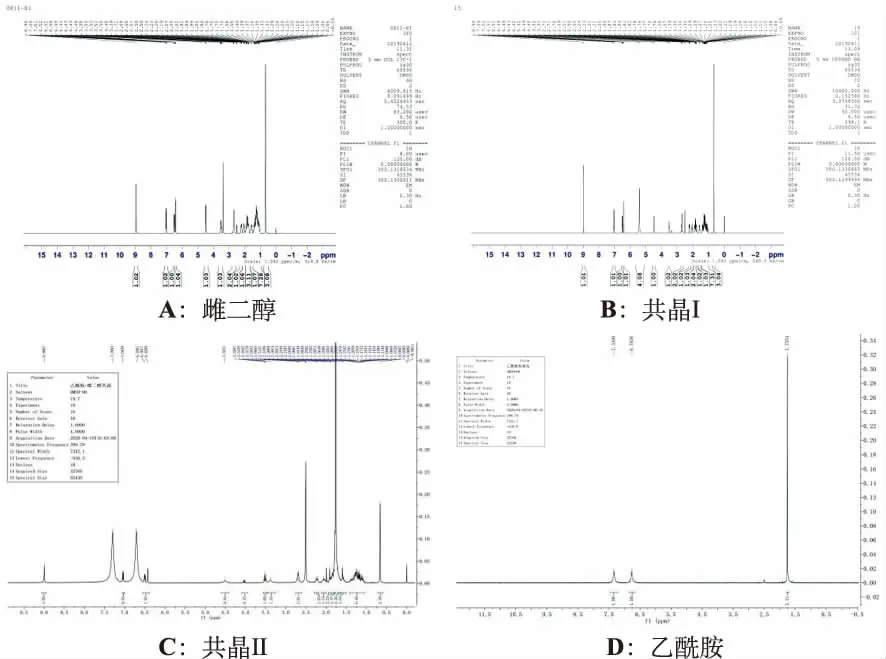
图4 E2及两种共晶的NMR图谱
上述图谱中各物质的化学位移及累计氢原子的数量与原料药雌二醇有所不同,所制备的物质的氢原子个数是各组分的氢原子之和,由此,初步判断在摩尔比1:1的情况下,所制备的物质是雌二醇的共晶或者溶剂合物。
2.4.3SCXRD单晶图谱 单晶X射线衍射结果显示两种共晶分子比例分别为1:1,4:4,即对共晶Ⅰ来说,一个晶胞内包含1分子雌二醇和1分子尿素,而在一个共晶Ⅱ的晶胞内包含4分子雌二醇和4分子乙酰胺。见图5。

图5 共晶Ⅰ(A)和共晶Ⅱ(B)的单晶图
2.4.4雌二醇共晶的单晶分析 见图6、图7。图6A、图7A中可以看出雌二醇和尿素及乙酰胺配体的氢键结合方式及位置,共晶Ⅰ以O1--H1…O3、N1--H1B…O1等氢键相互作用,共晶Ⅱ以O1--H1…O4、N1--H1B…O1等氢键相互作用,蓝色虚线表示分子间的氢键相互作用力,具体氢键数据见表2,3。两种共晶在晶胞中的排列方式如图6B、7B所示,两种共晶的晶体学数据见表4,共晶单晶结构中的各原子的二维平面序列见图6C、7C。两种雌二醇的共晶单晶,其中共晶Ⅰ属于正交晶系,空间群P212121,晶型共晶Ⅱ属于单斜晶系,空间群为P21。
2.4.5DSC-TAG结果 尿素熔点132 ℃,TG图谱在分解(247 ℃)之前有一次明显的失重(160 ℃),失重至40%。如图8所示,共晶Ⅰ在227 ℃时出现尖锐且强的单独吸热峰,具体温度见表5,与图9中API雌二醇的熔点(178~179 ℃)和CCF尿素熔点(132 ℃)不同,且高于两者。在160 ℃时出现尖锐且强烈的单独吸热峰,与API雌二醇原料药的熔点(178~179 ℃)和CCF乙酰胺熔点(81 ℃)不同,介于两者之间。见图8,9。
2.4.6熔点法表征 采用熔点仪对两种共晶样品进行熔点测定,升温速率:1.0 ℃·min-1,2种晶型的熔点数据见表6。
2.5晶型评价
2.5.1稳定性评价 两种共晶物质在高温、高湿、一定光照条件下的稳定性,结果见表7。稳定性PXRD对比图10中,从上到下依次是:初始雌二醇原料药;高温、高湿、光照10 d后的雌二醇原料药;初始共晶Ⅱ;高温、高湿、光照10 d后的共晶Ⅱ;初始共晶Ⅰ;高温、高湿、光照10 d后的共晶Ⅰ。PXRD图谱中两种共晶和原料药的峰位置、峰形状都没有发生明显的变化。稳定性评价结果表明:与雌二醇原料药类似,共晶Ⅰ和共晶Ⅱ都是较稳定的晶型。

图6 共晶Ⅰ的氢键结合图(A)、晶胞堆积图(B)和单晶结构图(C)
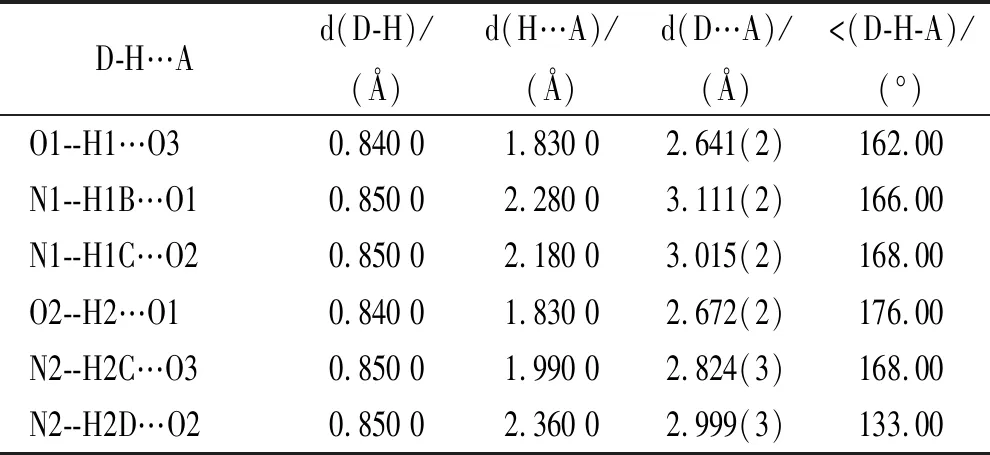
表2 共晶Ⅰ的氢键数据表 P21 21 21 R=0.04
2.5.2溶出度评价 溶出度实验结果见图11。
①用pH值1.2介质为溶出介质时,两种共晶的累计溶出度都明显提高,共晶Ⅱ溶约60%,共晶Ⅰ约溶出47%,而雌二醇原料药晶型溶出为33%,溶出介质区分度好,溶出速率两种共晶也高于原料药晶型。
②用pH值4.5介质为溶出介质时,共晶Ⅱ溶约46%,共晶Ⅰ约溶出37%,而雌二醇原料药晶型溶出37%。
③用pH值6.8介质为溶出介质时,共晶Ⅱ溶约27%,共晶Ⅰ约溶出23%,而雌二醇原料药晶型溶出17%,溶出介质不能很好的区别开三者。
④用水为溶出介质时,300 min晶型I、晶型Ⅱ几乎没有溶出。
⑤用0.2%SDS溶液为溶出介质时,原料药晶型累计溶出20%,共晶Ⅰ溶出25%,共晶Ⅱ溶出29%,且两种共晶速率高于原料药晶型,介质区别度不大。
⑥用0.5%SDS溶液为溶出介质时,原料药晶型累计溶出25%,共晶Ⅰ溶出32%,共晶Ⅱ溶出39%,且两种共晶速率高于原料药晶型。
由实验结果可知,在水中3种物质的溶解度小。两种共晶在6种介质中的溶出行为基本一致,都可达到溶出平衡,没有达到完全溶出。在pH值=1.2盐酸缓冲溶液中,共晶Ⅱ的累计溶出度比雌二醇原料药大近2倍,比共晶Ⅰ大1.2倍,且共晶Ⅱ的溶出速率高于共晶Ⅰ。

图7 共晶Ⅱ的氢键结合图(A)、晶胞堆积图(B)和单晶结构图(C)
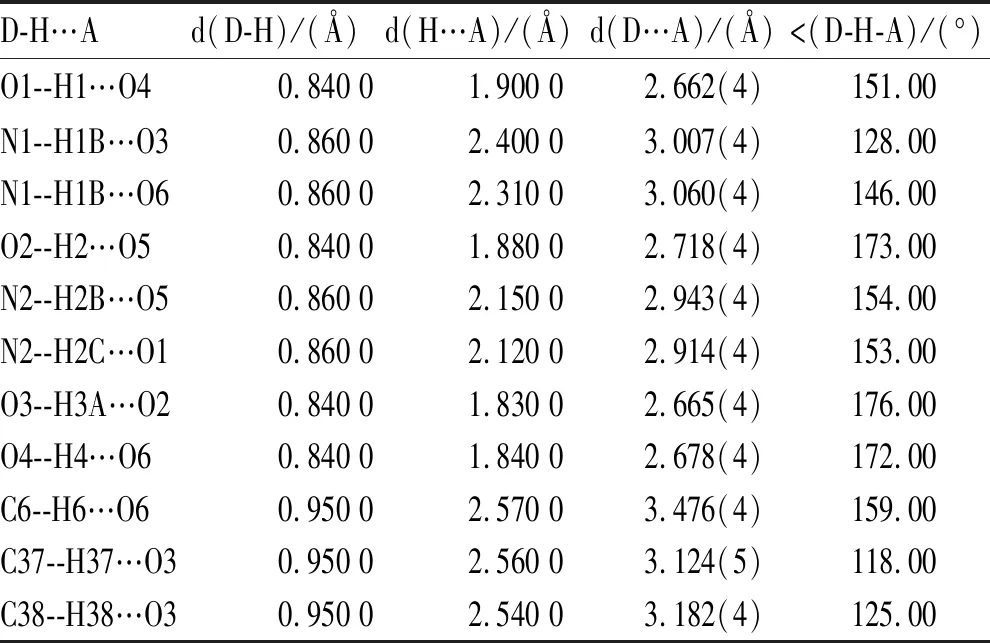
表3 共晶Ⅱ的氢键数据表 P21 21 21 R=0.07

表4 两种共晶结构参数表

图8 共晶Ⅰ(A)和共晶Ⅱ(B)TGA-DSC图

表5 两种共晶的放热峰对比表

图9 尿素(A)和乙酰胺(B)标准品TGA-DSC图

表6 两种共晶熔点数据表
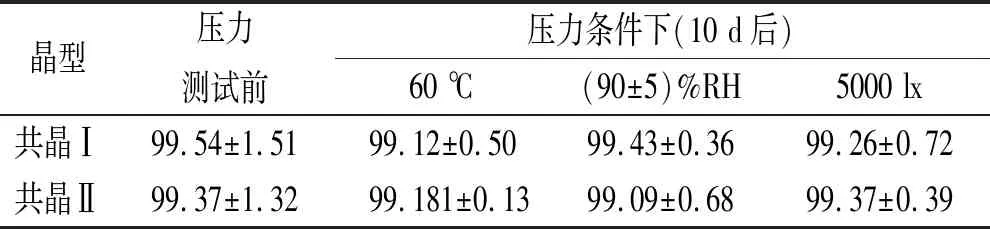
表7 两种共晶的稳定性考查数据表
3 讨论
结晶是一个复杂的过程,影响结晶的因素包括结晶的工艺和条件以及赋形剂和其他添加剂的影响。近年来,创新药物研发领域对药物晶型研究越来越重视。

图10 共晶Ⅰ、共晶Ⅱ与原料药的稳定性PXRD对比图

A.0.1 mol·L-1盐酸溶液(pH=1.2);B.醋酸溶液(pH=4.5);C.磷酸盐缓冲液(pH=6.8);D.水(pH=7.0);E.0.2%SDS溶液(pH=7.0);F.0.5%SDS溶液(pH=7.3)。
FDA近年审批上市的小分子新药中,涉及晶型的高达66%。“药物晶型研究技术”已成为化学药物研究关键技术之一。2015年版《中华人民共和国药典》则新增“药品晶型研究及晶型质量控制指导原则”作为新药研发及药物质控的参照标准[14]。
所谓共晶,API和CCF按固定化学计量比在氢键或其他非共价键的作用下自组装形成的超分子复合物[15]。共晶具有以下特点:①中性分子即可以作为共晶组成部分。②潜在CCF很多,比如药用辅料、食品添加剂、氨基酸以及其他活性分子[16]。③有效的提高难溶性API的溶解性能,改善药物的理化性质、机械性能及生物利用度等。形成共晶并没有打破药物的共价键,原料药的结构没有发生变化,因此开发已上市药物的共晶的过程(包括临床试验)和成本要远远小于新化学分子实体(NCEs),周期也会大大缩短。所以,目前国内对于药物共晶的研究已经成为继药物多晶型研究之后的又一个研究热点。
雌二醇药理作用为调控女性的月经周期、控制性征、附属性器官的成熟[20],临床使用广泛可用于更年期综合征等补充雌激素不足类疾病、转移性乳腺癌、口服避孕药等。但其存在生物利用度低(约10%)的不足,因此本课题组致力于寻找其新晶型或共晶以提高药物的稳定性和临床疗效,前期研究已经获得一种雌二醇的新溶剂合物[21-22]。文献检索发现,截至目前雌二醇有半水、一水合物,甲醇、乙醇、正丙醇的溶剂合物等形式[23-24],但共晶研究甚少。
药物共晶的本质是根据API和CCF的官能团互补性来设计氢键超分子合成子,了解API的结构、官能团及所含氢键供体和受体的种类、数目和位置等至关重要。因此,我们首先对雌二醇的原料药进行了PXRD、溶解性等检测分析。结果发现,雌二醇不易溶于水也不易溶于有机试剂,含有两个醇羟基,理论上能与含有羧基、羰基、氨基等基团的化合物形成氢键,故可能形成共晶。常用CCF主要有药用辅料、盐性药物中的成盐离子、食品添加剂等5类。
共晶的制备方法与晶型药物的制备相同,因此本文采用了研磨法、混悬法等四种制备方式尽可能多的获得药物共晶相,表征分析后发现共获得雌二醇的2种共晶晶型:共晶Ⅰ雌二醇-尿素共晶和共晶Ⅱ雌二醇-乙酰胺共晶,其中共晶Ⅱ为首次发现。实验中还得到了雌二醇-甲醇-水合物,也是首次发现的含有两种溶剂分子的溶剂合物。表征分析中,SXRD证明了雌二醇存在多晶型现象主要是由于分子构象中分子的排列、结晶溶剂的介入、晶胞参数等的差异,解释了非共价键作用力在形成共晶的重要作用。结合PXRD图谱证明制备的雌二醇晶型物质为高晶型纯品,为其他晶型表征手段提供了参照基础。在NMR图谱中可以看出,新制得各物质的化学位移及累计氢原子的数量与原料药雌二醇有所不同,由此,可以初步判断所制备的物质可能是雌二醇的共晶或者溶剂合物,但还需要进一步的检测来支持。从热分析图谱(DSC/TGA)可进一步得出两者是形成新的共晶的结论。
笔者采用了初步的稳定性和溶出度评价对获得的共晶性质进行进一步探讨。结果发现,共晶Ⅰ以及共晶Ⅱ属稳定型,且共晶Ⅱ的溶出性质更优,证实通过共晶API的溶解性得到一定改善。共晶提高药物溶解度和溶出速率时因先溶解为无定型状态而常会出现弹跳-伞降现象,本文中并未观察到此结果。因此,雌二醇优势共晶的最终确定还需进行生物利用度和药动学等研究加以判断。本文通过对雌二醇共晶进行了系统的初步筛选和检测,证实雌二醇能形成共晶(获得一种新共晶),且不同共晶理化性质存在差异,为雌二醇的研发提供了思路和可供参考的数据,对提高其临床药效和临床应用具有重要的意义。
