肝硬化肾损害的诊治进展
2021-11-30傅青春
傅青春
上海市公共卫生临床中心肝病中心 (上海, 200000)
肾功能不全是肝硬化常见的并发症[1],在Child A级、B级和C级肝硬化中的患病率分别为5.3%、15%和31.7%。约20%的肝硬化住院患者发生急性肾损伤(AKI),其中超过60%可归因于肾前因素,30%是肾脏结构性损伤,仅1%由急性阻塞性肾病引起[2]。肝肾综合征(HRS)是一种“功能性”的肾功能不全,由肝硬化门静脉高压引起的高动力血液循环和内源性血管活性系统过度活跃所致,预后不良。随着人们对AKI和HRS发病机制的认识进步,有关HRS分类、命名、诊断标准和致病理论不断更新,本文重点讨论HRS的诊治进展。
1 肝硬化肾功能不全的定义更新
1.1 急性肾损伤 慢性肝病患者的肾功能不全定义为血清肌酐(sCr)浓度≥1.5 mg/dl(133 μmol/L),AKI定义为sCr自基线快速翻倍至>1.5 mg/dl[3]。2012年改善全球肾脏病预后组织(KDIGO)指南制定了AKI、急性肾病(AKD)和慢性肾病(CKD)的新定义和特征[4]。肝病学界紧随其后,2015年国际腹水俱乐部(ICA)将肝硬化患者的AKI定义为以下任何一种:①sCr在48 h内增加≥0.3 mg/dl(≥26.5 μmol/L);②确定或推测在前7 d内,sCr增加至≥1.5倍基线值[5]。据此,将原来以AKI为特征的HRS-1型的诊断标准全面修订,并更名为HRS-AKI(见表1),去掉了AKI诊断的临界值限制并放宽基线sCr值的获得时限,可避免至少2 d的诊断延迟,有利于早诊早治。多项前瞻性研究已在肝硬化患者中证实了新定义的益处。
最近,对慢加急性肝衰竭(ACLF)的研究证明了由病原体相关分子模式(PAMP)或损伤相关分子模式(DAMPS)诱导的全身炎症在肝硬化HRS发生和急性失代偿(AD)进展中发挥了重要作用[6]。另外,非酒精性脂肪性肝炎后肝硬化患者日渐增多,潜在代谢综合征(糖尿病、高血压)带来的CKD患者也迅速增加[7,8]。将HRS限定于肝硬化腹水和无肾实质损伤患者,不利于临床诊治。因此,2019年ICA的肝病学家Angeli和Garcia-Tsao联合2位肾病学家提出修改意见,认为HRS定义的肝病患者应包括肝硬化、急性肝衰竭(ALF)和ACLF,肝脏和/或肝外(细菌感染和/或细菌易位)因素均可诱发,HRS的诊断背景可以是AKI、亚急性肾脏病和CKD。同时建议将尿量添加到HRS-AKI的标准中(见表1和表2)[9]。
肝硬化AKI的鉴别难点是如何区分HRS-AKI和急性肾小管坏死AKI(ATN-AKI)。sCr仅反映肾脏滤过功能而非损伤的标志物,因此无法区分AKI是功能性或结构性。肾小管损伤的新型生物标志物,比如尿白细胞介素-18(IL-18)、肾损伤分子-1(KIM-1)、肝型脂肪酸结合蛋白(L-FABP)和中性粒细胞明胶酶相关脂质运载蛋白(NGAL)颇有诊断潜力。其中研究最多的是尿NGAL,若以220 μg/g肌酐为临界值,86%的ATN-AKI患者高于该阈值,而大多数HRS-AKI或肾前性AKI患者(分别为88%和93%)低于该阈值,可供诊断参考[10]。
钠排泄分数 (FENa)是尿中排泄的钠滤过百分比,通过计算(尿钠/血清钠)/(尿肌酐/血清肌酐)的比值得出。HRS患者的FENa都显著低于ATN患者,可低至0.2%以下,有助于区分HRS和ATN(见表1)。

表1 2019年HRS-AKI新诊断标准建议方案(Angeli等)[9]
1.2 急性和慢性肾病 KDIGO指南将CKD定义为肾脏结构或功能异常(GFR<60 ml/min/1.72 m2)且持续时间超过3个月,而AKD涵盖了所有持续时间<3个月的肾功能减退,包括AKI或肾脏结构或功能异常(GFR<60 ml/min/1.72 m2)。以前命名的HRS-2型被认为是CKD的一种,以顽固性腹水为临床特征。最近,EASL指南提出将HRS-2更名为HRS-NAKI(即非AKI的HRS)[11]。Angeli等建议将其分成2型,即肝硬化伴CKD,且已排除其他原因为HRS-CKD型,或是AKD中不符合AKI标准且持续时间少于3个月的肾功能不全为HRS-AKD型(见表2)。
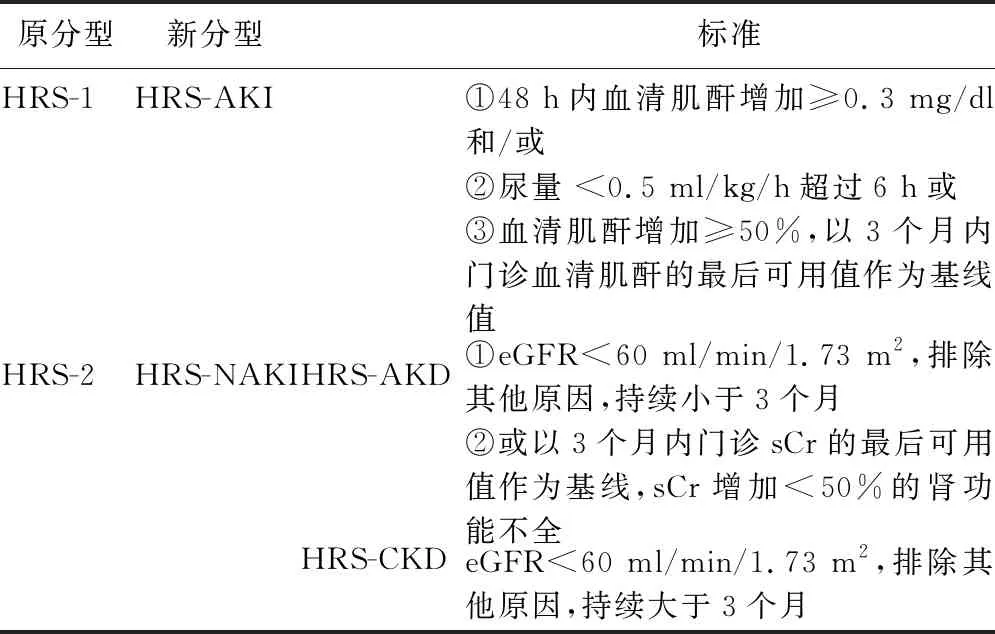
表2 HRS分型的新定义
肝硬化患者的eGFR往往被低估,由此来定义HRS-NAKI可能欠准确,但与之前的HRS-1或HRS-2相比,有助于诊断叠加在HRS-CKD或HRS-AKD上的HRS-AKI。在新定义的框架下,若HRS-CKD叠加HRS-AKI,则没有慢性结构损伤的证据;CKD基础上的HRS-AKI,会有慢性结构损伤的证据,比如在肝硬化合并糖尿病和高血压导致的结构性CKD上发生的HRS-AKI。当然,新的HRS定义和分类需在未来的前瞻性研究中得到验证和完善。
2 HRS的病理生理新证据
根据肝硬化患者失代偿和多器官衰竭进展的新理论,所有HRS还涉及全身炎症激活,广泛的全身炎症与ACLF进展和死亡风险相关[6]。细菌易位是门静脉高压引起HRS特征性循环功能障碍和自发性细菌性腹膜炎等感染发病的主要机制。细菌易位导致PAMP激活单核细胞,进而释放促炎细胞因子,如肿瘤坏死因子α(TNF-α)、白介素6 (IL-6)和白介素1 β(IL-1β)[12]。这些细胞因子与肝硬化、ACLF和ALF患者的肾功能受损有关。因此,HRS-AKI和败血症诱发AKI的发病机制可能存在重叠。另外,一些HRS-AKI患者的胆汁淤积可能通过加重炎症和/或大血管功能障碍,或促进胆盐相关的直接肾小管损伤而进一步损害肾功能[13]。所有这些特征,即使在没有循环功能障碍和肾灌注不足时也可能发生,造成某些患者对血管收缩剂应答不佳。
3 肝肾综合征的病理新发现
HRS的纯粹“功能性”血液动力学紊乱的概念,还受到病理新证据的挑战。一项来自肝硬化伴肾功能不全患者的肾活检研究发现,先前诊断为CKD(sCr >1.5 mg/d)的18名患者,尿蛋白<500 mg/d且无血尿,可能是HRS-CKD,肾组织学显示慢性肾小管间质损伤13例,急性肾小管间质损伤12例,肾小球损伤10例,血管损伤12例[14]。表明没有明显的蛋白尿和血尿并不能排除肾脏器质病变。HRS患者的尿液中多种生物标志物可升高,特别是NGAL,提示HRS可能也与一定程度的肾实质损伤相关。
4 HRS治疗新进展
一旦明确诊断并确定AKI的原因,应立即开始AKI的管理。应停用利尿剂和/或β受体阻滞剂,停用可能与AKI相关的药物,如血管扩张剂、非甾体抗炎药和其他肾毒性药物。根据液体丢失的原因和严重程度补充容量。当诊断HRS-AKI时,应尽快开始使用血管收缩剂治疗,特别是特利加压素加白蛋白,可显著改善HRS-1患者的肾功能[15,16]。在随机试验的三项荟萃分析中,特利加压素的使用与所有患者短期生存率的显著改善有关。特利加压素可静脉推注给药(从0.5~1 mg,Q 4~6 h开始至最大剂量2 mg,Q4h)和连续静脉输注(从2 mg/d开始至最大剂量12 mg/d)。后一种给药方式可显著减少持续性腹泻、腹部缺血、外周缺血、心绞痛和循环超负荷等副作用。如果sCr在治疗3 d后没有降低至少25%,则应逐步增加特利加压素的剂量。治疗应持续至sCr达到与患者基线sCr相差0.3 mg以内。对于无反应或部分反应的患者,应在14 d内停止治疗。鉴于HRS病理生理的复杂性,这些患者应强烈考虑结构损伤的可能性。全身炎症和氧化应激可以影响治疗反应,如ACLF患者的全身炎症程度会影响HRS-AKI对药物治疗的反应。在HRS-1患者中,对特利加压素加白蛋白治疗的应答状态与尿NGAL水平无关,提示有肾实质损伤时患者仍可获益。
相反,尽管对特利加压素加白蛋白的反应率较高,但HRS-2的复发很常见。此外,最近的一项病例对照研究未显示接受特利加压素治疗的患者在肝移植(LT)后转归方面有益处。因此,HRS-2(现称为HRS-NAKI)不能被视为使用特利加压素加白蛋白的指征。
4.1 血管收缩剂的类型与治疗反应 目前有3种血管收缩剂可用于治疗HRS,特利加压素、去甲肾上腺素及米多君+奥曲肽的组合。多项随机对照试验表明,特利加压素和白蛋白的联合在治疗HRS方面比单独使用白蛋白更有效。在最近的两项随机对照临床试验中,以sCr降低>50%并<1.5 mg/dl(133 μmol/L)为标准,对特利加压素联合白蛋白表现出完全反应的HRS-1患者达55.5%,停药复发率不到20%,再治疗通常是有效的。
米多君(一种α1 激动剂)与奥曲肽联合白蛋白输注也可有效治疗HRS-1。然而,在一项小型、单中心、随机对照试验中,特利加压素联合白蛋白治疗HRS,显示比米多君联合奥曲肽和白蛋白的组合更有效。多项研究表明,去甲肾上腺素(以0.5~3 mg/h的剂量给药)联合白蛋白治疗HRS-1患者,与特利加压素一样有效。但最近的一项随机试验提示特利加压素在治疗ACLF患者的HRS时,比去甲肾上腺素更有效;但去甲肾上腺素有价格优势,值得临床尝试。
白蛋白对于HRS的治疗至关重要。特利加压素可能会加剧心输出量(CO)的下降,不利于HRS。相比之下,白蛋白的非渗透特性能够维持或增加CO和增加全身血管阻力。白蛋白还有抗氧化和抗炎作用,其给药剂量为 20~40 g/d,并根据中心静脉压进行管理,以避免循环超负荷[17]。
4.2 经颈静脉肝内门体分流术(TIPS) TIPS可降低门静脉压力,减少血管收缩物质,增加肾脏灌注,可能改善肾功能。但也有可能影响肾血流而加重HRS,目前尚处于探索性阶段。
4.3 肾替代治疗及人工肝 出现高血钾、酸中毒、高容量的HRS,可考虑分子吸附再循环系统治疗,但风险极大,不作常规推荐。RRT可用于移植前过渡。
4.4 肝肾综合征患者的肝移植 肝移植(LT)是HRS-AKI患者的最佳治疗,无论他们对药物治疗的反应如何。在移植等待中,HRS-AKI药物治疗应答者须获得正确的移植优先权,考虑到sCr改善可以降低MELD评分,排序时应充分考虑基线MELD,或在计算MELD评分时将HRS的药物治疗视为透析,可以避免延误时机。至于对药物治疗无反应的患者行同步肝肾移植 (SLK)的问题,应考虑AKI持续时间、透析需求和CKD证据等要素[18]。
5 小结
肾功能不全是肝硬化、ACLF 和 ALF 患者的常见并发症,HRS是其中的特殊类型。HRS的性质可能主要是功能性的,也可能与连续性肾损伤谱中的某种程度的肾实质损伤有关。目前肝肾综合征的诊断基于2015年ICA的临床标准,尚无用于确诊的特异性指标。2019年Angeli等提出的HRS新定义和分类,是基于有价值的新数据,可能有重要的临床意义,但需要在前瞻性研究中进行验证。应强调对有HRS风险的患者采取预防措施,包括适当的抗生素预防和使用白蛋白。对于已确诊的HRS患者,特利加压素联合白蛋白被认为是一线药物治疗,但疗效随着AKI严重程度的增加、全身炎症加重和胆汁淤积的存在而减弱。肝移植仍然是最佳治疗方法,及时转诊进行移植评估对于避免永久性肾损伤和同时进行肝肾移植的需要至关重要。TIPS的疗效待进一步研究。
