佛山地区孕妇线粒体耳聋基因突变分析
2021-11-29宋春林邓璐莎陈淑芬
宋春林 邓璐莎 陈淑芬 周 成
广东省佛山市妇幼保健院产前诊断中心,广东佛山 528000
听力损失是最常见的人类健康问题之一,全球约有3.6 亿耳聋人口。每700~1000 名新生儿中就有1个受到影响,约50%的病例是由遗传因素引起的,约70%的遗传性听力障碍是非综合征性听力损失[1]。间隙连接β2 蛋白(gap junction β2 protein,GJB2)、间隙连接β3 蛋白(gap junction β3 protein,GJB3)、溶质载体家族26 成员4(solute carrier family 26 member 4,SLC26A4)和线粒体DNA(mitochondrial DNA,mtDNA)突变是非综合征性听力损失最常见的遗传原因[2]。遗传性耳聋可根据遗传方式分为常染色体显性遗传性耳聋和常染色体隐性遗传性耳聋,此外还有伴性遗传性耳聋以及母系遗传性耳聋。其中,母系遗传性耳聋由线粒体基因突变引起,是基因和环境等多方面的因素作用的结果,特别是在氨基糖甙类药物相关性耳聋中扮演着重要的角色,其比例占5%左右。然而,其性质和频率的可变性在不同人群中存在遗传异质性[3]。由于不同的遗传背景,这些基因的突变谱在中国不同地区常见的致聋基因各不相同。本研究分析佛山地区人群耳聋基因突变谱,对线粒体常见突变位点进行了扩增并测序,为孕妇耳聋基因筛查的遗传咨询提供依据。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年4月在佛山市妇幼保健院产科门诊就诊的孕妇作为研究对象,分析其常见耳聋易感基因突变比例并测序研究线粒体突变类型。在接受耳聋知识宣教和遗传咨询后,最终纳入研究20299 人,年龄19~43 岁。本研究通过医院医学伦理委员会批准,参与研究的患者经过充分地知情自愿选择并签署了知情同意书。排除标准:环境因素导致的耳聋、综合征性耳聋、外伤导致的耳聋。
1.2 方法
1.2.1 DNA 提取 使用ACD 抗凝管真空采血管采集孕妇外周血2 ml,混匀,采用自动核酸提取仪(西安天隆科技有限公司,NP968-c)提取DNA,使用核酸定量仪(赛默飞世尔科技公司,Nanodrop2000)检测浓度和纯度。
1.2.2 导流杂交 采用耳聋易感基因检测试剂盒和导流杂交仪(广东凯普生物科技有限公司,HB-2012A),按试剂盒说明书操作,检测常见耳聋基因型突变,包括:GJB2 基因的176del16、235delC、299de lAT、155delTCTG、35delG五个位点;SLC26A4 基因的1229C>T、2168A>G、IVS7-2A>G 位点;线粒体DNA中1555A>G、1494C>T、7445A>G、12201T>C 位点;以及GJB3 中的538C>T 位点。
1.2.3 扩增与纯化 采用特异引物对线粒体基因的特定突变区域进行特异性扩增,并将扩增产物使用琼脂糖凝胶DNA 纯化试剂盒(天根生化科技有限公司,Cat NO.DP209-03)回收纯化。引物(上海生工生物工程有限公司)序列为:mtD1555-F(5'-3'):AGAACACT ACGAGCCACAGC;mtD1555-R(5'-3'):CATCTTTCCCTTGCGGTACTA;mtD7445-F(5'-3'):CTAACTTTC TTCCCACAACAC;mtD7445-R(5'-3'):CTATTTCCTGAGCGTCTGAG;mtD12201-F (5'-3'):CTAGTCACA GCCCTATACTCC;mtD12201-R(5'-3'):CTGATAATA AAGGTGGATGCGA。扩增程序为:95℃变性9 min,(95℃30 s、57℃30 s、72℃60 s)×40 循环,72℃延伸5 min,16℃保存。
1.2.4 Sanger 测序 采用BigDye Terminator 试剂盒进行测序PCR,每管PCR 混合液只加单端引物,96℃1 min,(96℃10 s,50℃5 s,60℃4 min)×25 循环,纯化上机在毛细管电泳仪(美国应用生物公司;3500Dx)上测序。
2 结果
2.1 导流杂交结果
通过第一轮的导流杂交法检测4 个耳聋基因13个位点,总阳性率为3.64%(739/20299)。其中GJB2:35delG 杂合突变1 例;GJB2:176del16 杂合突变14例;GJB2:235delC 杂合突变349 例;GJB2:299delAT 杂合突变40 例;GJB2:155delTCTG突变未发现;PDS:2168A>G 杂合突变26 例;PDS:IVS7-2A>G 杂合突变180 例;PDS:1229C>T 杂合突变50 例;mtDNA:1555A>G 均质突变36 例,异质突变13 例,低比例异质突变1例;mtDNA:1494C>T 均质突变3 例,异质突变2 例,mtDNA:12201T>C 突变未发现;mtDNA:7445A>G 突变未发现;GJB3:538C>T 杂合突变24 例(表1)。
2.2 线粒体基因测序结果
通过对线粒体基因扩增特定位点并进行Sanger法基因测序验证,检测出24 种突变位点。根据测序峰值结果判断是均质突变或异质突变,通过查询线粒体基因数据库判断其突变性质,分为5 种性质:良性突变、疑似良性突变、致病性未明、疑似致病突变、致病突变。其中良性突变位点6 种,疑似良性突变位点1 种,致病性突变位点3 种,致病性未明突变位点14种。共检测出线粒体突变阳性130 例(表2)。
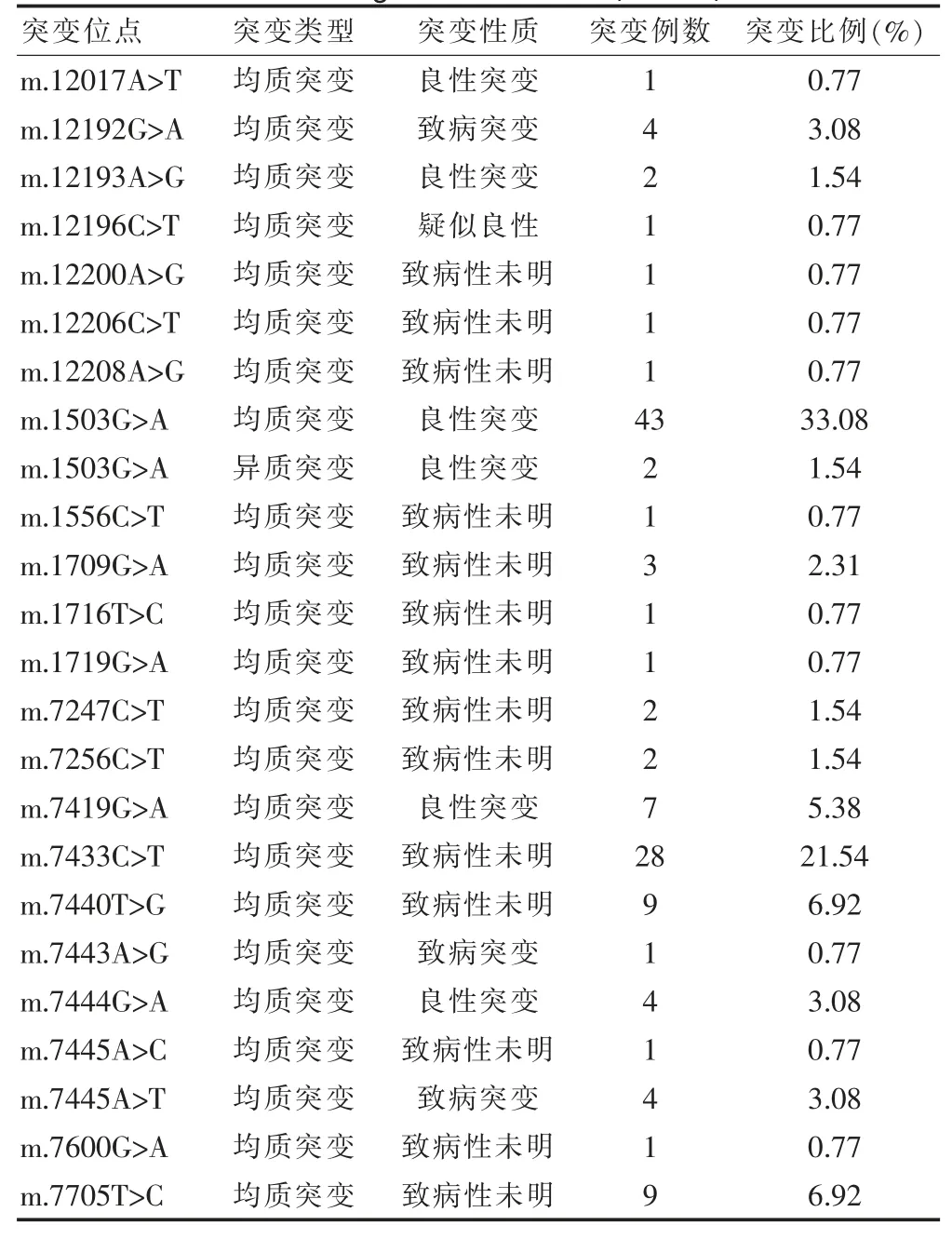
表2 Sanger 测序鉴定结果(n=130)
3 讨论
听力障碍使得患者自幼无法接收语言信号而形成聋哑。在我国,每年出生听力缺陷儿童约3 万,2010年末听力残疾人口达到了2054 万,占2010年全部残疾人口的24%[4]。遗传性耳聋中超过70%的患者为非综合征型耳聋,大约5%由线粒体DNA 突变引起,属于母系遗传[5]。线粒体的功能损伤除了与耳聋相关,还与遗传性糖尿病、衰老、肿瘤等多种疾病有关[6]。
线粒体DNA 包含37 个基因,涉及rRNA、tRNA和多种参与氧化磷酸化的酶复合物。线粒体12SrRNA突变与非综合征性听力损失有关。但单独的mtRNR1突变不足以产生临床表型。还需要修饰因子、氨基糖苷类抗生素和线粒体单倍型的参与。线粒体基因点突变导致tRNA 的修饰,rRNA 结构的改变从而影响到ATP 的生产。比如A1555G 的突变影响了rRNA 基因氨酰基-tRNA 受体位点。突变的12SrRNA 的结构类似于细菌大肠杆菌的16SrRNA,因此中断了RNA 转录和蛋白质合成。受影响的内毛细胞凋亡,导致渐进的感音神经听力损失,从而出现了一针致聋的现象[7]。线粒体DNA 的突变率是核DNA 的10 倍左右。因此线粒体DNA 的突变呈现出更大的异质性。如3243 腺嘌呤到鸟嘌呤的突变,根据异质性比例不同,可导致线粒体脑肌病MELAS 或糖尿病伴听力障碍。由于线粒体DNA 基本来源于卵母细胞,所以患者表现为母系遗传,mtDNA 拷贝数变化在不同疾病或疾病发展的不同阶段变化有所不同[8]。因此本研究对来产检的孕妇进行了充分的遗传咨询和耳聋宣教,在知情同意后对孕妇进行了线粒体耳聋基因的筛查。并对于部分筛查可疑的孕妇进行了线粒体特定片段的基因测序。
本研究采用导流杂交术检测4 个耳聋基因13 个常见位点突变,共检出有突变的孕妇739 例,阳性率为3.64%。其中突变频率最高的是GJB2 的235delC位点突变,共349 例,占所有突变的47.22%,其次是PDS 的IVS7-2A>G 突变,共180 例,占所有突变比例的24.36%。该研究除了线粒体外的三大基因的结果与文献报道的中国客家新生儿筛查结果基本一致[9]。
线粒体A1555G 基因突变导致的氨基糖甙类药物性耳聋是迄今为止研究得最深入、最广泛的mtDNA突变。氨基糖甙类抗生素和线粒体12SrRNA 的基因突变后的碱基结合,干扰了rRNA 的蛋白合成,导致细胞凋亡,从而发生耳聋[10]。1494C>T 突变导致了线粒体编码的12SrRNA 的二级结构发生了改变,并极容易与氨基糖甙类药物结合。同时影响了线粒体的功能,细胞出现ATP 的合成障碍[11]。而线粒体tRNA Ser7445A>G 突变会导致COI 基因的终止密码子发生改变和线粒体稳定性下降,导致了线粒体的氧化呼吸功能缺陷的发生。T12201C 突变下调了tRNA 的表达,从而影响了线粒体蛋白的合成、降低了氧气消耗,进一步引起了细胞内线粒体功能障碍[12]。本研究检测出mtDNA:1555A>G 均质突变36 例,mtDNA:1555A>G 异质突变13 例,mtDNA:1555A>G 低比例异质突变1 例,mtDNA:1494C>T 均质突变3 例,mtDNA:1494C>T 异质突变2 例,都与氨基糖甙类药物性耳聋相关。在异质突变的情况下,由于随着年龄的增长,线粒体突变的改变,以及不同组织中线粒体的异质性,临床仍然建议一般情况下不使用耳毒性药物。mtDNA:12201T>C 突变和mtDNA:7445A>G 突变在这次研究中都没有检测到。比较相关文献,这可能与本研究的样本群体有关,提示线粒体基因存在异质性,也提示线粒体基因测序的必要性[13]。
本研究对线粒体特定片段位置进行扩增并采用Sanger 测序检测突变,结果显示发生130 例线粒体阳性突变,其中包括24 种突变位点,6 种为良性突变,但是其中的m.7444G>A 以前认为有风险。研究[14]表明,tRNASer7444 位点的鸟嘌呤到腺嘌呤的突变会引起线粒体COI 基因翻译后的多肽链在C 端增加了3 个氨基酸(赖氨酸-谷酰胺-赖氨酸),从而导致折叠后的蛋白结构出现异常,进而影响复合物的功能。研究还发现了线粒体DNA7444 位点的G>A 突变也会加重1555A>G 突变引起的线粒体氧化呼吸功能的缺陷从而加重了临床表型[14]。但,后来基于数据库的更新,根据ACMG 指南分级,该突变被判定为致病性存在争议。该位点所在密码子为终止密码子,突变后变为编码亮氨酸,提醒可能存在风险,是否一定出现临床症状则无法准确预测。检测出致病性未明的突变14 种。m.12196C>T 之前也是致病性未明,基于更新后的CMG 指南,该突变被判定为一个疑似良性突变[15]。因此线粒体基因测序可以丰富突变谱,随着数据的增加,对于突变位点的致病性的认识也可能改变。本研究检测出3 种致病性位点。m.12192G>A 在Leber 视神经病有见报道,且提到与心肌病相关;m.7443A>G与非综合征型耳聋相关,患者听力损失程度从正常到严重均有可能;m.7445A>T 与非综合征型耳聋相关,患者听力损失程度从正常到严重均有可能。其作用机制可能与mtDNA:7445A>G 突变相似[16]。随着基因测序更多数据的更新,线粒体基因的遗传咨询也会随着改变。这也提示了线粒体基因测序具有重要价值。
综上所述,单一的导流杂交术只能检测常见耳聋基因位点,由于线粒体基因突变的异质性,孕妇线粒体的筛查和测序可以丰富线粒体基因突变的数据库。孕妇若检测出突变,则会遗传给下一代,且母系家族成员应为同样突变,临床应建议提示风险。因此,导流杂交术结合Sanger 测序法在孕妇耳聋筛查的应用,能够更好地为孕妇提供遗传咨询,在耳聋防控中有重要的价值。
