麦瘟病与小麦抗麦瘟基因研究进展
2021-11-27王士臻王教瑜王艳丽孙国仓
王士臻, 王教瑜, 王艳丽, 孙国仓
(农产品质量安全危害因子与风险防控国家重点实验室, 浙江省农业科学院 植物保护与微生物研究所, 浙江 杭州 310021)
小麦是世界三大主要粮食作物之一,种植面积大、分布范围广,是世界范围内种植最为广泛的禾本科作物。2017年全世界小麦产量达7.71亿t,仅次于玉米。然而,由于病害的影响,每年造成的小麦产量损失高达10%,成为危害粮食安全的重要因素。
小麦麦瘟病,1985年,首次发现于巴西,主要危害小麦穗部,由稻瘟病菌小麦专化型(Magnaportheoryzae, sp.Triticum, MoT)侵染引起[1]。随后,该病原菌传播至相邻的南美国家和地区[2-3]。由于该病害主要危害小麦穗部,一旦受到侵染,会直接造成产量损失[1,4-5]。巴西一半的小麦产区受到麦瘟病危害[1],巴拉圭、玻利维亚等地区2009年由麦瘟病导致的小麦产量损失在50%左右[6-7]。有研究表明,即使在使用农药的情况下,2005年巴西小麦依然减产14%~32%[7]。抽穗期如遇高温高湿天气,受害情况会更加严重。该病害已成为南美小麦产区的重要病害,威胁当地小麦生产安全。由于没有有效的防治措施,为防止麦瘟病进一步扩散,当地政府只能焚烧数百公顷的病区小麦,给当地经济带来了严重的损失。自发现以来的30年,麦瘟病一直只在南美州地区流行传播。然而,2016年,麦瘟病首次出现在亚洲的孟加拉国,2017年,该病害传播至印度[8]。对亚洲乃至全世界的小麦生产形成了潜在威胁。
近年来,世界各国的科学家对麦瘟病进行了广泛和深入的研究,在麦瘟病菌的起源、麦瘟病趋势预测、麦瘟病抗病基因、无毒基因的鉴定以及小麦-麦瘟病菌互作方面取得了较大进展。目前我国还没有麦瘟病发生的报道,但部分地区存在麦瘟病的发病条件,随着全球气候变暖有暴发麦瘟病的可能,应引起重视。本文综述了麦瘟病的病原菌、发病过程与发病条件、抗病基因和无毒基因,以及小麦-麦瘟病菌互作等方面的研究进展。以期为加快我国麦瘟病发病机理和小麦抗性育种研究提供参考,并为预防我国麦瘟病的发生未雨绸缪。
1 病原菌及其危害
麦瘟病是由梨孢菌小麦专化型(Magnaportheoryzae, sp.Triticum, MoT) 引起,无性态为灰梨孢菌 (Pyriculariaoryzae),可侵染50多种禾本科植物,包括水稻、大麦、燕麦等栽培植物,以及牛筋草、狗尾草、马唐等杂草。根据寄主植物的不同,梨孢菌可被分为不同的专化型,如侵染燕麦(Avenasativa)的Avena专化型(MoA);侵染水稻(Oryzaesativa)的Oryzae专化型(MoO);侵染穇子(Eleusinecoracana)的Eleusine专化型(MoE);侵染狗尾草(Setariaviridis)的Setaria专化型(MoS);以及侵染小麦(Triticumaestivum)的Triticum专化型[1,8-10]。其中,由稻瘟病菌水稻专化型(M.oryzae, sp.Oryzae, MoO) 引起的水稻稻瘟病一直以来都是水稻生产上的重要病害,在全世界80多个水稻种植区均有发生。该病害可对整个水稻生育期造成侵害,形成叶瘟、穗瘟、穗颈瘟等。全世界每年由于稻瘟病而造成的水稻产量损失相当于损失10%~30%的水稻种植区面积,近50亿美元[11]。
稻瘟病菌侵染的生物学过程研究相对较多,该菌喜适温高湿的环境条件,常被发现于深水稻田中[12-13]。在适宜的环境下,稻瘟病菌形成梨形的分生孢子,利用分生孢子侵染水稻的叶片和穗部,以菌丝体和分生孢子的形式在病谷及病稻草上越冬,翌年作为初侵染源侵染作物。麦瘟病原菌形态上与稻瘟病原菌相同,与稻瘟病不同的是,田间小麦叶瘟则并不常见,只有高感的小麦品种受麦瘟病菌侵染时才能观察到叶瘟病斑[7],因此,当能够观察到麦瘟病发生时,穗部已经受到麦瘟菌的侵染,呈现出苍白干瘪的病状,加大了麦瘟病的防治难度。
2 麦瘟病菌的侵染过程及病状
Cruz等[14]研究发现,在小麦叶片受侵染时,与水稻幼叶容易受稻瘟菌侵染不同,小麦老叶更易被麦瘟菌侵染。小麦叶片或穗部受侵染后呈现出典型的梭形病斑,受侵染的小麦基部叶片上能够产生数万至数十万孢子。
叶片侵染过程:麦瘟病菌菌株孢子悬浮液接种小麦叶片6 h后,在近轴叶片上开始发芽,12 h后开始分化出芽管以及附着胞,12~24 h后,附着胞附着部位叶片表面的蜡质消失,36~72 h后,形成侵入钉,同时附着胞和孢子逐渐干瘪萎缩[6]。叶片受麦瘟病菌侵染后呈现出梭形病斑,外缘有明显的边界线(图1-A),严重时病斑呈现出绿色水渍状。
穗部侵染过程:同样该病原菌孢子悬浮液接种穗部72 h后,可见大量菌丝侵入花轴,同时向上向下扩展,引起穗部变色。120 h后,菌丝从侵染的花轴组织扩展到外表皮以及髓部薄壁组织。168 h后,菌丝侵入木质部导管、薄壁组织以及表皮。菌丝在花轴细胞同时向内外扩展,甚至突破细胞壁,彻底摧毁麦穗[6]。穗部受侵染时,病原菌一般从穗轴侵入,受侵染的穗部全部或部分死亡,呈白色干枯、谷粒干瘪或无籽粒状态(图1-B),直接影响小麦产量。
3 麦瘟病发生条件
气候条件是麦瘟病大规模发生以及流行的重要因素。经研究发现,麦瘟病发生流行的最佳温度范围是25~30 ℃。高温并伴有长时间的降雨,则比较容易大规模暴发麦瘟病,南美洲麦瘟病暴发流行地区的气候特点是长期或者突然遭遇到高温高湿的极端气候,如玻利维亚、巴西等[3,15]。同样,Islam等[16]研究认为2016年麦瘟病在孟加拉国暴发流行是由于当地气温相较2015年升高了1.8~6.5 ℃,除此之外,扬花期降雨更加重了麦瘟病的发生概率以及发病程度。 随着全球气候变暖加剧、病原菌菌株的不断进化,麦瘟病在南美及南亚以外地区传播与流行的可能性还将持续增加。
4 麦瘟病抗性基因及无毒基因的鉴定与定位
自1985年首次报道麦瘟病以来,研究者们对世界不同地区的小麦种质资源进行抗性鉴定以及抗性基因定位。
4.1 抗性基因的定位
截至目前,在小麦中一共鉴定出9个抗性基因(表1),包括Rmg1(又名Rwt4)、Rmg2、Rmg3、Rmg4、Rmg5、Rmg6、Rmg7、Rmg8、RmgGR119。Rmg1(Rwt4) 是针对Avena致病型菌株Br58具有抗病性并被定位于日本小麦品种N4(農林4)1D染色体,该基因在高温(27~29 ℃)亦可发挥作用,与之关联的无毒基因(AVR-gene)为PWT4[17]。Zhan等[18]利用Triticum致病型病原菌Br48对小麦品种Tatcher进行叶片接种,发掘抗性基因Rmg2和Rmg3并分别定位于7A和6B染色体,但该基因在高温或穗部的抗病性较弱[19]。Nga 等[20]在小麦品种N4以及RE(Red Egyptian)中发现针对稻瘟菌Digitaria致病型菌株Dig41的抗性基因Rmg4、Rmg5并定位于4A和6D染色体。Rmg6对Lolium致病型菌株TP2具有抗性,定位于小麦品种N4的1D染色体[21],相关的无毒基因为PWT3。Tagle等[19]在四倍体小麦品种St17/St24/St25中发现对Triticum致病型菌株Br48具有抗性的基因——Rmg7,该基因在穗部有较好的抗性表现,并将其定位于St24的2A染色体。此外,Anh 等[22]在六倍体小麦S-615中鉴定出抗性基因Rmg8,定位于2B染色体,该基因在叶片、穗部抑或是高温都能够表现出较强的抗病性。Wang等[23]在小麦品种GR119中鉴定出抗性基因——RmgGR119,该研究表明GR119中含有两个抗性基因,分别为Rmg8以及RmgGR119。
然而,上述已鉴定的抗病基因均存在一些缺陷,例如:Rmg2和Rmg3在高温或者穗部的抗病性较弱;Rmg7则是在高温下抗病性表现不显著等等。
4.2 麦瘟病菌无毒基因的鉴定
植物与病原菌之间的不亲和性符合基因对基因(gene-for-gene)学说[24],该学说是解释植物与病原菌之间抗性互作的理论基础,在稻瘟菌已鉴定出40多个AVRgene,其中19个被成功克隆[25]。
目前,在与小麦互作的梨孢菌中鉴定的AVR-gene共有3个,PWT4、PWT3(A1)以及AVR-Rmg8(表 1)。稻瘟菌Avena致病型菌株Br58中鉴定并克隆的无毒基因PWT3和PWT4,其中PWT4与Rmg1互作[17];Lolium致病型菌种TP2中的无毒基因同样鉴定到与Rmg6互作的无毒基因,PWT3[21];Rmg7与Rmg8均与AVR-Rmg8相互识别[26]。其中,Inoue等[27]认为,携带PWT3的菌株是造成巴西麦瘟病大暴发的重要因素。此外,Asuke等[28]在进行梨孢菌穇属致病型(MoE)与小麦的非亲和互作的相关研究中发现,该致病型菌株至少存在5个无毒基因与小麦中的抗性基因互作。
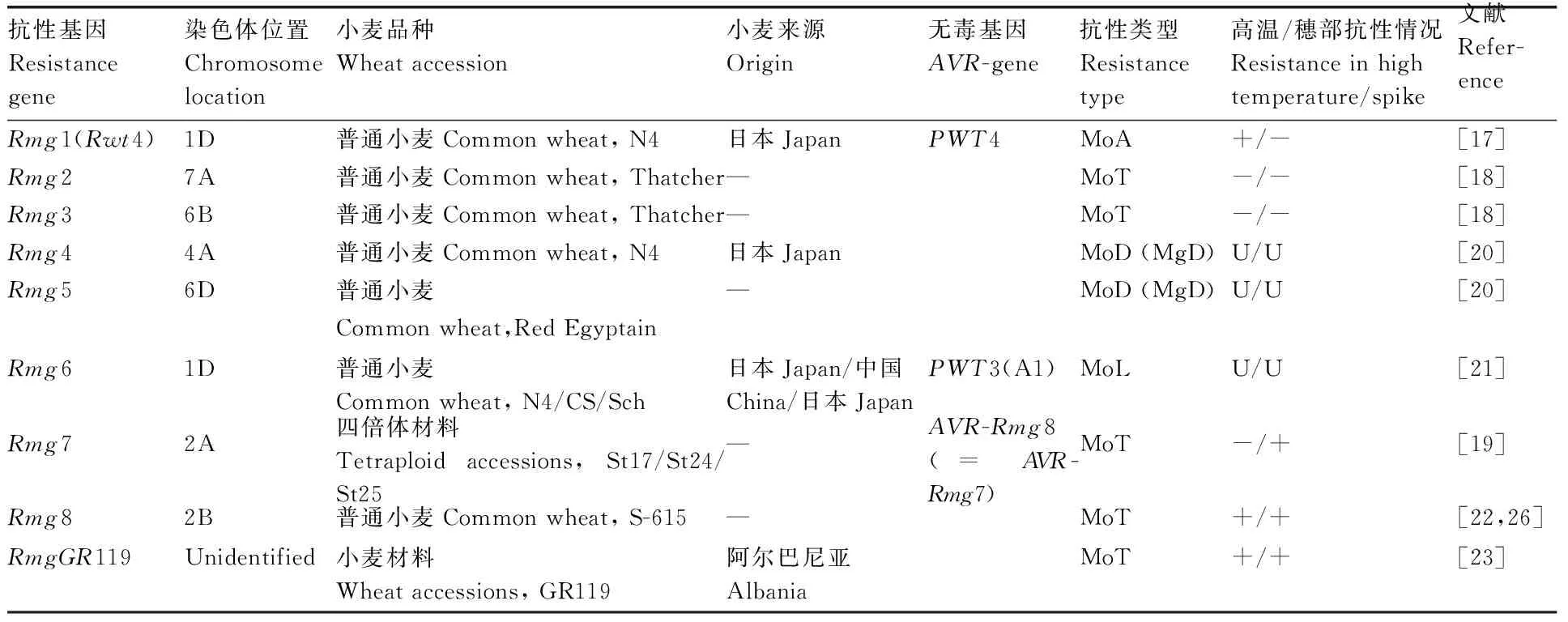
表1 小麦中已鉴定的抗性基因
5 小麦抗麦瘟病能力评价方法
麦瘟病抗性基因鉴定一般分为两种:苗期叶片抗性鉴定与成株期穗部抗性鉴定。在实验室条件下,叶瘟的发病程度常常作为判断小麦材料抗感差异的评价体系。
苗期叶片抗性鉴定是利用活体接种法,即在接种前一天将小麦第一叶叶片固定在透明背板上,将调整好浓度的病原菌孢子悬浮液均匀喷施在叶片上。黑暗保湿培养24 h,之后将接种后的小麦继续光暗交替培养3~5 d。通过观察病斑大小、发病程度以及叶片颜色等表型,判断小麦苗期抗性等级。根据病斑大小从0到5可被分为6个等级[23]:0,没有明显可见的侵染点;1,针孔型斑点;2,小的病斑(<1.5 mm);3,病斑中等大小但分布稀疏(<3 mm); 4,大而典型的病斑;5,叶片完全枯萎。此外,还需要明确病斑颜色,如B代表褐色,G代表绿色。例如,侵染类型3B代表中等大小的褐色病斑。等级0~5并为褐色病斑被定义为抗病,而3G、4G、5G则被定义为感病(图2)。
由于小麦麦瘟病是穗部病害,因此,小麦穗部的抗性表现被认为是判断抗性基因抗病能力以及抗性基因是否稳定表达的依据。穗部抗性鉴定与苗期鉴定基本相同,将收集到的麦穗插入含有清水的试管中,并将一定浓度的孢子悬浮液均匀喷施在小麦穗部(包括穗颈)。黑暗保湿培养24 h,之后将其取出,继续光暗交替培养7~10 d。通过记录病斑大小、发病程度以及颖片颜色等表型观测发病情况,明确抗性等级。与叶片等级相似,根据病斑大小从0到5可被分为6个等级[19]:0,没有明显可见的侵染点;1,针孔型斑点;2,小的病斑(<1.5 mm);3,病斑中等大小但分布稀疏(<3 mm); 4,白绿色病斑且无明显由于过敏性反应而产生的褐色病斑;5,麦穗完全枯萎。侵染等级0-3被定义为抗病,而4和5则被定义为感病(图3)。
此外,我们利用浙江省采集的稻瘟菌株对国内收集的小麦品种进行了初步筛选。结果发现,大部分的小麦品种,包括叶片和穗部,均可被稻瘟菌侵染,并形成典型的瘟病病斑。这表明我国小麦对稻瘟菌株并不存在集体免疫的情况,随着稻瘟菌株不断变异,在合适的环境条件下,国内的稻瘟菌株可能发生寄主跃迁,侵染小麦,威胁我国小麦安全生产。
6 梨孢菌与小麦间的互作
日本神户大学Yukio Tosa团队研究发现,寄主跳跃是梨孢菌侵染小麦的契机,推测是由于80年代初巴西广泛种植rwt3小麦,为携带PWT3的某些稻瘟病菌的存在及繁殖提供了便利条件。PWT3为稻瘟菌株Br58中分离鉴定的无毒基因,与之互作的抗病基因为Rwt3,该研究表明这些含有rwt3的小麦品种是侵染黑麦草属 (Lolium)的稻瘟菌株发生寄主跳跃的一块跳板,使梨孢菌成功侵染小麦,导致巴西麦瘟病大暴发[27]。Asuke等[30]研究发现,在所有Eleusine(Ec-II) 致病型菌株中均存在具有功能的PWT3等位基因,可被Rwt3识别,在对P.oryzae的不同致病型,如Eleusine、Lolium以及Avena的互作中具有制约作用,证明Rwt3是小麦中重要的抗性基因。此外,该团队早期鉴定的抗病基因Rmg8,被认为是针对麦瘟病原菌抗病能力强且稳定的抗性基因,Wang等[23]研究表明,RmgGR119可与Rmg8协作,无论在苗期还是穗期,抑或是高温情况下均可表现出完全抗病性。然而,Inoue等[31]发现PWT4对抗病基因Rmg8的表达具有抑制作用,同时PWT4关联的抗性基因Rwt4可以抵消PWT4对Rmg8的抑制作用。通过此次的研究发现,Rmg8的抗性可能被削弱,进一步加大了麦瘟病全球暴发的风险以及防治难度。
7 问题与展望
在麦瘟病发生之前,1936年的报道称麦瘟菌早已在巴西存在[5];发生麦瘟病后,美国肯塔基州立大学研究人员曾在美国发现受麦瘟病菌侵染的小麦植株,该菌株(MoL)在美国已存在16年之久[15]。然而,美国并没有发生麦瘟病的大流行推测可能是由于气候条件目前还不适宜麦瘟病的流行。
周益林等[32]、曹学仁等[33]研究分析认为,我国云南、广东、广西以及海南等具有高温高湿气候条件的地区存在暴发麦瘟病的潜在可能,随着全球温度升高,高温高湿的气候加剧,无疑为该病害提供了传播、流行的有利条件,无论我国或是全球遭受麦瘟病原菌侵害的地区将进一步扩大。尽管目前我国还未有小麦受麦瘟病原菌侵染的报道,但基于我们前期的研究(资料未发表),大部分的稻梨孢菌均可侵染我国大多数的小麦品种。此外,我们还发现除了大部分小麦易受侵染之外,某些来自同一地区的小麦表现出良好抗病性,我们推测该抗病性由同一个抗性基因控制,结合Wang等[23]对世界范围内收集的520多个小麦品种进行初筛选时的报道,520个小麦品种中仅有20多个品种表现出抗性,且其中18个小麦品种的抗病性均只由Rmg8控制。由此可见:(1)我国的小麦品种从种质而言有被麦瘟菌侵染的可能性或者稻梨孢在气候条件适宜的情况下,存在类似巴西麦瘟病菌发生寄主跳跃的可能;(2)无论从世界范围内还是我国的小麦种质资源来看,小麦本身存在的梨孢菌抗性基因均十分稀缺,且较为单一,进一步加大了麦瘟病在我国或是全球流行的风险。
由于目前针对麦瘟病并没有行之有效的防治方法,因此,选育和利用抗病品种被认为是当前既经济且环境友好的防治措施,能够有效减少病害带来的直接或间接损失。而在实际生产中,若大面积、长时间使用含有单一抗性基因的抗性品种,随着致病菌种的变异,小麦致病小种上升,最终往往导致抗性丧失。Wang等[23]提出由于Rmg8是存在范围较广且抗病能力较强的一个抗病基因,RmgGR119与Rmg8同时存在时,彼此的协同作用进一步促进了抗性基因的表达,因此,在选育抗性品种时,应考虑将RmgGR119和Rmg8同时转入小麦品种中,以实现抗性能力的叠加,且多种抗性基因的富集不易使寄主抗性丧失。此外,小麦麦瘟病是穗部病害,抗病基因是否可以在穗部良好表达直接影响发病严重程度以及小麦产量。因此,寻找广谱、高效且能在穗部良好表达的抗病基因仍是目前针对麦瘟病抗病育种的关键。
在2011年APS国际会议上,Duveiller等[34]曾通过分析预测印度、孟加拉国以及埃塞俄比亚存在暴发麦瘟病的潜在风险。如今麦瘟病已在孟加拉国及印度相继发生,再一次证明了该病害可以在南美洲之外的任何环境适宜的地区传播、流行及暴发。下一个受侵害的国家会是埃塞俄比亚,还是其他国家或地区?孟加拉国会不会是第二个“巴西”?我国与孟加拉国邻近、与印度接壤,小麦年产量居世界首位,若麦瘟病成功入侵我国,势必会给我国小麦带来严重的威胁。全球性气候变暖,厄尔尼诺现象频发,均为该病害提供了传播、流行的有利条件,无疑将会加剧麦瘟病的传播与暴发风险,使其在全球包括中国的潜在分布范围进一步扩大,因此,加强麦瘟病研究,增加对该病的了解和知识储备,方可防患于未然。
综上,本研究认为,我国的研究者应尽快开展对麦瘟病的发生、防治、流行等方面的研究。首先应针对我国现有的小麦品种进行抗病性评估,针对具有抗性表现的小麦品种,发掘、定位抗性基因,为抗性品种育种提供理论基础。其次,还应对小麦-麦瘟病菌间的互作机制进行研究,分离和鉴定病菌中的相关致病基因,为寻求有效防治方法,提供分子理论基础,为麦瘟病的防治以及选育持久有效抗性品种奠定必要的基础。最后,研究者或研究机构也应加强同麦瘟病发生国以及麦瘟病研究中心的技术交流与合作,加强基础研究,实现优质育种,为我国预防麦瘟病发生做出准备。
