电离辐射对断乳期小鼠脾脏发育的影响研究
2021-11-27郑宇栋刘元朵王长征黄江荣
郑宇栋,刘元朵,王长征,黄江荣,刘 莲
(1.长江大学医学部基础医学院,湖北 荆州 434023;2.长江大学第二临床医学院,湖北 荆州 434023)
环境中电离辐射的来源主要包括天然本底辐射、核泄漏及医疗环境辐射。医疗环境辐射已成为公众辐射的主要来源,且主要为X射线。研究证实,电离辐射除了可造成神经系统[1]、心血管系统[2]损伤外,对于免疫系统[3]和造血系统[4]的影响也十分明显。
脾脏作为人体较为关键的造血免疫器官,除具有广泛的免疫功能外,在造血和红细胞清除中也起着重要的作用,是辐射损伤最常见的器官之一[5]。有研究发现,3 Gy的辐射即可降低成年小鼠脾脏指数及外周血象中的白细胞数量[6]。目前研究多关注于辐射对成年小鼠脾脏的影响,而辐射对断乳期小鼠脾脏的生长状态及功能的影响研究甚少。
电离辐射致损伤的众多靶点中,DNA是辐射损伤的主要目标。DNA损伤形成后,可激活细胞内DNA损伤应答调控反应,维持基因组的稳定性[7]。组蛋白H2AX在分子对DNA损伤应答反应中起着至关重要的作用[8]。DNA双链断裂(DSBs)发生后,其磷酸化产生的γ-H2AX可以及时反映DNA损伤程度和修复情况。此前研究发现γ射线可诱导人淋巴细胞中H2AX磷酸化蛋白的表达增加[9],然而辐射对脾脏组织中H2AX表达及其影响目前甚少报道。本研究探究了X射线辐射对断乳期小鼠脾脏生长状态和功能的影响及可能的机制,以期为急性电离辐射损伤动物模型的建立和辐射防护提供实验依据。
1 材料和方法
1.1 材料
SPF级21日龄健康C57BL/6J小鼠14只[北京市实验动物研究中心,动物合格证号:SCXK(京)2016-0006],医用电子直线加速器(Elekta,英国),CM1950冷冻切片机(Leica,德国),DM LB2显微镜(Leica,德国),全自动血细胞分析仪(Olympus AU,日本),GelDoc XR凝胶成像系统(BIO-RAD,美国),全波长酶标仪(Thermo,美国),BBY24 M全自动组织破碎仪(NESTADVANCE,美国),ML-204电子分析天平(Mettler Toledo,美国),涡旋混合器(金坛市医疗仪器厂,中国),电热恒温干燥箱(上海新苗医疗器械制造有限公司,中国),β-actin抗体、H2AX抗体(Cell Signaling Technology,美国),羊抗鼠抗体(Invitrogen,美国),羊抗兔抗体(Jackson,美国),ABC试剂盒、DAB试剂盒(Vector,美国),RIPA裂解液、PMSF(大连美仑生物技术有限公司,中国),BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司,中国),磷酸酶抑制剂(普利莱基因技术有限公司,中国)。
1.2 方法
1.2.1小鼠辐射模型建立及取材
健康C57BL/6J小鼠14只,21日龄,SPF级,饲养环境温度为(25±0.5)℃,相对湿度为(60±1)%,自由进食水。小鼠随机分为假照射组、5 Gy照射组。照射时,将小鼠置入有机玻璃盒内,不含金属物质,照射组以5 Gy的剂量(剂量率:4.23 Gy/min)进行全身X射线急性照射,源头到动物的距离是100 cm。于照射后第7天,戊巴比妥钠麻醉,取血,处死动物并取材。实验经过长江大学医学部伦理委员会审核,均遵守实验动物饲养和使用原则。
1.2.2小鼠体重及脏器指数测定
称取小鼠的体重,以戊巴比妥钠80 mg/kg麻醉后处死动物,立即解剖将其脾脏取出,用吸水纸吸去污血,置于电子分析天平上称量脾脏重量(mg),计算脾脏指数,脾脏指数=脾重(mg)/体重(g)×10。
1.2.3小鼠外周血象检测
小鼠摘除眼球采血,加入含有抗凝剂 EDTA-Na 的真空采血管,用全自动血细胞分析仪进行白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)及血红蛋白含量(HGB)的测量。
1.2.4免疫组化检测脾脏中H2AX蛋白含量
将脾脏组织浸泡于4%的甲醛中,24 h后换至30%的蔗糖溶液。沉底后放入液氮速冻,迅速取出用OCT包埋放入冰冻切片机内,冰冻后行连续切片,层厚50 μm。将切好的组织切片用画笔小心移到12孔板中,并分别加入30%的双氧水,室温0.5 h,PBST洗涤,血清室温震荡孵育 2 h,加入H2AX抗体(1∶500),4 ℃摇床过夜,PBST洗涤,二抗室温孵育1 h,PBST洗涤,加入AB液孵育0.5 h,DAB显色。
1.2.5Western蛋白印迹检测脾脏中H2AX蛋白含量
处死小鼠后迅速剥离脾脏,取脾脏准确称重并加入RIPA蛋白裂解液在组织破碎仪中破碎,破碎完成后在冰上静置裂解30 min,12 000 rpm离心20分钟取蛋白上清。蛋白定量变性后进行常规电泳,转膜,封闭后分别加入H2AX抗体(1∶1 000),4 ℃过夜,TBST洗涤,加入相应的辣根过氧化物酶标记二抗,室温1 h,化学发光显色。
1.3 图像分析和统计学方法
免疫组织图片采用Image pro plus软件进行平均光密度分析,WB蛋白条带采用Image J软件进行灰度分析。所有数据使用Prism 6 软件统计分析,以均值±单次测量标准差表示,组间比较用单样本t检验、双因素方差分析F检验及 Bonferroni Post Hoc 检验,p<0.05表示有统计学意义。
2 结果
2.1 各组小鼠生理情况
照射前,各组小鼠健康状况和精神状态良好,饮食饮水正常;进行照射及假照射处理7天后,相比于对照组,照射组小鼠毛色黯淡,毛较为稀疏,精神不振。
2.2 电离辐射对小鼠脾脏的影响
与对照组相比,出生21天小鼠,经5 Gy照射7天后,脾脏体积显著减小(图1),体重及脾脏重量显著下降(p<0.01,p<0.01),脾脏指数未见明显改变(p>0.05)(表1)。

C—对照组小鼠脾脏;IR—照后7天小鼠脾脏。图1 脾脏形态学变化Fig.1 Morphological changes of spleen
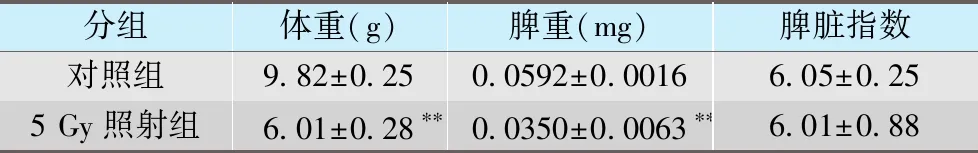
表1 辐射对小鼠体重、脾重、脾脏指数影响Tab.1 Effects of radiation on body weight,spleen weight and spleen indicators in mice
2.3 电离辐射对小鼠外周血象的影响
与对照组相比,出生21天小鼠,经5 Gy照射后,WBC(p<0.01)、PLT(p<0.05)、RBC(p<0.01)以及HGB含量(p<0.01)均有显著降低(表2)。

表2 辐射对小鼠白细胞计数、红细胞计数、血小板计数及血红蛋白含量的影响Tab.2 Effects of radiation on WBC,RBC,PLT and HGB content in mice
2.4 电离辐射对小鼠脾脏H2AX蛋白表达的影响
图2为照后小鼠免疫组化及Western Blotting实验检测结果。如图2所示,与对照组相比,出生21天小鼠,经5 Gy照射后,通过免疫组化及Western Blotting实验检测均显示脾脏H2AX蛋白磷酸化表达显著降低(p<0.05,p<0.01)。
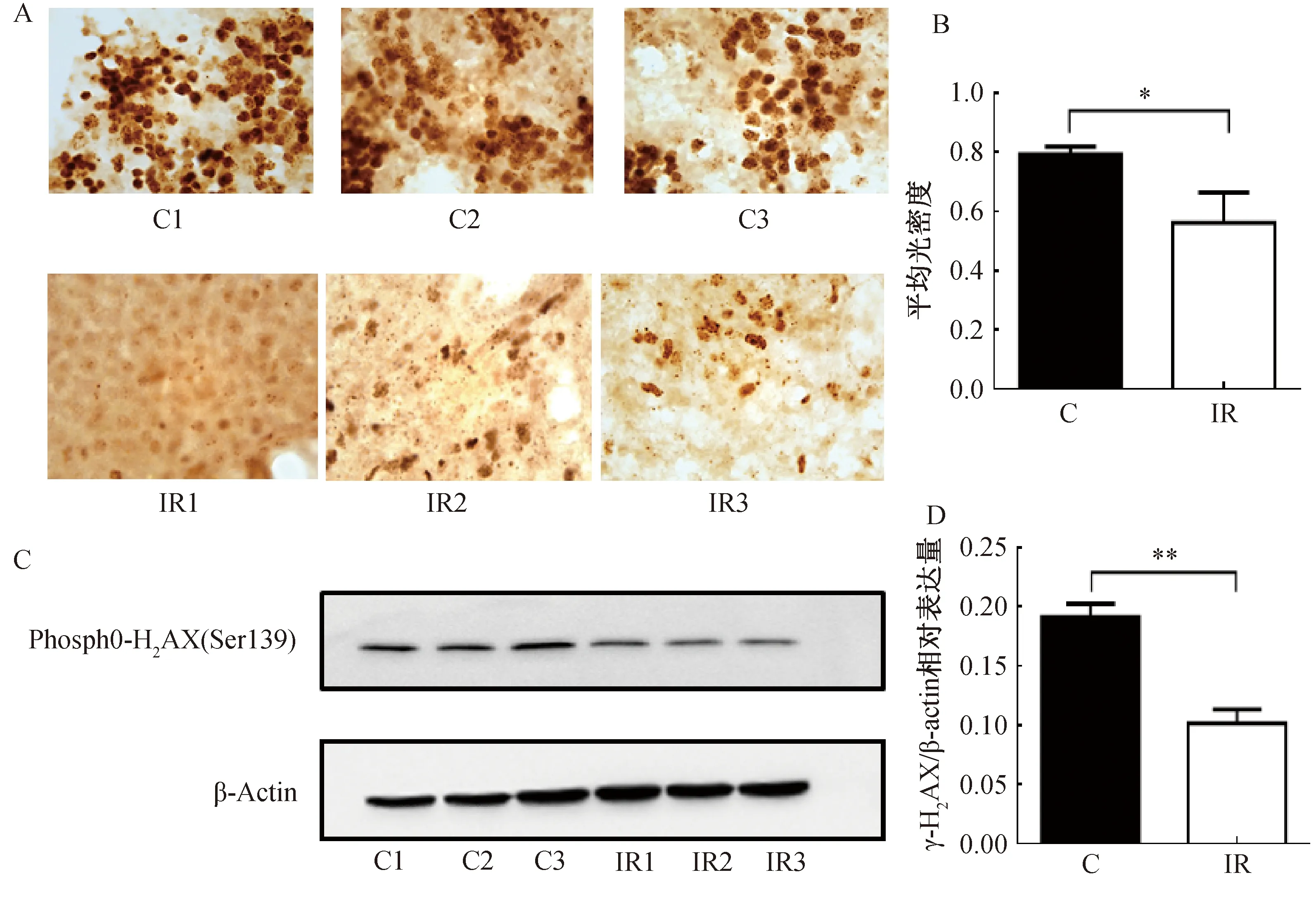
A:免疫组化检测phospho-H2AX表达(×100);B:光密度分析phospho-H2AX表达;C:Western Blotting检测phospho-H2AX表达;D:灰度分析phospho-H2AX表达。*与对照组相比,p<0.05;**与对照组相比,p<0.01。n=7。C为对照组,IR为照射组。图2 辐射对小鼠脾脏H2AX磷酸化蛋白表达的影响Fig.2 Effect of radiation on the expression of H2AX phosphorylated protein in mouse spleen
3 讨论
5 Gy的辐射剂量对啮齿动物的影响相当于对人类为1.67 Gy或为轻度辐射(辐射对人类和啮齿类动物的影响系数为3.0)[10]。目前对脾脏造成影响的辐射剂量集中在3~10 Gy[5-6,11],本研究暴露剂量属于常见范围。
啮齿类动物脾脏在出生后1~4周没有明显的血管结构,14天左右才逐渐发挥免疫作用,3月龄前生长快速,发育成熟之后虽可继续生长,但变化不明显[12]。因此,发育期脾脏经历了较长时间的生长,逐步形成组织和功能,特别容易受到不良因素的损伤。本研究采用刚断乳小鼠(21天)为研究对象,其脾脏还处于生长成熟阶段,观察X射线辐射对其影响。结果发现,小鼠的体重、脾重及脾脏大小显著降低,脾指数未见明显改变。此结果与Miao等[13]实验中小鼠的体重改变一致,但众多成年动物暴露类似剂量中脾脏指数均降低[14-16]。分析可能由于幼年期处于动物生长发育关键期,对不良外源环境尤为敏感,因此辐射暴露不仅仅表现为小鼠脾脏发育,还抑制小鼠整体发育。
脾脏生长发育及其功能正常与否直接影响动物机体免疫功能和造血能力,此前研究发现成年小鼠受到辐射后会使造血功能受到较大损害,在照射后7天,小鼠的血小板、白细胞及红细胞下降至最低点,此后机体的造血功能开始恢复[17]。在本研究中各类血细胞含量均降低,与该研究结果一致。其主要机制推测可能与氧化应激[18]和促进脾脏细胞凋亡有关[19]。
辐射致损伤的主要靶点为DSB,H2AX磷酸化是DSB的早期反应,可导致受损部位的结构改变,其关键作用是保留修复部位,从而启动DNA修复机制[20]。因此,H2AX磷酸化修饰改变不仅可以用于体现DNA损伤的水平,还可以用于评估DNA修复能力的变化。有研究表明H2AX缺乏症会增加未修复的DSB和易位的数量[21]。Urbain等人的研究也证实H2AX缺乏将导致小鼠出现氧化还原功能受损[22]。当DNA损伤无法及时修复时,机体就会启动凋亡程序。Yang等人研究发现,辐射可以促进骨肉瘤细胞H2AX的表达,而miR-328-3p可以抑制辐射诱导的H2AX的表达并促进细胞凋亡,敲除H2AX后,2 Gy照射增加肉瘤细胞的凋亡[23]。本实验发现电离辐射暴露可降低21日龄小鼠脾脏H2AX磷酸化的表达,进而影响小鼠脾脏生长及其造血功能,推测,其机制可能为辐射降低H2AX磷酸化蛋白表达,抑制辐射对DNA损伤修复,从而激活凋亡相关通路,随后促进凋亡。
综上所述,本研究发现H2AX介导了电离辐射对断乳期小鼠脾脏发育及造血功能的抑制,其机制可能通过抑制H2AX磷酸化表达,进而影响脾脏DNA的修复能力有关。然而,本研究并未直接证实脾脏细胞DNA修复能力受损,且未比较成年与幼年小鼠H2AX影响的不同,其深层次的机制还有待进一步研究。
