瘙痒的神经免疫学进展
2021-11-27谢鑫阳敖穗婷王芳
谢鑫阳, 敖穗婷, 王芳
中山大学附属第一医院皮肤科,广东 广州 510080
瘙痒最早的定义见于1660年,它被认为是一种令人想去搔抓的不愉快感觉。根据临床病程,瘙痒可分为急性瘙痒和慢性瘙痒。急性瘙痒是一种保护性机制,在日常生活中十分普遍,如蚊虫叮咬、接触羽毛纤维等。当瘙痒现象持续达到甚至超过6周时则被称为慢性瘙痒[1]。慢性瘙痒是一种病态现象,与多种疾病密切相关。因常引起失眠、焦虑等问题,慢性瘙痒给患者的生活质量带来了极大的负面影响。然而,瘙痒至今缺乏被批准的治疗药物,因此,研究瘙痒尤其是慢性瘙痒的发生机制并找到可能的干预靶点是科研工作者和临床医生普遍关心的问题。
随着瘙痒特异性通路的发现,免疫反应与瘙痒神经通路之间的关联被逐渐揭示,因此产生了新兴研究领域——瘙痒神经免疫学。近十余年来,瘙痒神经免疫研究领域不断出现突破性进展,揭示了皮肤免疫细胞释放的细胞因子可直接激活感觉神经元介导瘙痒[2]。基于这些研究进展,一些新型神经免疫靶向干预策略正逐步应用于瘙痒治疗。
1 慢性瘙痒疾病分类
2007年国际瘙痒研究论坛(international forum for the study of itch, IFSI)根据慢性瘙痒的病因将其分为以下6型[1]:①皮肤病型:如炎症性皮肤病(特应性皮炎、接触性皮炎、荨麻疹、银屑病等)、感染性皮肤病(毛囊炎、疥疮、单纯疱疹等)和肿瘤性皮肤病(皮肤T细胞淋巴瘤)等;②系统型:如慢性肾功能衰竭、原发性胆汁性肝硬化、甲状腺功能亢进、霍奇金淋巴瘤、副肿瘤性瘙痒和药物性瘙痒等;③神经源型:由器质性神经损伤、压迫等引起;④精神病型:精神和心身疾病、躯体性瘙痒、妄想症等;⑤混合型:不止一种疾病引起的瘙痒;⑥不明原因型。将慢性瘙痒从病因角度进行分类,有利于为慢性瘙痒的诊断提供方向,从而制定相应检查和治疗方案。
2 瘙痒的神经信号通路
瘙痒曾经被认为是一种轻微的疼痛,相关的强度理论指出对同一组神经元的弱激活和强激活分别产生瘙痒和痛觉。之后有实验证明人体内的一类C纤维接受组胺刺激后可引起瘙痒,却无法被机械刺激和热刺激激活,提示可能存在独特的瘙痒特异性传导通路[3]。2007年随着第一个独立于疼痛的瘙痒特异性受体胃泌素释放肽受体(gastrin-releasing peptide receptor, GRPR)在神经元的发现,瘙痒特异性感觉神经通路才被逐渐揭示和勾勒出来[4]。
皮肤是抵御外界环境刺激的第一道屏障,由初级感觉神经元支配。初级感觉神经元位于背根神经节(dorsal root ganglia, DRG),其结构为假单极神经元,胞体发出一个轴突投射至中枢神经脊髓,另一个轴突则投射至皮肤,并在表皮形成分支的游离神经末梢。瘙痒感觉信号始于皮肤,初级感觉神经末梢通过致痒因子受体识别外周致痒因子(pruritogen),进而引起感觉神经元离子通道如瞬时受体电位阳离子通道(transient receptor potential cation channel, TRP)V1、TRPA1等开放,从而导致神经元细胞膜去极化,最终产生动作电位[5]。瘙痒信号因此能够从外周向中枢进行传递:首先由初级感觉神经元传导至脊髓背角神经元,进而传递至大脑皮层,并在大脑皮层被感知。
外周感觉神经元表达Mas相关G蛋白偶联受体家族(Mas-related G protein-coupled receptor, MRGPR)是神经免疫学上一项开创性进展[6],该家族由人类的8个基因和小鼠的27个基因组成,其中多个成员已被证明可以介导瘙痒信号,如MrgprA3、MrgprD和MrgprC11[6-7]。小鼠MrgprA3介导氯喹引发的瘙痒,其瘙痒信号传递依赖于脊髓中的GRPR。在人类中,氯喹可以激活与MrgprA3具有相似序列的MRGPRX1[7]。MrgprC11介导牛肾上腺髓质肽(bovine adrenal medulla peptide, BAM)8-22产生的瘙痒,MrgprC11与MrgprA3在相同的感觉神经元亚群上共表达,它们下游均依赖TRPA1传递信号[7-8]。与MrgprA3和MrgprC11表达的感觉神经元不同,MrgprD阳性神经元主要传导β-丙氨酸引发的瘙痒信号。鉴于MRGPR家族与瘙痒密切相关,探究其在瘙痒性疾病中作用机制的基础研究及转化医学研究是目前较为活跃的研究领域。
瘙痒感觉神经元异质性近年也有较大进展。单细胞转录组测序技术(single-cell RNA sequencing, scRNA-seq)可将DRG感觉神经元根据特定受体和标志进行分类。Usoskin等[9]以2015年首次报道的经典分类为例,阐述各种感觉神经元与致痒因子和瘙痒信号通路之间的关系。DRG神经元根据是否有神经肽RNA水平的高表达分为肽能(peptidergic, PEP)神经元和非肽能(nonpeptidergic, NP)神经元。PEP神经元分泌多种神经肽,如:降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、P物质(substance P, SP)和血管活性肠肽(vasoactive intestinal peptide, VIP)等,神经肽可作用于相关组织引起组织器官功能和结构改变。NP神经元虽然神经肽基因表达水平较低,但也具备一定的分泌神经肽的能力。大部分传导瘙痒信号的神经元为NP神经元。NP瘙痒神经元根据受体表达的异质性可进一步被划分为3个亚群:NP1、NP2和NP3。NP1神经元表达MrgprD而不表达TRPV1,NP2神经元表达MrgprA3、MrgprC11、TRPV1和组胺1受体(Hrh1)等,NP3神经元高表达Hrh1、5-羟色胺受体、白三烯受体和IL-31受体等。值得注意的是,NP3神经元表达脑钠肽(brain natriuretic peptide, BNP)。作为神经肽的一种,BNP可将NP3介导的瘙痒信号进一步向脊髓传递[10]。神经肽胃泌素释放肽(gastrin-releasing peptide, GRP)是一个重要的瘙痒相关神经肽,通过脊髓内的GRP-GRPR回路将瘙痒信号从外周传递至中枢神经系统[4],然而目前,关于DRG神经元与GRP-GRPR回路之间的中间信号的传递尚不完全清楚[11]。总的来说,对瘙痒神经元的分类明确了各类NP神经元对其特定致痒原的识别,然而,各种瘙痒信号通路如何从外周进一步传递至脊髓尚需进一步研究。
3 2型免疫反应与瘙痒信号传导
免疫反应根据效应细胞和炎症因子的不同,可分为1型、2型和17型免疫反应。其中,2型免疫反应与瘙痒关系密切(图1)。2型免疫反应相关细胞主要包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、2型辅助性T细胞(T-helper 2, Th2)和2型固有淋巴样细胞(2 innate lymphoid cell, ILC-2)等;炎症因子主要有IL-4、IL-13和IL-31等。
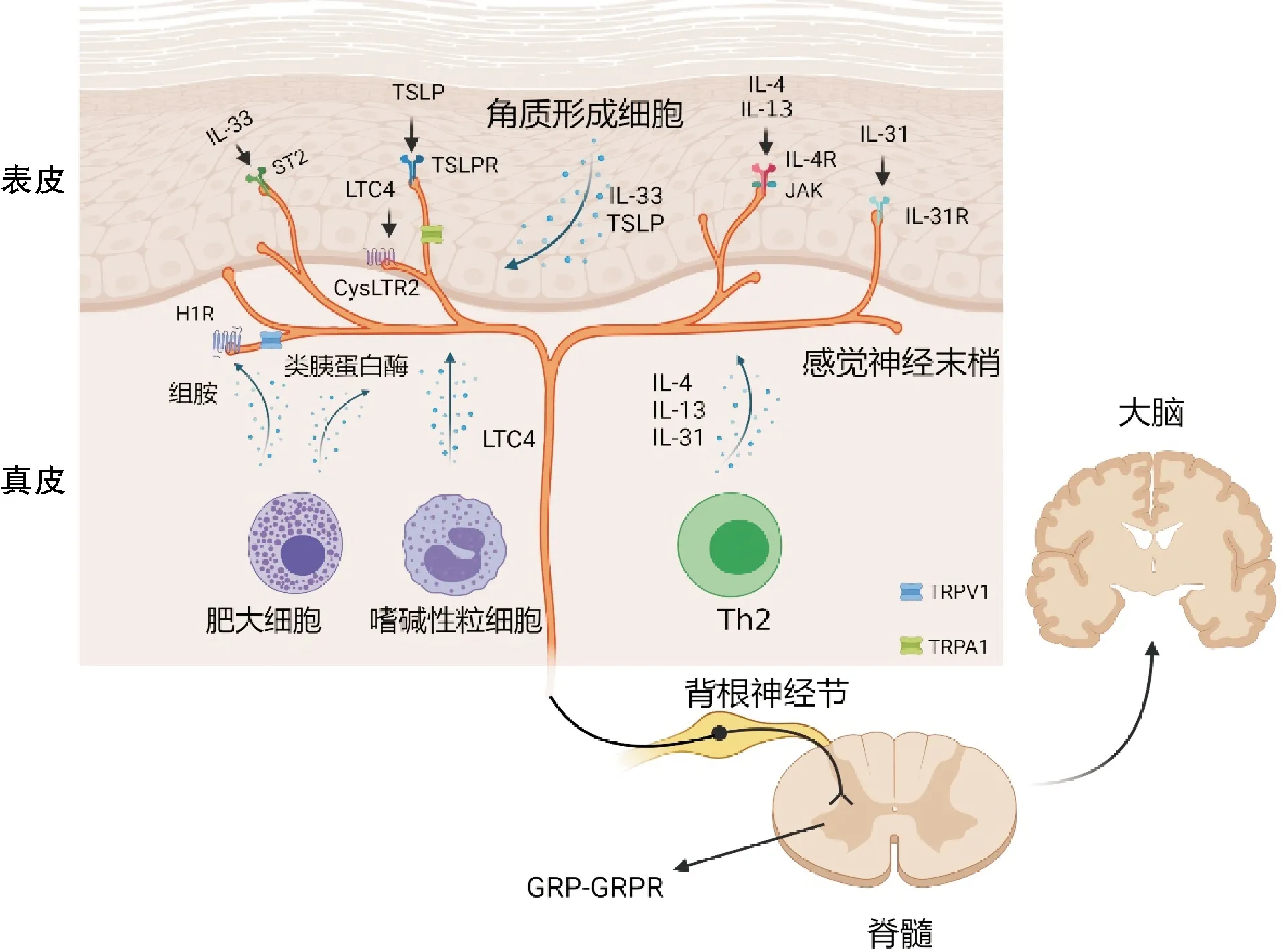
图1 2型免疫反应与瘙痒信号通路关系示意图:2型免疫细胞和表皮角质形成细胞释放致痒因子被外周感觉神经末梢上相应受体识别后,引起动作电位,进而将瘙痒信号向脊髓和大脑传递,最终在大脑皮层被感知。CysLTR2:半胱氨酰白三烯受体2;GRP-GRPR:胃泌素释放肽-受体回路;JAK:Janus激酶;LTC4:白三烯C4;TRP:瞬时受体电位阳离子通道;TSLP:胸腺基质淋巴生成素(作图工具为Biorender网站:https://biorender.com)
3.1 肥大细胞
肥大细胞是皮肤和其他粘膜屏障的常驻免疫细胞,在解剖学上和感觉神经末梢非常贴近。活化后的肥大细胞可迅速释放组胺等多种致痒因子,进而激活感觉神经元上的相应受体引起瘙痒。因此,肥大细胞-组胺通路被认为是瘙痒神经免疫学的经典通路[12]。目前已经发现,组胺共有4种受体,均为G蛋白偶联受体(G protein-coupled receptors, GPCRs):H1R到H4R。其中,DRG感觉神经元上表达H1R和H4R。组胺通过激活H1R引起TRPV1开放,进而触发感觉神经元的动作电位,引发瘙痒感觉[13]。因此,组胺引起的瘙痒是经典的TRPV1依赖性瘙痒。然而阻断H1R的抗组胺药物对荨麻疹以外的多数瘙痒性疾病的疗效普遍欠佳[14],提示存在其他非组胺依赖性瘙痒信号通路(图2)。
肥大细胞可被物理、化学等多种因素激活,其中以变应原特异性IgE激活通路最为经典,该通路也是引发瘙痒的经典通路之一。IgE可预先结合于肥大细胞表面的高亲和力受体FcεRI,当变应原再次出现并与IgE结合时,IgE发生交联,进而诱导肥大细胞迅速脱颗粒,并释放多种效应分子。其中组胺、5-羟色胺、类胰蛋白酶、白三烯和前列腺素等均可直接引起瘙痒[12]。除经典的IgE激活通路外,近年来发现一条新的Mrgpr依赖性肥大细胞瘙痒通路。与Mrgpr家族的其他成员不同,MrgprB2并非表达于神经元,而是表达于小鼠的肥大细胞[15]。最新研究[16]证明MrgprB2可被多种物质激活,肾上腺髓质素前体多肽(proadrenomedullin peptide, PAMP)9-20作为配体之一,可直接激活MrgprB2引发小鼠肥大细胞脱颗粒。与组胺不同,MrgprB2激活后,肥大细胞将释放大量类胰蛋白酶和少量组胺。该发现与疾病的联系在于,PAMP在变态反应性接触性皮炎(allergic contact dermatitis, ACD)患者角质形成细胞中高度表达,而ACD小鼠模型证实,ACD引起的瘙痒依赖于MrgprB2而非IgE。MrgprB2的发现不仅揭示了一条新的肥大细胞激活通路,也解释了疾病接触性皮炎瘙痒的部分原因。人类MRGPRX2与小鼠MrgprB2同源,MRGPRX2同样表达于人肥大细胞上,许多外源性物质和内源性多肽如抗菌肽β-防御素、葡萄球菌δ-毒素等均可通过MRGPRX2激活肥大细胞[17-18]。且已发现,在特应性皮炎(atopic dermatitis, AD)和银屑病患者的瘙痒性皮疹中,MRGPRX2 mRNA表达增加[19]。预示着MRGPRX2可能成为治疗瘙痒的新靶点[20]。
3.2 嗜碱性粒细胞
嗜碱性粒细胞与包括AD、荨麻疹、哮喘和食物过敏在内的多种过敏性疾病有关。与肥大细胞类似,嗜碱性粒细胞表面同样表达IgE的高亲和力受体FcεRI[21],也同样能够释放多种炎症介质如组胺、白三烯、IL-4和IL-13等。与肥大细胞常驻皮肤的特点不同,嗜碱性粒细胞常驻血液循环中,在皮肤炎症时可向皮肤组织迅速趋化。尽管如此,嗜碱性粒细胞和瘙痒的关系却从未得到证明。通过对中重度AD患者的每日瘙痒数据分析,发现部分患者具有长期慢性瘙痒基础上突然加重的急性瘙痒症状,而且这种现象在过敏原特异性IgE阳性患者中的发生率更高。然而,有趣的是,在动物实验中发现:这种突然加重的瘙痒虽然具有IgE依赖性,却并不依赖肥大细胞,而是依赖血液中的嗜碱性粒细胞。不仅如此,过敏原刺激后的嗜碱性粒细胞通过释放白三烯(leukotriene, LT)C4与感觉神经元上的半胱氨酰白三烯受体2结合,并进一步互补性依赖TRPV1和TRPA1传递瘙痒信号[22]。该瘙痒模式的发现提示目前临床工作中应用的瘙痒评价系统可能需要一定改进。同时,透彻的机制剖析不仅首次证明了嗜碱性粒细胞和瘙痒的关系,也意味着白三烯C4神经免疫通路可能成为AD瘙痒干预的新靶点(图2)。

图2 2型免疫反应靶向药物作用靶点机制图 CPUO:原因不明的慢性瘙痒;PN:结节性痒疹(作图工具为Biorender网站:https://biorender.com)
3.3 经典2型细胞因子
许多2型炎症主导的皮肤病都具有长期、反复、慢性的瘙痒特点。在众多2型炎症因子中,IL-31 是第一个被发现可直接致痒的2型炎症因子[23]。IL-31在AD和结节性痒疹(prurigo nodularis, PN)皮损组织中均有高表达。IL-31在感觉神经元上的受体为IL-31RA和OSMRβ组成的二聚体,IL-31可通过结合其受体直接激活感觉神经元引发瘙痒。与白三烯C4互补性依赖TRPV1和TRPA1不同,IL-31瘙痒信号的传导虽然也同时依赖TRPV1和TRPA1,但抑制其中任何一种离子通道均可减轻IL-31诱发性瘙痒[24]。Nemolizumab是一种针对IL-31受体亚单位(IL-31RA)的单克隆抗体,临床试验已经证明了其对AD有良好的止痒效果[25],加之最近一项二期临床试验证明nemolizumab对PN也具有良好的疗效[26],因此,IL-31是一个值得期待的瘙痒阻断靶点。
2017年,一项研究发现2型细胞因子IL-4和IL-13可以直接刺激感觉神经元上的受体IL-4Rα促进瘙痒,而且IL-4可增强感觉神经元对其他致痒因子如组胺、IL-31等的反应[27]。Dupilumab是针对IL-4Rα的单克隆抗体,在治疗AD及其他慢性瘙痒疾病中体现出了非常好的疗效[28]。两种抗IL-13单克隆抗体tralokinumab和lebrikizumab,同样在治疗AD的二期临床试验中显示出对瘙痒有较好的疗效[29-30]。因此,IL-4和IL-13是否可能成为其他瘙痒性疾病的治疗靶点值得进一步观察。2型细胞因子依赖JAK-STAT信号通路进行信号传递,IL-4Rα介导的瘙痒神经信号同样依赖下游的JAK激酶[27]。目前,外用的JAK抑制剂tofacitinib已被证实可明显减轻AD和银屑病患者的瘙痒[31],而口服JAK抑制剂(如upadacitinib、tofacitinib和abrocitinib)也在AD和原因不明的慢性瘙痒中显示出良好的止痒效果[32-34](图2)。因此,JAK抑制剂可能是炎症因子单克隆抗体之外又一治疗瘙痒的有力武器。
3.4 表皮因子
“瘙痒-搔抓循环”被认为是加重瘙痒和皮肤病的重要因素,而其中的科学机制却到近10年才被逐步解析。表皮角质形成细胞受到刺激后可以产生各种表皮因子如胸腺基质淋巴生成素(thymic stromal lymphopoietin, TSLP)和IL-33等,它们可激活2型免疫细胞,促进2型细胞因子的释放,进一步扩大2型炎症效应。2013年,Wilson等[35]研究显示感觉神经元表面存在TSLP受体TSLPR,TSLP可通过结合TSLPR直接激活感觉神经元引发瘙痒。接着,在一项过敏性接触性皮炎的研究中,小鼠模型研究表明,IL-33通过ST2直接刺激感觉神经元加重原有皮肤炎症引起的瘙痒[36]。临床试验中,虽然抗TSLP单克隆抗体tezepelumab在治疗AD的2期临床试验中疗效一般[37],但是否对其他瘙痒性疾病有治疗效果却未可知。抗IL-33单克隆抗体etokimab在AD的2期临床试验中显示出积极的疗效[38],但是否能获批上市仍需进一步临床试验。
4 结语
综上,无论是神经传导,还是免疫细胞和炎症因子,瘙痒神经免疫学均有一定的发现,为生物靶向制剂治疗瘙痒提供了依据。然而,瘙痒神经免疫却仍有很多悬而未决的问题,比如:IL-4和IL-13作为促进慢性瘙痒的关键2型炎症因子,它们的主要细胞来源是什么?敲除嗜碱性粒细胞似乎不能减轻慢性瘙痒,提示可能有其他细胞成为IL-4、IL-13的主要来源。银屑病作为1型/17型炎症反应主导的疾病,瘙痒发生率约70%,其神经免疫学机制是什么?角质形成细胞同样有多种炎症因子受体的表达,它在瘙痒机制中的作用是否仅限于分泌表皮因子呢?以上诸多问题仍需进一步的科学研究来回答和证实。未来研究也将不仅限于免疫反应对感觉神经的致痒效应,而且扩展至研究感觉神经对免疫系统的反作用上。交叉学科的思维碰撞必将带来更加显著的科学进步,我们坚信,不久的将来,皮肤病研究将有更多神经免疫学机制的新发现!
