基于术前NLR及PNI的胰腺癌根治术预后预测模型的构建及评价
2021-11-26邵全年周辉年肖竞英李向阳郭亚柴春焦作义
邵全年,周辉年,肖竞英,李向阳,郭亚,柴春,焦作义
兰州大学第二医院普通外科,兰州 730030
胰腺癌(pancreatic cancer,PC)是常见的消化系统恶性肿瘤,具有起病隐匿、恶性程度高、侵袭性强和预后差等特点[1],其中以胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)最为常见[2-4]。美国癌症中心的最新统计数据显示,胰腺癌5年生存率仅为10%[5]。手术切除是唯一可能的治愈方法,但即使对于病理类型和临床病理分期相同的患者,其术后预后结局也有很大差异,这是由患者相关因素如炎症反应、免疫状况及营养情况等的差异造成的[6-7]。Virchow于1863年首次提出炎症过程是肿瘤发展的诱发条件之一,肿瘤发展被描述为“脱离‘正常’的炎症增生”,随后大量研究证实,炎症在多种恶性肿瘤的发生和预后中起着至关重要的作用[8-9]。多项研究发现,中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)与消化系统恶性肿瘤有关,如结肠癌、胃癌、肝癌等[10-11],NLR升高常提示恶性肿瘤预后不良。营养不良也会影响癌症患者的疾病进展和生存,预后营养指数(prognostic nutritional index,PNI)是评估恶性肿瘤患者术后营养状况的指标,有研究证实其与小细胞肺癌、肝癌、头颈部癌、胃肠癌等恶性肿瘤的预后关系密切[12-13]。为此,本研究分析了影响PDAC根治术后患者生存率的危险因素,构建PDAC根治术后1、2、3年生存率的nomogram临床预测模型并进行效能评价,同时建立网页计算器,以期为临床医师个体化治疗提供方案,使患者获益。
1 资料与方法
1.1 研究对象 以“胰腺恶性肿瘤”和“胰腺癌”为关键词,检索兰州大学第二医院病案系统,回顾性收集2013年1月-2019年12月诊断为胰腺恶性肿瘤、行根治性手术并经术后病理证实为PDAC患者的临床资料。纳入标准:(1)行根治性手术治疗;(2)病理诊断为PDAC;(3)无其他恶性肿瘤病史;(4)无远处转移或其他部位来源的肿瘤侵袭;(5)临床病理资料完整。排除标准:(1)组织学诊断为非PDAC,如多形性癌、黏液癌、腺泡细胞癌等;(2)术后发生严重并发症致生存时间<30 d;(3)有血液病和炎症性疾病的感染证据或病史,影响血常规结果;(4)随访资料缺失。共检索出185例患者,排除病理诊断为非PDAC 18例、术后发生严重并发症致生存时间<30 d 5例和失访14例,最终148例纳入本研究。
1.2 资料收集 收集患者的性别,年龄,身高,体重,术前7 d 内的血常规(中性粒细胞和淋巴细胞绝对值计数)、血清白蛋白及肿瘤标志物甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)125和CA19-9结果,手术方式,术中肿瘤位置、出血量,术后病理报告(含肿瘤大小、病理类型、肿瘤分期、肿瘤分化程度、手术切缘、有无血管和神经侵犯等),术后有无化疗,术后并发症等资料。
1.3 术后随访 采用电话随访、复查病例、门诊随访等方式,前2年每3个月随访1次,第3~5年每6个月随访1次,以后每年随访1次直至患者死亡或失访,随访内容包括进行临床和实验室检查。随访至2019年12月30日。
1.4 数据分析 计算148例患者NLR及PNI的最佳截断值;分析NLRP评分与PDAC患者临床病理特征的关系,以及PDAC根治术后患者预后影响因素;基于Cox回归分析结果,构建预测PDAC根治术后1、2、3年生存率的nomogram模型,对模型进行效能评价,并建立网页计算器。
1.5 统计学处理 使用X-tile软件计算NLR和PNI的最佳截断值,采用SPSS 25.0软件进行统计分析,使用Kaplan-Meier法(K-M法)进行生存分析,生存率差异的比较采用log-rank检验,单因素及多因素分析采用Cox比例风险回归模型,同时计算风险比(HR)和95%CI。分类变量以例(%)表示,组间比较采用χ2检验或Fisher精确概率检验,连续变量比较采用t检验或Mann-WhitneyU检验。使用GraphPad Prism 8.0及R 4.0.3软件(主要用于绘制nomgram)绘图,用bootstrap法对预测模型进行内部验证,计算一致性及区分度,通过决策曲线分析评价临床获益度。P<0.05为差异有统计学意义。
2 结 果
2.1 PDAC患者的临床病理特征及生存分析 共纳入148例PDAC患者,其中男89例(60.1%),女59例(39.9%),年龄(57.8±9.18)岁。术前无淋巴结转移94例(63.5%),TNM分期Ⅰ-Ⅱ期92例(62.2%),低分化腺癌9 7 例(6 5.5%),术后发生胰漏3 2 例(21.6%)。中位生存时间18.2个月,术后1、2、3年生存率分别为70.8%、35.8%、12.2%。其余临床病理特征如表1所示。
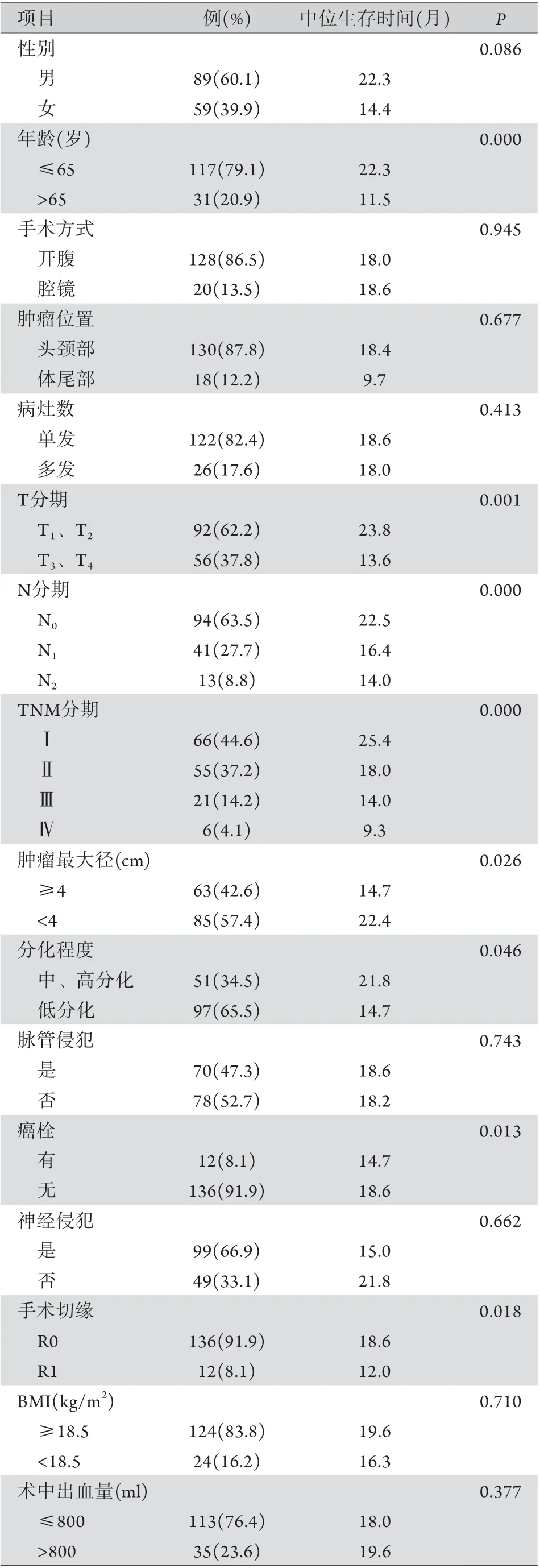
表1 PDAC患者的临床病理特征及生存分析(n=148)Tab.1 Clinicopathological characteristics and survival analysis of PDAC patients (n=148)

(续 表)

(续 表)
2.2 NLR及PNI的最佳截断值 使用X-tile软件计算NLR及PLR的最佳截断值(基本原理为通过K-M生存分析,行log-rank检验,使用枚举法,确定P值最小的结果即为最佳截断值),分别为1.85和44.13(图1)。依据最佳截断值将PDAC患者各分为两组:NLR<1.85组30例(20.3%)与NLR≥1.85组118例(79.7%);PNI<44.13组54例(36.5%)与PNI≥44.13组94例(63.5%)。
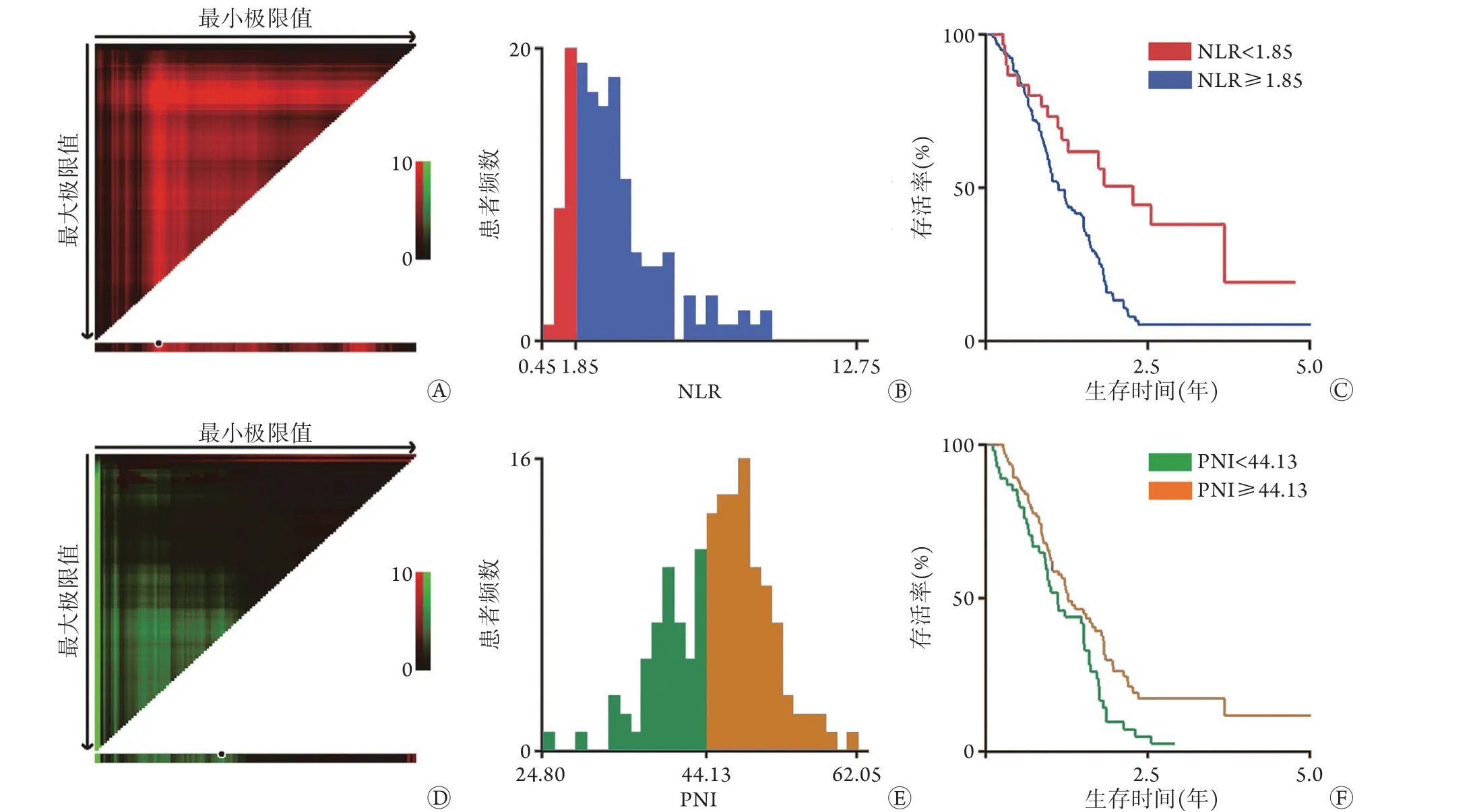
图1 X-tile软件计算NLR及PNI的最佳截断值Fig.1 The best cut-off value of NLR and PNI calculated by X-tile software
2.3 NLR P评分与PDAC患者临床病理特征的关系 结合NLR及PNI的截断值,构建NLRP评分:NLR<1.85且PNI≥44.13记0分,NLR≥1.85或PNI<44.13记1分,NLR≥1.85且PNI<44.13记2分。依据NLRP评分将患者分为NLRP 0分组[23例(15.5%)]、NLRP 1分组[78例(52.7%)]与NLRP 2分组[47例(31.8%)],各组中位生存时间分别为33.7、18.2、14.7个月,NLRP评分越高患者预后越差(P<0.05)。不同NLRP评分患者在肿瘤部位、N分期、体重指数(BMI)、术后胰漏(ISGPF B/C)、腹腔感染、术前血清白蛋白(ALB)、总胆红素(TB)、癌胚抗原(CEA)等方面差异有统计学意义(P<0.05,表2)。

表2 NLRP评分与PDAC患者临床病理特征之间的关系[例(%)]Tab.2 Relationship between NLRP score and clinicopathological characteristics of PDAC patients [n(%)]
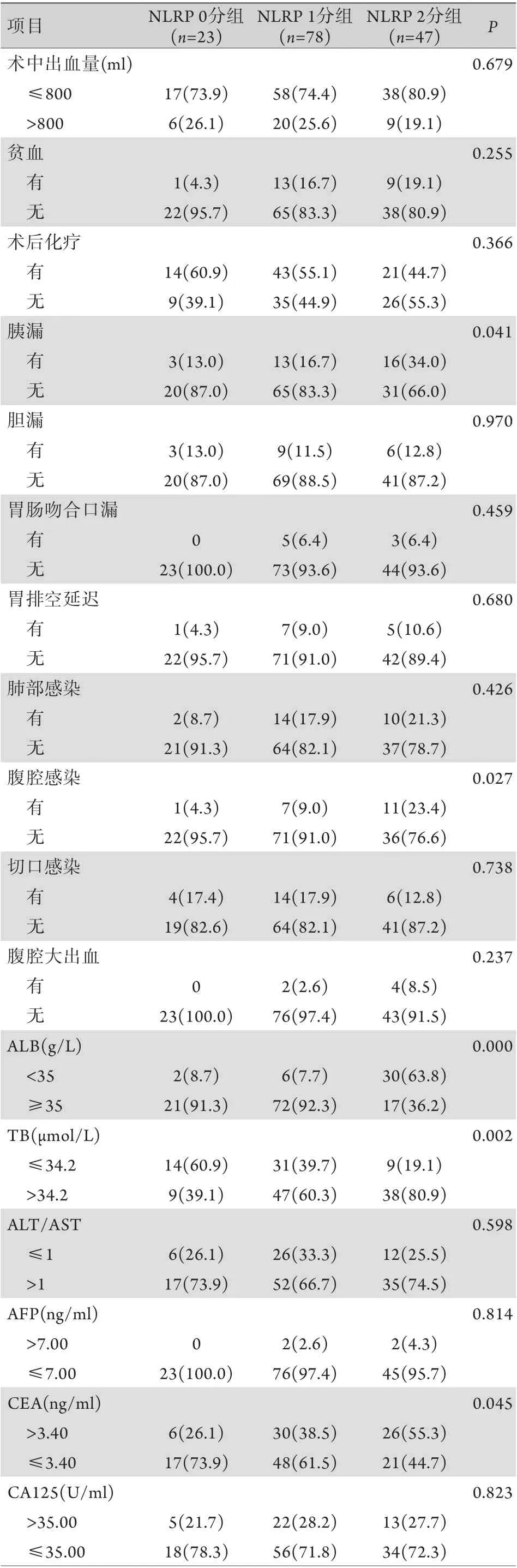
(续 表)
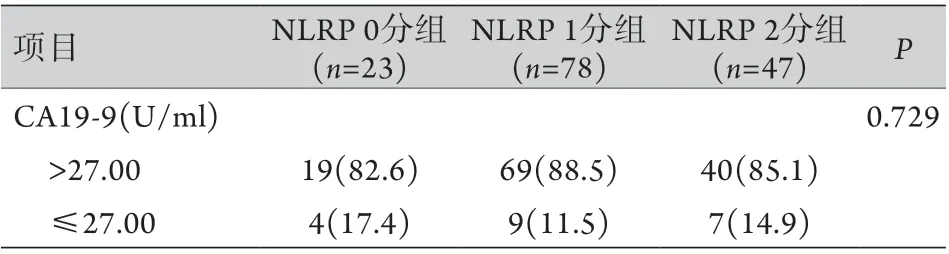
(续 表)
2.4 PDAC根治术后患者预后的影响因素分析使用Cox回归模型对PDAC患者的临床病理特征进行分析,将年龄、性别、TNM分期、NLRP评分等因素纳入单因素生存分析,采用log-rank检验分析差异,结果显示,年龄>65岁、T分期高、N分期高、TNM分期高、R1切除、肿瘤直径≥4 cm、分化程度差、有癌栓、术前NLRP评分高、术后未行化疗、术后胰漏、胆漏是影响胰腺癌术后总生存时间的危险因素(P<0.05,表3)。将上述危险因素纳入多因素生存分析,结果显示,年龄>65岁、N分期高、TNM分期高、术后未行化疗、术后胰漏、NLRP评分高是影响PDAC患者术后总生存时间的独立危险因素(P<0.05,表3)。

表3 PDAC根治术后患者总生存时间的影响因素分析(n=148)Tab.3 Analysis of factors affecting the overall survival time of patients after radical operation of PDAC (n=148)
2.5 PDAC根治术预后预测模型 基于Cox回归分析结果构建的预测PDAC根治术后患者1、2、3年生存概率的nomogram模型见图2。图中变量的每一个数字/类别在分数量表上都有对应的分数。将总分相加,对应在总分标上,直线向下画1/2/3年生存率标,即表示每个时间点的预估生存时间或生存率。

图2 预测PDAC术后1、2、3年生存率的nomogram模型Fig.2 The nomogram for predicting the survival rate of 1, 2, and 3 years after radical operation of PDAC
2.6 Nomogram预测模型效能评价及网页计算器建立
2.6.1 区分度评价 使用R 4.0.3 软件,基于bootstrap重采样法在内部数据集中验证nomogram的预测效能,计算得出C-index为0.710(95%CI 0.652~0.768),提示基于NLRP评分的nomogram预测模型对PDAC根治术后患者1、2、3年生存率具有较强的预测能力。纳入影响PDAC根治术后患者生存率的独立危险因素及nomogram预测模型绘制ROC曲线,结果显示,术后1年nomogram预测ROC曲线下面积(AUC)为0.752,TNM分期AUC为0.605;术后2年nomogram预测AUC为0.815,TNM分期AUC为0.704;术后3年nomogram AUC为0.854,TNM分期AUC为0.714,表明该nomogram预测模型具有良好的精准度和区分度,且术后时间越长预测准确度越高(图3)。
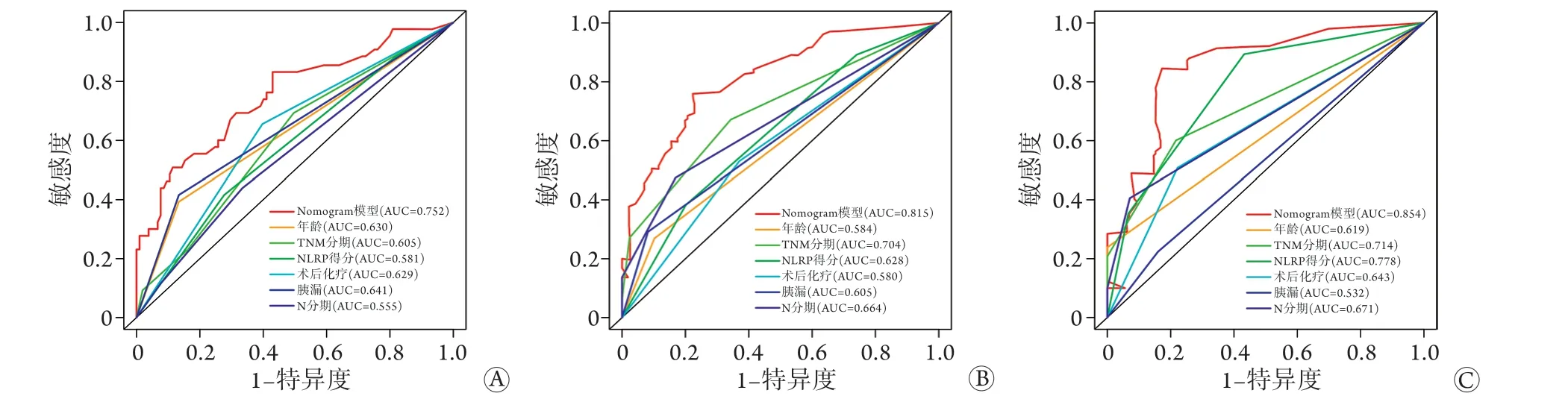
图3 Nomogram模型预测PDAC根治术后生存率各指标的ROC曲线Fig.3 The ROC curve of each factor in the nomogram forecast model for the survival rate of pancreatic cancer after radical resection
2.6.2 一致性分析 使用R 4.0.3软件,运用boot法绘制1、2、3年生存率的校正曲线,结果显示,实际观察到的术后1、2、3年生存率与nomogram预测所得生存率有较好的一致性(图4)。
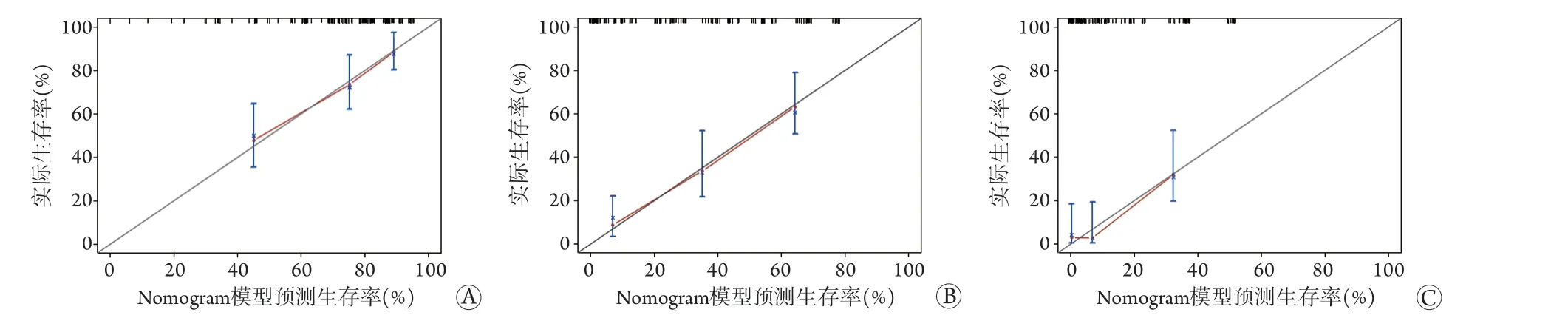
图4 预测PDAC根治术后生存率的nomogram预测模型校准图Fig.4 Calibration chart of the nomogram prediction model for predicting the survival rate of of pancreatic cancer after radical resection
2.6.3 决策曲线(decision curve analysis,DCA)分析 DCA可以显示出预测模型的临床净效益,有色曲线至灰色曲线与横线之间的范围为患者的临床净获益,结果显示,与TNM分期及其他单因素相比,nomogram模型显示了更大范围的阈值概率(0.08~0.96vs. 0.20~0.82)和更广的净收益(图5)。
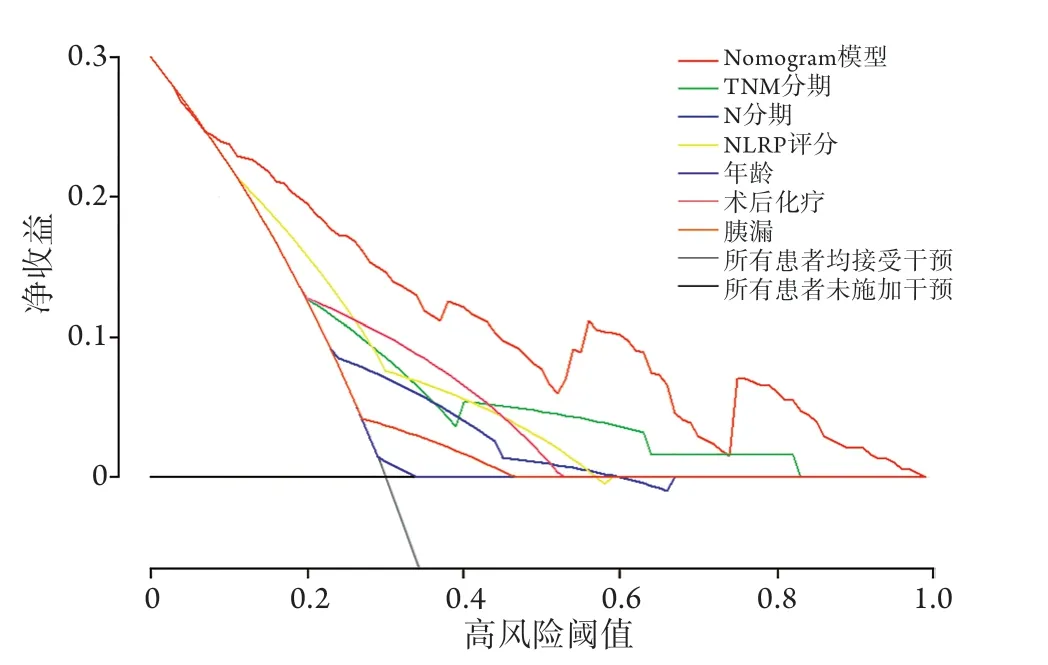
图5 预测PDAC术后1、2、3年生存率nomogram模型的决策曲线Fig.5 The decision curve of the nomogram model for predicting the survival rate of 1, 2, and 3 years after radical resection of PDAC
2.6.4 动态列线图的实现——网页计算器 为进一步增加nomogram的实用性,建立了网页计算器,通过直接访问https://shawnbaby.shinyapps.io/Prognosis_PDAC,可实现图2列线图的动态nomogram呈现。通过输入临床特征和阅读由网络服务器生成的输出数据和表格,可确定患者的预测存活概率。
3 讨 论
胰腺癌在临床中发现时通常已是晚期,仅有约20%的患者可接受根治术治疗,接受手术切除的患者5年生存率为10%~25%,手术仍然是唯一具有治愈潜力的方法[14]。然而,即使病理类型和TNM分期相同的患者,其短期及长期生存率也存在较大差异。有研究发现,癌症的进展不仅是由肿瘤细胞的内在特性引起的,还与宿主的全身和局部刺激密切相关[15],其具体机制目前尚未明确。全身炎症反应与循环白细胞的变化有关,中性粒细胞计数升高可能通过为肿瘤生长提供有利环境而促进癌症的进展[16];全身炎症反应还参与多种细胞因子和趋化因子的释放,在肿瘤侵袭和转移中起着重要作用,这些炎性细胞因子为肿瘤生长、侵袭和转移提供了有利的环境[17-18],表明NLR升高反映了先天免疫应答上调。营养亦与癌症发展密切相关,且在原发性肿瘤切除术后的预后中起着重要作用。作为围术期营养状况的替代指标,PNI已被证实是各种恶性肿瘤术后预后不良和病死率增高的重要预测指标[19]。
目前基于血清学参数形成的实体肿瘤预后评分多以单一指标进行评估,其截断值选取方法大多以ROC曲线为主,但ROC曲线因变量为二分类变量,未考虑生存资料的时间因素,尤其对于胰腺癌,ROC曲线取截断值的方法并不合适[20]。本研究使用X-tile软件取得最佳截断值,综合术前NLR及PLR的最佳截断值形成一个新的预后评分NLRP,结果显示,NLRP评分越高,PDAC根治术后患者中位生存时间越短,相较NLRP 0分患者(33.7个月),NLRP 2分患者预后差(14.7个月)。分析NLRP与PDAC患者临床病理特征的关系发现,NLRP评分不同的患者在肿瘤部位、N分期、BMI、术前ALB、TB、CEA、术后胰漏(ISGPF B/C)、腹腔感染方面存在统计学差异。在单因素分析中,NLRP评分、年龄、TNM分期、肿瘤分化程度、术后化疗、CEA等与患者总生存期有关,且在多因素分析中,NLRP仍为影响PDAC根治术后患者生存率的独立危险因素,表明NLRP评分可以作为一种新的有前途的炎症预后评分方法。
Nomogram是预测和量化患者发生某一临床事件概率的便利工具,对于临床决策和风险分层具有重要价值[21]。本研究纳入Cox回归模型中影响PDAC根治术后患者总生存期的独立危险因素,构建了基于这些因素的nomogram模型,并进行了一致性和区分度评价,结果显示,该nomogram模型具有良好的预测效能,且在PDAC根治术后第1、2、3年多变量ROC曲线分析中,nomogram模型较TNM分期有更大的AUC,表明nomogram模型具有更好的预测能力。在DCA分析中,nomogram模型较TNM分期有更宽的阈值范围和更广的净收益,提示nomogram模型在临床应用中具有良好的准确性和实用性,可使患者获益且有助于临床医师开展个体化治疗。为了方便操作,本研究同时建立了网页计算器,实现nomogram模型的动态化,输入患者相关临床病理特征即可获得对应的存活概率。
本研究仍具有一定局限性:为单中心回顾性研究,存在选择偏倚且样本量较少,所获得NLR及PNI截断值可能不适用于其他同类研究;研究内容局限于PDAC根治术后患者,对不同化疗方案的影响未能进行讨论。
综上所述,NLR和PNI作为一种廉价易得的评价指标,其组合所得NLRP评分可作为PDAC根治性切除术的一个强有力的预后预测指标,同时,包含NLRP评分、年龄、N分期、TNM分期、术后胰漏及术后化疗的nomogram模型是一种良好的预后模型,有助于推动个体化治疗。
