利福昔明联合枯草杆菌二联活菌肠溶胶囊对伴有小肠细菌过度生长的腹泻型IBS的疗效分析
2021-11-26罗哲李超王晓辉李辉李晓伟崔立红
罗哲,李超,王晓辉,李辉,李晓伟,崔立红
解放军总医院第六医学中心消化内科,北京 100048
肠易激综合征(irritable bowel syndrome,IBS)是临床常见的功能性肠病,以腹痛、排便频率改变、大便性状改变为主要症状,排便后腹痛可缓解。我国普通人群IBS总患病率为6.5%,女性略高于男性,中青年更常见[1]。IBS的发病机制目前尚未完全阐明,考虑与多种因素有关[2-3]。小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)指由于器质性或功能性原因引起小肠瘀滞、细菌过度繁殖,造成小肠细菌数量异常升高和(或)菌群种类改变。以往研究发现,包括SIBO在内的肠道微生态失衡是IBS的致病原因[4-5],补充益生菌能改善肠道菌群组成,有效缓解IBS的临床症状[6],对改善SIBO也有一定效果,因此在临床上常使用益生菌制剂治疗IBS[7]。利福昔明是一种仅在肠腔内发挥抗菌作用而不被肠道吸收的抗生素,常用于杀灭肠道内有害菌,治疗SIBO及腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)。有研究认为利福昔明治疗IBS-D是安全、有效的[8],但利福昔明的使用也存在局限性,它能一并杀灭肠道内的益生菌,从而诱发新的菌群失调;作为抗生素,该药若广泛使用可能存在耐药风险;而且该药的价格相对昂贵,给患者造成了一定经济负担。本研究选取伴有SIBO的IBS-D患者,采用利福昔明联合枯草杆菌二联活菌肠溶胶囊进行治疗,观察其治疗效果及血清细胞因子的变化,旨在为该病的合理用药提供参考,并探索利福昔明的合理适应证。
1 资料与方法
1.1 研究对象 选取2018年7月-2019年12月解放军总医院第六医学中心消化内科收治的114例伴有SIBO的IBS-D患者,采用随机数字表法将患者分为益生菌组(n=64)与联合组(n=50)。
1.2 纳入及排除标准 纳入标准:(1)年龄18岁以上,性别不限;(2)经甲烷氢呼气试验证实SIBO阳性;(3)符合罗马Ⅲ标准中的IBS-D诊断标准[9],即诊断前至少出现症状6个月,近3个月满足以下标准:每月至少有3 d伴有反复发作的腹痛或腹部不适,并有2个及以上下列症状:①排便后症状缓解;②排便频率改变;③粪便性状改变,糊状便或水样便(Bristol粪便性状量表中的6型或7型)>75%排便时间,硬便或块状便<25%排便时间。以下症状支持IBS诊断:(1)排便频率异常,即每周≤3次或每天>3次;(2)粪便性状异常,即硬粪、糊样粪或水样粪;(3)排便费力;(4)排便急迫感、不尽感;(5)排出黏液;(6)腹胀。排除标准[10]:(1)近2周曾使用通便或影响胃肠动力的药物;(2)近2周曾使用抗生素或抗精神病类药物;(3)近2周内行结肠气钡造影、结肠镜检查或接受灌肠术;(4)对利福昔明或利福霉素类药物过敏;(5)儿童、妊娠或哺乳期女性;(6)依从性差、无法配合检查。
1.3 治疗方法 益生菌组口服枯草杆菌二联活菌肠溶胶囊(0.25 g/粒,北京韩美药品有限公司),用法为0.5 g/次,3次/d。联合组口服枯草杆菌二联活菌肠溶胶囊与利福昔明片(0.2 g/片,意大利阿尔法韦士曼制药公司),枯草杆菌二联活菌肠溶胶囊用法同益生菌组,利福昔明片用法为0.2 g/次,4次/d,两药间隔3 h。两组患者疗程均为14 d,停药后随即复查甲烷氢呼气试验。
1.4 观察指标
1.4.1 症状调查 记录并比较患者治疗前后的主要症状及伴随症状,主要症状采用IBS病情严重程度量表(IBS symptom severity scale,IBS-SSS)[11]调查。IBS-SSS量表包括腹痛程度、腹痛频率、腹胀程度、对大便满意度、肠道症状对生活的困扰共5个项目,其中腹痛程度按“1~5分”分为5个级别;腹痛频率按“≤1 d/周、2~3 d/周、4~6 d/周、每日、每日多次或持续存在”分为5个级别;腹胀程度按“无、轻度、中度、偏重、严重”分为5个级别;对大便满意度按“满意、尚且满意、不满意但可耐受、影响正常生活、严重影响正常生活”分为5个级别;肠道症状对生活的困扰按“完全不影响、有时影响、经常影响、严重影响、完全无法进行正常的生活工作”分为5个级别。5个级别按照20分递增,每个项目满分100分。根据5个项目的分数之和(SSS总分)判断IBS-D患者的严重程度,75~175分为轻度,175~300分为中度,>300分为重度。轻症率=轻度患者例数/总病例数×100%。伴随症状主要包括是否伴有排便费力感、排便急迫感、排便不尽感、排黏液便、腹部胀气等症状。
1.4.2 炎性及肠黏膜屏障功能相关因子检测 抽取受试者清晨空腹外周静脉血5 ml,离心取血清,采用ELISA法检测炎性因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),以及肠黏膜屏障相关因子D-乳酸(D-LA)、细菌内毒素脂多糖(LPS)水平。
1.4.3 SIBO转阴率 记录两组患者治疗后SIBO转阴例数,计算转阴率。SIBO转阴率(%)=治疗后SIBO转阴例数/本组人数×100%。
1.5 统计学处理 采用SPSS 24.0软件进行统计分析。计量资料以表示,两组比较采用成组t检验,治疗前后比较采用配对t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 益生菌组64例,男30例,女34例,年龄(46.9±15.2)岁;联合组50例,男19例,女31例,年龄(50.8±15.3)岁。两组性别(χ2=0.902)、年龄(t=1.326)比较差异均无统计学意义(P>0.05)。
2.2 两组治疗前后症状比较 治疗前,两组患者的主要症状及伴随症状差异无统计学意义(P>0.05)。治疗后,两组的腹痛频率、腹胀程度、肠道症状对生活的困扰、SSS总分,以及伴有排便急迫、排黏液便比例均低于治疗前,联合组的腹痛程度评分及腹部胀气比例低于治疗前,轻症患者比例高于治疗前,差异有统计学意义(P<0.05);且联合组的腹痛程度、腹痛频率、腹胀程度、SSS总分及腹部胀气比例低于益生菌组,轻症患者比例高于益生菌组,差异有统计学意义(P<0.05,表1)。
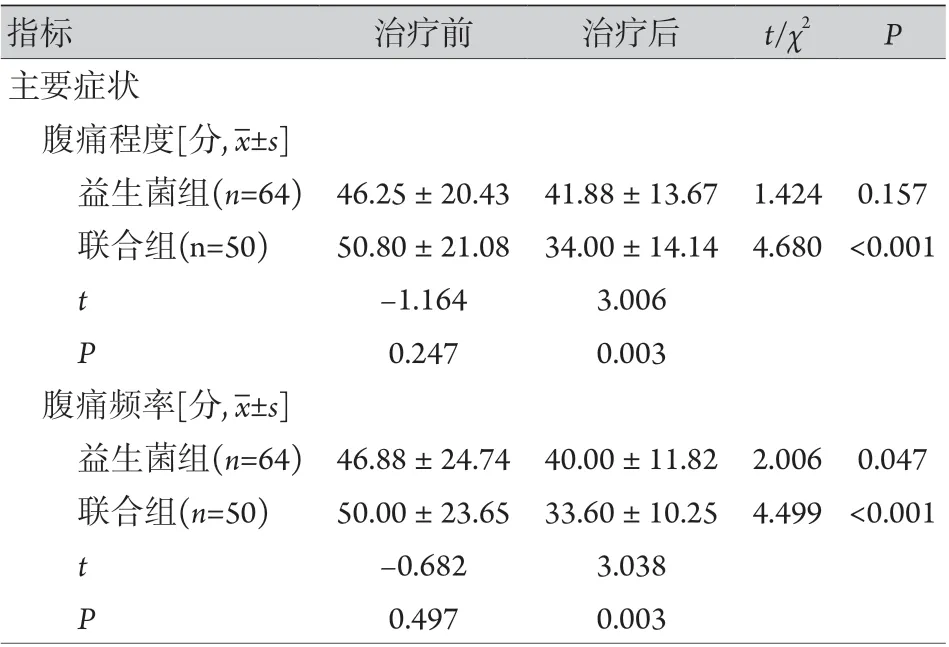
表1 两组伴有SIBO的IBS-D患者治疗前后症状比较Tab. 1 Comparison of the symptoms between IBS-D patients with SIBO in the two groups before and after treatment
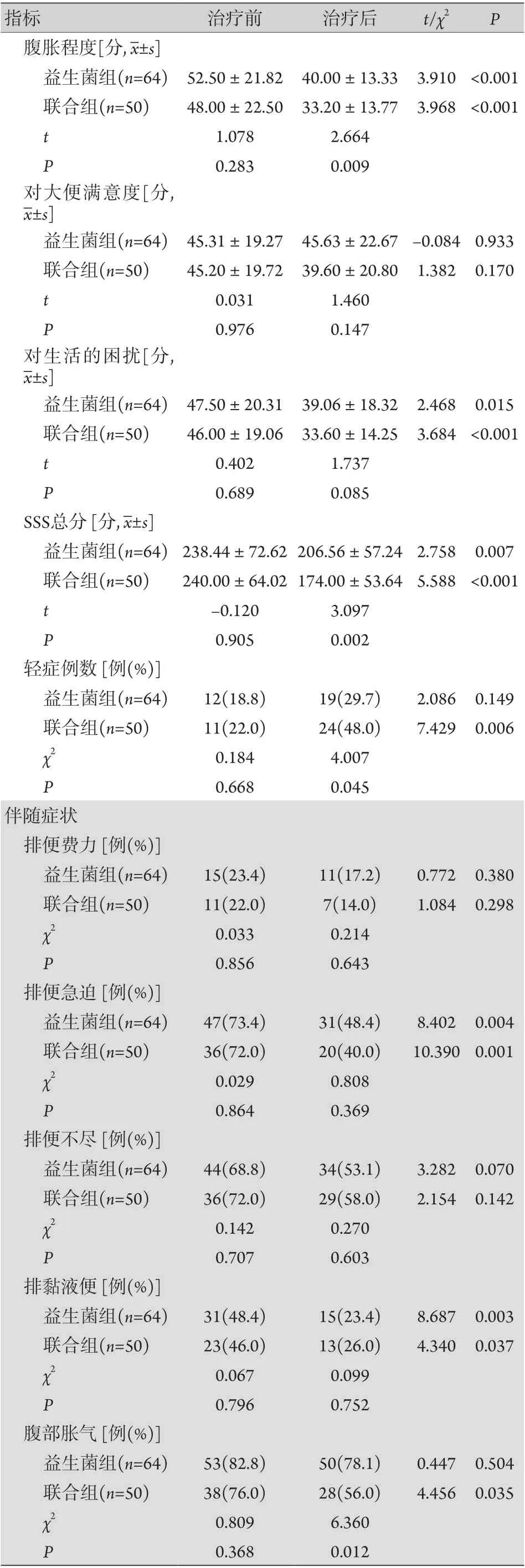
(续 表)
2.3 两组治疗前后血清相关因子比较 治疗前,两组血清IL-6、TNF-α、D-LA、LPS水平比较差异无统计学意义(P>0.05)。治疗后,两组血清IL-6、TNF-α、D-LA、LPS水平均低于治疗前,且联合组的IL-6、TNF-α、LPS水平低于益生菌组,差异有统计学意义(P<0.05);治疗后两组血清D-LA水平差异无统计学意义(P>0.05,表2)。
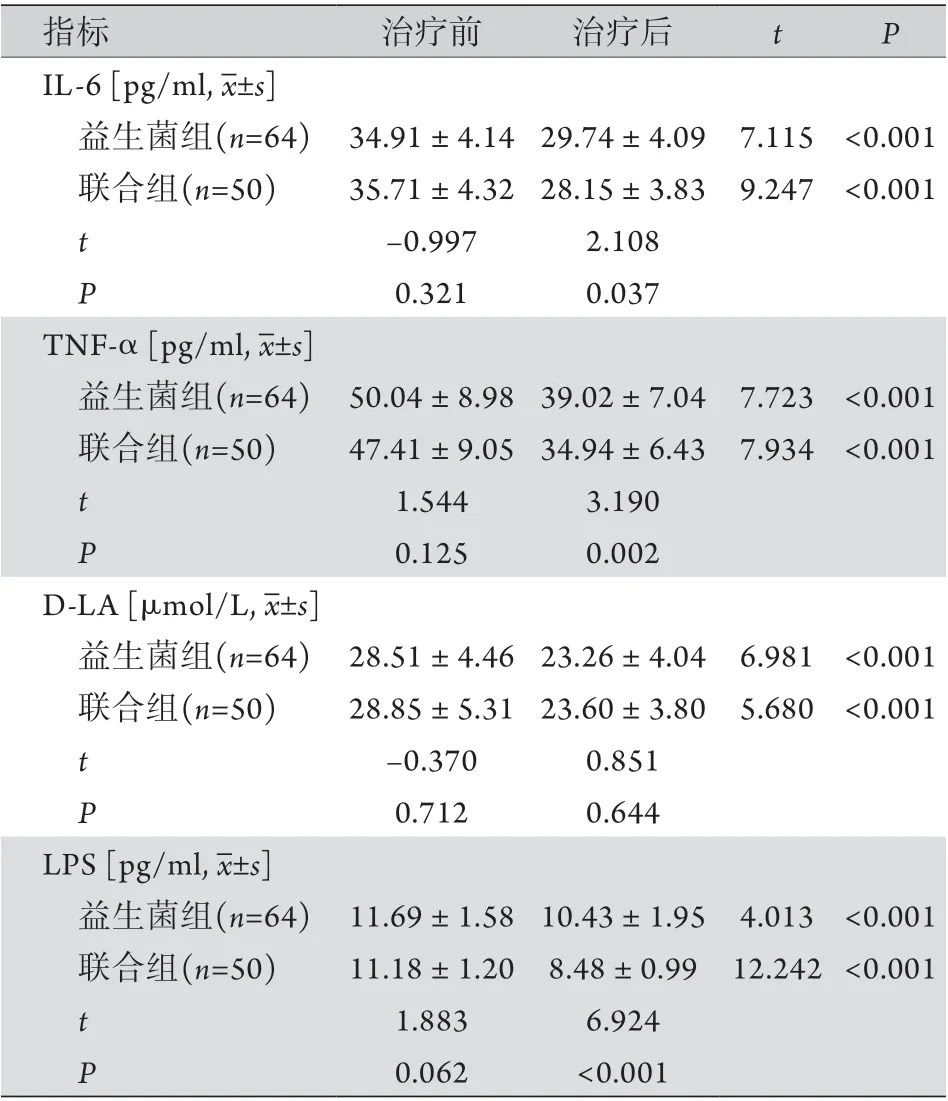
表2 两组伴有SIBO的IBS-D患者治疗前后血清相关因子比较Tab. 2 Comparison of the serum related factors between IBS-D patients with SIBO in the two groups before and after treatment
2.4 两组治疗后SIBO转阴率比较 治疗后,联合组的SIBO转阴率为76.0%(38/50),高于益生菌组的46.9%(30/64),差异有统计学意义(χ2=9.893,P=0.002)。
3 讨 论
IBS是一组常见的以腹痛、腹胀、腹部不适伴排便习惯改变为主要症状的临床综合征,IBS-D是IBS中以稀便为主的亚型。IBS发病机制目前尚不明确,可能与肠道菌群紊乱、SIBO存在密切关系[12-14]。有研究显示,IBS-D患者肠道内有害菌群明显增加,有益菌群减少,微生物丰富度降低[15-16]。SIBO诱发IBS的机制主要包括两个方面:一是SIBO相关的肠道菌群失衡引起异常发酵,导致小肠内气体过多,引起IBS症状[17];二是SIBO可降低肠道屏障功能,激活黏膜下免疫反应,引起轻度炎症[18],从而导致胃肠道神经及平滑肌功能的持续变化,引起肠道运动及功能障碍[19]。肠道内的细菌能产生大量LPS,并通过发酵产生D-LA,当肠道内有害菌增多,肠黏膜由于免疫反应及炎症反应出现屏障功能受损时,LPS、D-LA增多并进入血液,因此IBS-D患者的血清LPS及D-LA水平高于健康人群[20-21]。肠黏膜低度炎症则与肠上皮内淋巴细胞、肥大细胞及嗜铬细胞数量增加有关[22],这些免疫细胞能够增强TNF-α、IL-6等炎性因子的表达并体现在外周血中。
许多研究者认为,益生菌制剂可以改善IBS患者的腹痛、腹泻等症状,能有效治疗IBS[23-24],因此益生菌制剂被广泛用于IBS患者。益生菌治疗IBS的可能机制包括[25]:(1)减少竞争性病原体的数量;(2)调节胆盐代谢;(3)通过细胞因子和Toll样受体的调节作用减轻低度炎症反应;(4)调节肠道免疫功能;(5)作用于紧密连接,降低肠黏膜通透性;(6)调节内脏敏感性;(7)调节胃肠运动;(8)调节大脑中枢兴奋及抑制等。颜美珠等[21]使用酪酸梭菌(米雅)治疗IBS-D患者,发现患者的LPS、D-LA、二胺氧化酶(DAO)、C反应蛋白(CRP)、IL-6、IL-1β水平均明显下降,腹痛、腹胀、大便次数增多症状明显缓解,提示益生菌可能通过改善黏膜通透性、修复黏膜屏障来缓解IBS症状。Lewis等[26]进行的一项临床随机对照试验(RCT)发现,干酪乳杆菌HA-196及双歧杆菌R0175可以降低IBS-D患者的IBS-SSS评分,降低肠道蠕动频率,干酪乳杆菌HA-196还能增加大便稠度,提升患者生活质量。Martoni等[27]开展的另一项RCT研究显示,嗜酸乳杆菌DDS-1及乳酸双歧杆菌UABla-12能缓解IBS患者的腹痛、腹胀、排便习惯改变等症状,提升生活质量。在本研究中,受试者口服的枯草杆菌二联活菌肠溶胶囊内含有屎肠球菌和枯草杆菌两种人体正常菌群,益生菌组患者口服该药物后腹痛、腹胀及总体症状均明显缓解,排便异常减少,血清IL-6、TNF-α、D-LA、LPS水平均明显降低,提示益生菌在缓解IBS-D患者的临床症状、改善肠道炎症及通透性方面有效,符合既往研究结论。然而诸多临床试验对益生菌治疗IBS的有效性结论并不一致,益生菌治疗IBS仍存在争议。Simrén等[28]在肯定双歧杆菌治疗IBS有效性的同时,也提出是否应联用多菌株益生菌、益生菌的生物利用度如何、给药方案、特定IBS亚型如何选择菌株、哪些IBS症状属于益生菌治疗的主要目标等问题,这些问题仍需进一步探索。
另一类治疗IBS的药物是抗生素。利福昔明作为肠道内杀菌药近些年被广泛用于治疗非便秘型IBS,该药通过杀灭肠道内细菌以降低肠黏膜炎症反应,促进肠黏膜屏障功能恢复,从而减轻IBS患者的症状[29-30]。Xu等[31]对内脏痛觉过敏大鼠使用利福昔明治疗,使乳杆菌属占优势,降低其回肠组织中IL-17、IL-1β、TNF-α、IFN-γ等炎性因子水平,增加了紧密连接蛋白occludin的表达,改善了实验动物的内脏痛觉过敏。Hou等[32]发现IBS-D大鼠的TNF-α、IL-6水平明显高于正常大鼠,而用利福昔明灌胃给药后,大鼠的TNF-α、IL-6水平显著低于以生理盐水灌胃的空白对照组。Pimentel等[33]对非便秘型IBS患者进行双盲对照治疗,发现利福昔明组的腹胀完全缓解及腹痛、腹泻症状缓解的比例明显高于安慰剂组。刘治宏等[34]给SIBO阳性IBS-D患者口服利福昔明,发现其症状评分、IL-8、TNF-α、核因子κB(NF-κB)改善情况明显优于口服安慰剂的对照组。在本研究中,治疗后联合组的腹痛、腹胀积分,排便伴腹胀人数,以及血清IL-6、TNF-α、LPS水平均低于益生菌组,SIBO转阴率高于益生菌组,提示联合用药能更好地逆转SIBO,减轻肠道炎症反应,恢复肠道屏障功能,缓解腹痛、腹胀。
综上所述,IBS缺乏特效的治疗药物,而益生菌长期被用于治疗IBS,安全性、有效性及经济性均较好,临床上常将其作为治疗IBS的常规用药。在本研究中,单独使用益生菌即可对伴有SIBO的IBS-D患者起到减轻肠道炎症反应、缓解临床症状的作用,而益生菌联合利福昔明治疗效果更佳,推测在应用利福昔明发挥肠道内杀菌作用的同时补充益生菌,可能比单用益生菌能更有效地杀灭有害菌,改善菌群结构,减轻肠道炎症反应。但该联用方案仍有许多问题亟待解决,如益生菌与利福昔明是否存在拮抗作用,治疗后的长期效果如何,益生菌菌株应如何选择,两药联用的最佳给药方案如何确定,合理的疗程是多久,影响治疗效果的相关因素有哪些,利福昔明的耐药风险如何,再治疗的有效性及安全性如何明确等等。这些问题尚需通过更多更深入的研究进行探索。
