关节表层软骨干细胞在骨关节炎中的作用研究进展
2021-11-26徐伟廖冬发夏宁刘达王维郑伟
徐伟,廖冬发,夏宁,刘达,王维,郑伟
西部战区总医院骨科,成都 610083
关节表面覆盖着含水丰富、无神经和血管分布的关节软骨,其由表层、中间层、深层和钙化软骨层构成。关节软骨表层(superficial zone,SPZ)由2~4层扁而长的细胞沿关节面平行排列而成,其中平行分布的胶原纤维及表层细胞分泌的润滑素[由蛋白聚糖4(proteoglycan 4,Prg4)基因编码]可减小关节活动中的摩擦力,维持关节软骨的完整性和功能[1]。中间层和深层中存在的唯一类型的细胞是关节软骨细胞,其与关节表面呈垂直分布并分泌大量蛋白聚糖和网状分布的Ⅱ型胶原纤维,可以保留大量水分,增加关节软骨的韧性和弹性并可吸收及缓冲应力。钙化层软骨细胞肥大化,可分泌Ⅹ型胶原纤维,通过钙化基质将应力均匀传递到软骨下骨中[2-3]。
骨关节炎(osteoarthritis,OA)是一种以软骨细胞肥大和凋亡、软骨细胞外基质降解、滑膜炎性浸润以及软骨下骨重塑为主要病理特征的慢性致残性疾病[3-4]。OA早期的病理变化主要为关节SPZ的组织纤维化和组织完整性破坏。关节SPZ细胞也是第一个随着年龄增长而丢失的细胞,与30岁比较,85岁丢失的SPZ细胞多达50%[5]。目前尚无有效方法延缓OA进展,OA患者最终只能进行关节置换。由于目前治疗方法的局限性,激发了研究者对采用干细胞再生软骨进而治疗OA的广泛兴趣[6-7]。大多数干细胞治疗研究都是采用体外贴壁扩增的间充质干细胞(mesenchymal stem cells,MSCs),后者主要来源于骨髓或脂肪组织,但这些MSCs在关节软骨再生中的效果仍存在争议,其产生的软骨样组织与正常关节软骨在生物特性和功能上具有一定差距[8]。理想的关节软骨修复不仅是新生软骨填充软骨缺损部位,且新生的软骨应具有与原关节软骨相同的分层结构、生物特性及基质组分,以达到更为完美的功能学修复[9]。为解决该问题,有研究者提出激活动员关节软骨内源性干细胞的方法以促进缺损部位进行自我修复[10-11]。虽然关节软骨缺乏自我修复能力,但大量研究证实关节SPZ中存在软骨干细胞(cartilage-derived stem/progenitor cells,CSPCs),本文对关节表层软骨干细胞(SPZ-CSPCs)及其在OA中的作用研究进展作一综述。
1 SPZ-CSPCs的发现简史及特异性标志物
尽管缺乏自我修复能力,但已证实关节软骨中存在一批具有干细胞特性的细胞。这些软骨来源的具有干细胞特性的细胞已在人、马和牛等的关节软骨中被发现,并依据其具备自我更新能力、干细胞相关表面标志物和多项分化潜能而被分离和鉴定[12]。Hayes等[13]发现,软骨细胞可能是从关节SPZ开始更新(称为外加生长),而不是从深层软骨开始更新(间质生长)。Candela等[14]利用溴脱氧尿苷(bromodeoxyuridine,BrdU)长时程标记实验发现,小鼠关节SPZ中存在一群BrdU标记保留细胞,而BrdU标记保留是成体干细胞的特征之一。谭乔燕等[15]分离小鼠关节SPZ细胞并进行功能鉴定,发现SPZ细胞具有体外克隆形成能力和三系分化能力,且可表达MSCs表面标志物,表明SPZ细胞具有干细胞特性。同样,有学者在人关节SPZ中也发现了“干细胞样”细胞[12]。这些细胞的共同特点是表达特异性MSCs相关表面标志物,包括CD105、血管细胞黏附蛋白-1(vascular cell adhesion molecules-1,VCAM-1,也称CD106)、CD166、NOTCH-1、STRO-1和平滑肌肌动蛋白(smooth muscle actin,SMA)等。Lotz等[16]报道,在正常关节SPZ细胞中,NOTCH-1、STRO-1和VCAM-1阳性细胞占比高达45%。尽管上述研究证实了关节SPZ中“干细胞样”细胞的存在,且具有类似于MSCs的干细胞特性,包括自我更新能力、多向分化潜能和表达MSC相关表面标志物,但由于研究手段有限,这些研究并未提出可在体内进行可靠鉴定和谱系示踪的SPZ-CSPCs特异性标志物,即无直接证据证实SPZCSPCs的存在。这些从关节SPZ中分离和鉴定的干细胞只能称为软骨“干细胞样”细胞。
随着细胞示踪技术和基因技术的发展,近年来多项研究为SPZ-CSPCs的存在提供了直接证据。Kozhemyakina等[17]将CreERT2表达盒(一种他莫昔芬诱导的Cre等位基因)敲入小鼠Prg4基因中,利用该小鼠品系进行细胞示踪,发现PRG4蛋白特异性地表达于SPZ细胞和滑膜衬里细胞中,PRG4+细胞是存在于关节SPZ中的CSPCs,其一方面通过对称分裂维持自身干细胞数量,另一方面通过不对称分裂向下分化为中层和深层的软骨细胞。Li等[5]进一步证实了该研究结果,发现PRG4+细胞同时参与幼年小鼠关节软骨的外加生长和间质生长,并能完全重建成年关节软骨组织。此外,SPZ中PRG4+细胞分裂缓慢,具有自我更新能力,并表达干细胞特异性标志物,符合成体干细胞的标准,是一种SPZ-CSPCs。Decker等[18]进一步采用两种替代的、独立衍生的小鼠品系(Prg4-CreERT2小鼠和Dkk3-CreERT2小鼠)证实了上述结论。这3项研究为SPZCSPCs的存在提供了直接证据,表明SPZ-CSPCs在出生后即存在于关节SPZ中,PRG4为其干细胞特异性标志物。
2 SPZ-CSPCs对关节发育和稳态维持的作用
关节发育是一个复杂而有序的过程,在小鼠胚胎期10.5 d,MSCs凝聚形成软骨雏形,随后在将来关节形成的部位出现扁平状的MSCs并形成中间带,中间带的出现是关节发育的第一征象。随后,中间带中分化出现关节腔,中间带及其周围的细胞逐渐形成关节软骨和滑膜关节[19]。关节发育过程受多种信号通路和分子的调节,包括生长分化因子5(growth differentiation factor 5,GDF5)、Wnt、印度豪猪蛋白(indian hedgehog,IHH)、甲状旁腺激素相关蛋白(parathyroid hormone related protein,PTHrP)、骨形态生成蛋白(bone morphogenetic protein,BMP)、转化生长因子-β(transforming growth factor-β,TGF-β)和成纤维细胞生长因子(fibroblast growth factor,FGF)等[19]。既往研究发现,在胚胎发育早期,所有关节结构都来源于中间带的GDF5+干细胞[20]。近期通过对关节形成的时空特征进行研究提出了流入模型,即在关节形成过程中外周细胞不断流入中间带的GDF5+干细胞区域,同时GDF5+干细胞从中间带流向骨骺软骨[21]。因此,新的软骨干细胞不断从外周组织中得到补充,而同时GDF5+干细胞也不断向外周流出,进一步促进胎儿期骨骺软骨的生长。出生后当关节完全形成时,GDF5+干细胞消失,PRG4+干细胞出现。GDF5+干细胞在胚胎期14.5~15.5 d开始局限于SPZ,随后在胚胎期15.5 d至出生前消失,与此同时,关节SPZ细胞开始表达PRG4,这些GDF5+干细胞可能转变成了PRG4+干细胞[5,20-21]。
出生后,PRG4+干细胞分裂非常缓慢,其通过对称分裂进行自我更新,两个子细胞都停留在SPZ中成为SPZ-CSPCs。与此同时,关节SPZ中PRG4+干细胞通过不对称分裂,部分细胞分化成为软骨细胞。当发育成熟后,所有关节软骨细胞都来源于SPZ中的PRG4+干细胞[5,17]。Kozhemyakina等[17]在胚胎期17.5 d对PRG4+干细胞进行标记示踪,发现其后代细胞构成了成年小鼠关节软骨的所有层(从表层至钙化层),即使在1月龄时开始标记示踪,PRG4+干细胞也会在1年内缓慢扩张到潮汐线以上的整个软骨层。总之,SPZ中的PRG4+干细胞是具备自我更新能力的SPZ-CSPCs,这些细胞负责成年小鼠软骨的形成和稳态维持(图1A、B)。
3 SPZ-CSPCs对软骨再生和OA的作用
早期研究虽然缺乏用于体内直接示踪SPZCSPCs的干细胞特异性标志物,但多项研究提示这些SPZ“干细胞样”细胞在软骨损伤和OA中发挥了重要作用。Seol等[22]首先报道了健康软骨组织中因钝性机械损伤而迁移出现软骨“干细胞样”细胞,这些软骨“干细胞样”细胞会对软骨损伤伴随的生物变化(如细胞外基质降解、血管浸润和滑膜炎症)做出反应。Seol等[23]发现,细胞外基质降解酶对软骨细胞外基质的损伤促进了体外培养的关节软骨组织中软骨“干细胞样”细胞的迁移。软骨损伤后释放的炎性因子如高迁移率族蛋白-1(high mobility group box-1,HMGB-1)、白细胞介素-1β(interleukin-1β,IL-1β)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)和血小板源性生长因子(platelet derived growth factor,PDGF)等促进了软骨“干细胞样”细胞的迁移[12]。
多项研究表明,SPZ中“干细胞样”细胞参与了OA的各个阶段。OA组织中细胞增殖和干细胞表面标志物增多,如CD105+、CD166+细胞在OA软骨中的比例约为8%,而在正常软骨中的比例约为4%,提示这些软骨“干细胞样”细胞可能参与了OA的发病过程[24]。在OA早期,关节软骨的裂隙及其周围出现增殖的细胞群,这些细胞群中大多数细胞表达干细胞特异性标志物,如NOTCH-1、STRO-1和VCAM-1等[16,25]。在OA晚期,Koelling等[26]发现,在退变软骨部位出现软骨“干细胞样”细胞的迁移群体,这些细胞可能是从损伤局部细胞直接增殖而来和(或)从邻近组织(滑膜、软骨下骨、关节液等)迁移而来的。
随着研究技术的发展和SPZ-CSPCs特异性标志物的发现,SPZ-CSPCs在关节软骨再生和OA中的作用获得了直接证据。Decker等[18]发现,关节软骨损伤后7 d,软骨缺损区域的细胞主要由PRG4+细胞的后代构成(≤70%)。值得注意的是,Decker等[18]观察到,PRG4+细胞在关节滑膜中大量增殖,而在软骨SPZ区域,PRG4+细胞及其子代均不增殖。此外,软骨损伤部位与增生的滑膜组织距离越近,PRG4+示踪细胞在缺损区域所占的比例越大,表明位于滑膜的PRG4+细胞而不是SPZ的PRG4+细胞参与了软骨损伤的修复过程[18]。Roelofs等[27]进一步研究发现,软骨损伤后,参与再生修复的细胞绝大部分为GDF5+细胞(≤80%),这一比例与PRG4+子代细胞在软骨损伤修复中的比例相当。此外,GDF5+滑膜细胞也表达PRG4,表明GDF5+细胞可能是出生前PRG4+细胞的祖细胞,而PRG4+细胞则是出生后的CSPCs[28]。值得注意是,Roelofs等[27]发现,软骨急性损伤后滑膜中GDF5+细胞大量增殖,但临近损伤部位的SPZ-CSPCs却几乎没有反应。由于PRG4+细胞和GDF5+细胞同时存在于滑膜和SPZ中,因此参与软骨损伤修复的CSPCs究竟来源于滑膜还是SPZ需要进一步探讨。相反,Seol等[22]在关节软骨组织体外培养损伤模型中发现,SPZ中的“干细胞样”细胞可以迁移到软骨组织的损伤部位,由于这种干细胞迁移在体内细胞示踪实验中不易发现,因此,不能完全排除SPZ中PRG4+干细胞对软骨损伤的修复作用。同时,Roelofs等[27]发现,损伤部位参与软骨再生修复的细胞中有一部分细胞不属于标记示踪的细胞,提示除PRG4+干细胞外,可能存在其他特异性标志的干细胞参与了软骨损伤修复过程(图1C)。
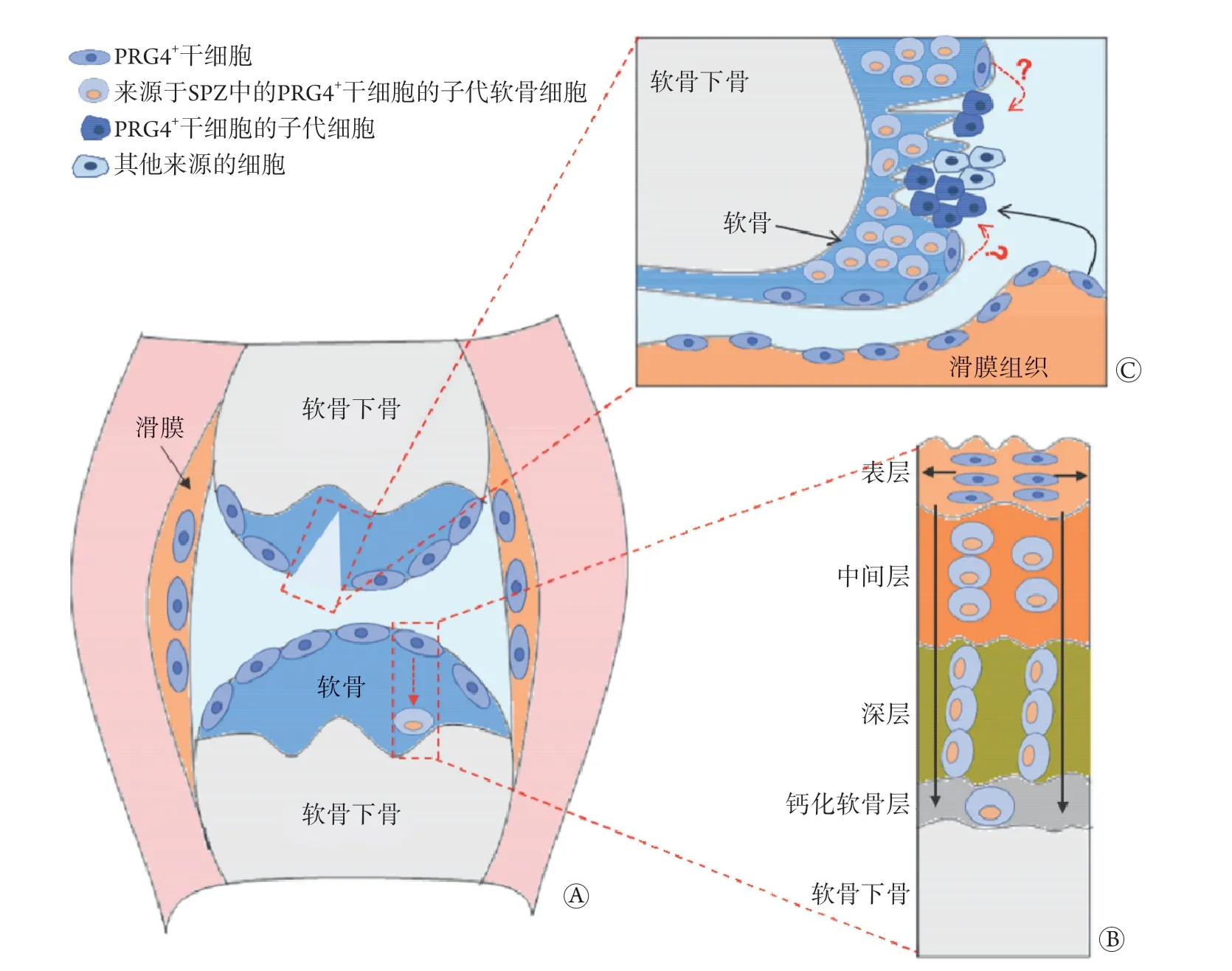
图1 SPZ-CSPCs对关节发育和软骨损伤的修复作用Fig.1 Effects of SPZ-CSPCs in joint development and repair of cartilage injury
Tan等[29]研究发现,特异性敲除小鼠SP ZCSPCs中活化素受体样蛋白激酶5(activin receptorlike kinase 5,Alk5)基因后,SPZ中PRG4+干细胞数量减少,表面润滑素分泌减少,并伴有软骨退变加快和OA的发生,提示PRG4+干细胞在OA中发挥着重要作用。相反,Zhang等[30]发现,通过诱导白喉毒素的自主表达来杀死小鼠关节SPZ中的PRG4+干细胞后,并不会导致软骨退变加快和OA的发生。该研究结果似乎与SPZ-CSPCs在关节稳态维持和OA中的重要作用相矛盾。虽然大量的PRG4+软骨干细胞死亡,但有证据表明,幸存的SPZ-CSPCs会以更快的速度进行增殖分裂,最终重新补充原来SPZCSPCs耗尽的区域。同时,由于白喉毒素诱导的细胞死亡不会对关节软骨造成机械损伤,这种方法可能不足以激发SPZ-CSPCs的软骨再生修复反应[5]。
4 调控SPZ-CSPCs的功能对OA的作用
关节发育和稳态维持过程受多种信号通路和分子的调节,包括GDF5、Wnt、IHH、PTHrP、BMP、TGF-β和FGF等[19],同样多种信号通路和分子可调控SPZ-CSPCs的功能进而影响OA的发生和发展,包括Wnt/β-catenin、表皮生长因子受体(epidermal growth factor receptor,EGFR)、TGF-β和PRG4等。Koyama等[20]发现,β-catenin条件性敲除(conditional knockout,CKO)小鼠(Col2a1-β-catenin CKO或Gdf5-β-catenin CKO)关节SPZ中扁平状细胞(主要是SPZ-CSPCs)消失且润滑素表达减少。Yasuhara等[31]发现,条件性敲除β-catenin的小鼠关节软骨中SPZ细胞和润滑素表达减少,同时关节软骨分层结构消失,均由圆形的软骨样细胞组成。Xuan等[32]发现,SPZ-CSPCs特异性β-catenin敲除小鼠的OA进展较野生小鼠明显加快,并伴有SFZ破坏。相反,SPZ-CSPCs特异性β-catenin增强小鼠的润滑素表达增加,OA进展较野生小鼠明显减慢。上述研究结果表明,经典的Wnt/β-catenin信号可通过诱导SPZ-CSPCs分泌润滑素而在关节软骨稳态维持和OA中发挥重要作用。Jia等[33]发现,软骨特异性EGFR敲除小鼠的关节软骨中SPZ细胞数量明显减少,润滑素分泌减少,同时关节软骨退变加快。Wei等[34]发现,软骨特异性EGFR过表达小鼠的SPZ-CSPCs数量增加、增殖加快,润滑素分泌增多,内侧半月板不稳定(destabilization of the medial meniscus,DMM)诱导的软骨退变减慢。TGF-β信号通路在关节软骨发育、稳态维持及OA的发生中也具有重要作用。近期研究发现,TGF-β信号通过调控SPZ-CSPCs的功能在OA中发挥重要作用。王权[9]和Tan等[29]发现,SPZ-CSPCs中特异性敲除Alk5基因抑制TGF-β/ALK5信号后,在老年性OA或DMM诱导的OA模型中,SPZ-CSPCs数量减少,润滑素分泌减少,并伴有软骨退变加快。进一步研究发现,Alk5 CKO小鼠中SPZ-CSPCs表现出衰老表型,包括SPZ-CSPCs增殖和分化减少、SA-β-gal阳性细胞增多、ROS产生增加、线粒体明显肿胀以及溶酶体破裂[29]。润滑素特异性表达于SPZ-CSPCs中,人类和小鼠中Prg4基因缺失可导致关节软骨退变加快及OA的发生[35]。Zhang等[36]发现,Creb5是一种特异性表达于SPZ细胞中的转录因子,是TGF-β和EGFR信号诱导润滑素表达所必需的。Delve等[37]发现,在SPZ细胞中,Yes相关蛋白(Yes-associated protein,YAP)和PDZ结合基序转录共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)可调控润滑素的表达。
5 总结与展望
综上所述,至少有一种类型的SPZ-CSPCs(PRG4+细胞)已在小鼠中被发现和鉴定,且PRG4+干细胞很可能是GDF5+细胞的后代。PRG4+干细胞同时存在于SPZ和滑膜中,存在于SPZ中的PRG4+干细胞在出生后分化成软骨细胞,形成完整的关节软骨。PRG4+干细胞在软骨损伤后可迁移到软骨损伤部位,但这些干细胞的来源(滑膜还是SPZ)及其在软骨损伤修复中的愈合潜力仍待进一步阐明(图1)。SPZ-CSPCs在OA的发生和发展中发挥着重要作用,多种信号通路和分子(如Wnt/β-catenin、EGFR、TGF-β和PRG4等)通过调控SPZ-CSPCs的功能而影响OA的发生和发展。虽然激活动员内源性SPZ-CSPCs或局部注射外源性SPZ-CSPCs来促进缺损部位修复为OA的治疗带来了曙光,但其只适用于较小面积的损伤修复,关节软骨大面积缺损需借助组织工程技术进行移植重建,同时外源性干细胞治疗存在靶向性差、半衰期短等问题,需要与组织工程技术结合使用。未来SPZ-CSPCs有望作为组织工程种子细胞被应用于软骨组织工程,移植重建创伤或OA引起的关节软骨缺损。
