缺氧诱导的间充质干细胞外泌体对胃癌细胞生长和转移的影响及机制*
2021-11-26李延新段小瑞
杜 雄,李延新,段小瑞,康 婷
延安大学附属医院:1.病理科;2.肿瘤科,陕西延安 716000
胃癌是一种常见的消化道恶性肿瘤,在中国其发病率位居恶性肿瘤第三位,病死率位居第二位,虽然随着医疗技术的发展,胃癌的手术和化疗均取得了一定的进展,胃癌患者的5年生存率逐渐提高,但仍低于30%[1-3]。由于缺乏早期诊断的特异性标志物,胃癌患者往往在确诊时就已经处于中晚期,错过了手术和化疗的最佳时机,并且胃癌发生发展的分子机制尚不明确,治疗靶点受限[4-5],所以探究胃癌的发生机制对于其临床诊断和治疗至关重要。
肿瘤细胞和微环境细胞受到多种应激因素的影响,例如缺氧、代谢应激、氧化应激等[6]。缺氧是实体肿瘤的特征,癌细胞的快速生长导致局部缺氧,进而刺激肿瘤微环境中的各种基质细胞对肿瘤产生影响[7-8]。间充质干细胞是肿瘤微环境的重要组成部分,可有助于肿瘤的发生发展[9]。肿瘤外泌体是肿瘤细胞所分泌的纳米级囊泡,可调控肿瘤的生长、转移、免疫逃逸等[10]。但在缺氧条件下,间充质干细胞外泌体对胃癌细胞的影响研究较少,本研究探讨了缺氧条件下间充质干细胞外泌体对胃癌细胞生长和转移的影响。
1 材料与方法
1.1仪器与试剂 人骨髓间充质干细胞hBMSCs(美国ScienCell公司,Cat.XY-XB-1578),人胃癌细胞MGC-803(美国ScienCell公司,Cat.ml-cs-0276),兔源CD9抗体、兔源CD63抗体、兔源TSG101抗体、兔源p-β-catenin抗体、兔源β-catenin抗体(英国Abcam公司,Cat.分别为ab92726、ab134045、ab125011、ab246504、ab32572),细胞凋亡检测试剂盒(沈阳万类生物技术有限公司,Cat.WLA030b),CCK8检测试剂盒(沈阳万类生物技术有限公司,Cat.WLA074),兔源CD44抗体、兔源c-myc抗体、兔源cyclin D1抗体、兔源GAPDH抗体、HRP标记山羊抗兔IgG(沈阳万类生物技术有限公司,Cat.分别为WL03531、WL01781、WL01435a、WL01114、WLA023),Matrigel胶(福麦斯生物技术有限公司,Cat.356234),无外泌体胎牛血清(美国Gibco公司,Cat.A2720801),流式细胞仪(美国Beckman公司),透射电镜(日本Hitachi公司),0.4 μm的Transwell小室(美国康宁公司,Cat.3413)。
1.2方法
1.2.1细胞培养 (1)正常的hBMSCs培养:取液氮保存的细胞,于37 ℃水浴锅中迅速解冻,然后转移至细胞培养皿中培养,hBMSCs培养于含10%胎牛血清、1%非必须氨基酸、1%谷氨酰胺的DMEM/F12培养基中,MGC-803细胞培养于含10%胎牛血清的DMEM培养基中,细胞置于含5% CO2,37 ℃的细胞培养箱中培养,隔天更换细胞培养基,细胞生长至汇合率80%时进行细胞传代。(2)缺氧诱导的hBMSCs培养:将hBMSCs细胞置于0.2% O2,5% CO2,37 ℃的细胞培养箱中,细胞培养2 d后收集细胞培养上清液,用于提取外泌体。
1.2.2外泌体的提取与鉴定 使用差速离心法提取正常间充质干细胞外泌体(Nom-exo)、缺氧诱导的间充质干细胞外泌体(Hypo-exo),将正常培养和缺氧培养的hBMSCs培养基更换为无外泌体胎牛血清配制的完全培养基,继续培养细胞,收集细胞培养上清液,使用差速离心法收集细胞上清液中的外泌体,主要步骤为:将上清液以3 000×g,4 ℃离心15 min去除死细胞;然后将上清液以6 000×g离心40 min,去除细胞碎片;10 000×g离心1 h,取上清液;100 000×g离心1 h,收集沉淀,用400 μL无菌磷酸盐缓冲液(PBS)重悬外泌体。使用透射电镜观察外泌体的形态结构,拍照记录。使用蛋白质印迹法(Western blot)检测外泌体标志蛋白CD9、CD63、TSG101的表达水平。将MGC-803细胞分为Nom-exo组、Hypo-exo组和PBS组,分别与10 μg/mL的Nom-exo、Hypo-exo以及等体积的PBS溶液共孵育24 h后进行后续研究。
1.2.3细胞增殖 采用CCK8法检测细胞增殖能力,将MGC-803细胞接种于96孔板,每孔5×103个细胞,每孔加入适量外泌体,使外泌体终浓度为10 μg/mL,96孔板中体积为100 μL,每组3个复孔,并设置24 h、48 h、72 h时间点对应的培养板,在细胞培养箱中培养,于对应时间点取出96孔板,每孔加入10 μL的CCK8溶液,于培养箱中孵育4 h后,使用酶标仪检测各孔450 nm处的吸光度(A)值,A值越大,细胞增殖能力越强。
1.2.4细胞凋亡 将MGC-803细胞接种于6孔板中,加入外泌体,使其终水平为10 μg/mL,于细胞培养箱中培养24 h,按照细胞凋亡检测试剂盒说明书,每孔5×104个细胞,用500 μL的染色缓冲液重悬细胞成单细胞悬液,随后添加5 μL的异硫氰酸荧光素(Annexin V-FITC)和5 μL的碘化丙啶染料(PI),混匀后室温避光孵育15 min,并设置Annexin V-FITC和PI单阳性管用于荧光补偿调节,空白管用于电压调节;使用流式细胞仪检测上述各样品的荧光值,使用FlowJo v5.573软件分析细胞凋亡数。
1.2.5细胞迁移与侵袭 Transwell小室用于检测细胞迁移,Matrigel胶于4 ℃融化后,取50 μL平铺于Transwell小室中用于检测细胞侵袭。取MGC-803细胞用DMEM培养基稀释至2.5×104个/毫升,取200 μL细胞接种于Transwell小室中,每孔5×103个细胞,每组3个复孔,每个小室中加入外泌体,使其终水平为10 μg/mL,小室放置于24孔板中,每孔加入600 μL含10%胎牛血清的完全培养基,并将上述24孔板转移至细胞培养箱中培养24 h,小室底部用PBS清洗后用无水乙醇固定30 min,然后将小室倒扣,底部滴加结晶紫染色10 min,清洗后晾干,于显微镜下观察、拍照并计数,比较各组细胞迁移数及侵袭数。
1.2.6Western blot 取各组与10 μg/mL外泌体共孵育后的MGC-803细胞1×106个,加入200 μL RIPA蛋白裂解液和2 μL PMSF蛋白酶抑制剂,冰上裂解30 min后,以12 000×g,4 ℃离心10 min,取上清液,即为细胞总蛋白。根据BCA蛋白定量试剂盒定量,定量后各组蛋白加入上样缓冲液煮沸30 min,使蛋白样品充分变性,然后进行SDS-PAGE凝胶电泳,转膜,用5%的脱脂牛奶对聚偏二氟乙烯膜(PVDF)封闭2 h,然后以1∶1 000比例稀释后的一抗4 ℃孵育过夜,TBST洗膜后二抗室温孵育1.5 h,再用TBST洗膜后按照ECL试剂盒说明书配制发光液,并将PVDF膜浸入发光液中反应半分钟,曝光并拍照,用Image J软件对曝光结果进行定量分析。
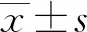
2 结 果
2.1外泌体提取及鉴定 透射电镜观察外泌体形态结果显示,外泌体具有双层膜结构,形态呈“杯托样”,粒径在30~100 nm,Western blot检测外泌体标志蛋白结果显示,差速离心法提取的外泌体表达标志蛋白CD9、CD63、TSG101,符合外泌体的结构及生物学特征。见图1~2。
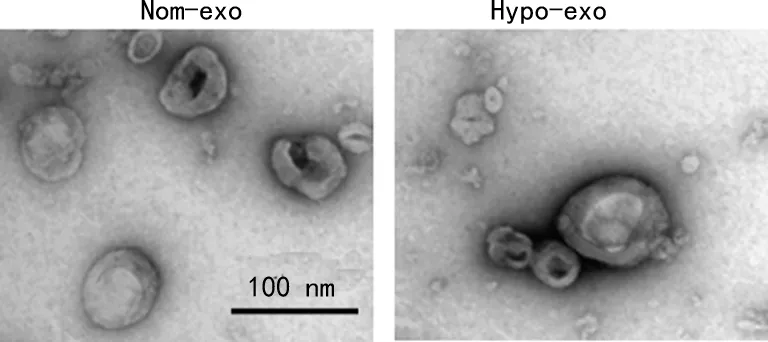
图1 透射电镜观察外泌体形态结构
2.2缺氧条件下间充质干细胞外泌体对胃癌细胞增殖能力的影响 相比于PBS组,Nom-exo组MCG-803细胞增殖能力显著增加(P<0.05),Hypo-exo组MGC-803细胞增殖能力亦显著增加(P<0.05),相比于Nom-exo组MCG-803细胞,Hypo-exo组MGC-803细胞增殖能力显著增加(P<0.05)。见图3。
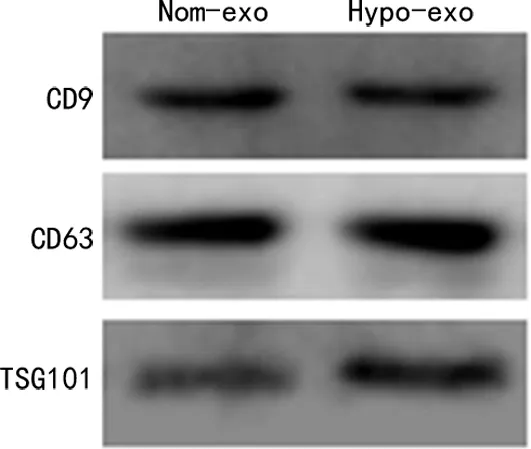
图2 Western blot检测外泌体标志蛋白表达
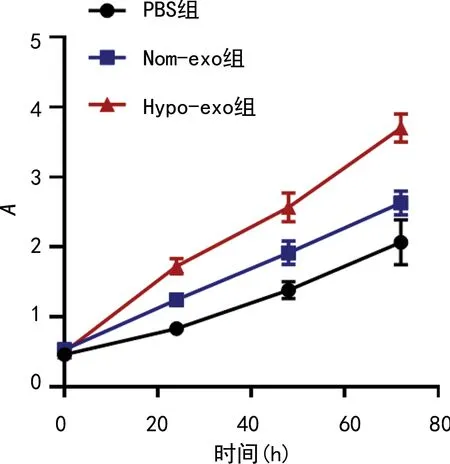
图3 间充质干细胞外泌体对胃癌细胞增殖能力的影响
2.3缺氧条件下间充质干细胞外泌体对胃癌细胞凋亡水平的影响 相比于PBS组,Nom-exo组MGC-803细胞凋亡水平显著降低(P<0.05),Hypo-exo组MGC-803细胞凋亡水平显著降低(P<0.05);而相比于Nom-exo组,Hypo-exo组MGC-803细胞凋亡水平亦显著降低(P<0.05)。见图4。

注:A、B、C分别为PBS组、Nom-exo组、Hypo-exo组细胞凋亡图;D为细胞凋亡率的统计值图。
2.4缺氧条件下间充质干细胞外泌体对胃癌细胞迁移能力的影响 相比于PBS组,Nom-exo组MGC-803细胞迁移数目显著增加(P<0.05),Hypo-exo组MGC-803细胞迁移数目显著增加(P<0.05);相比于Nom-exo组,Hypo-exo组MGC-803细胞迁移数目亦显著增加(P<0.05)。见图5。
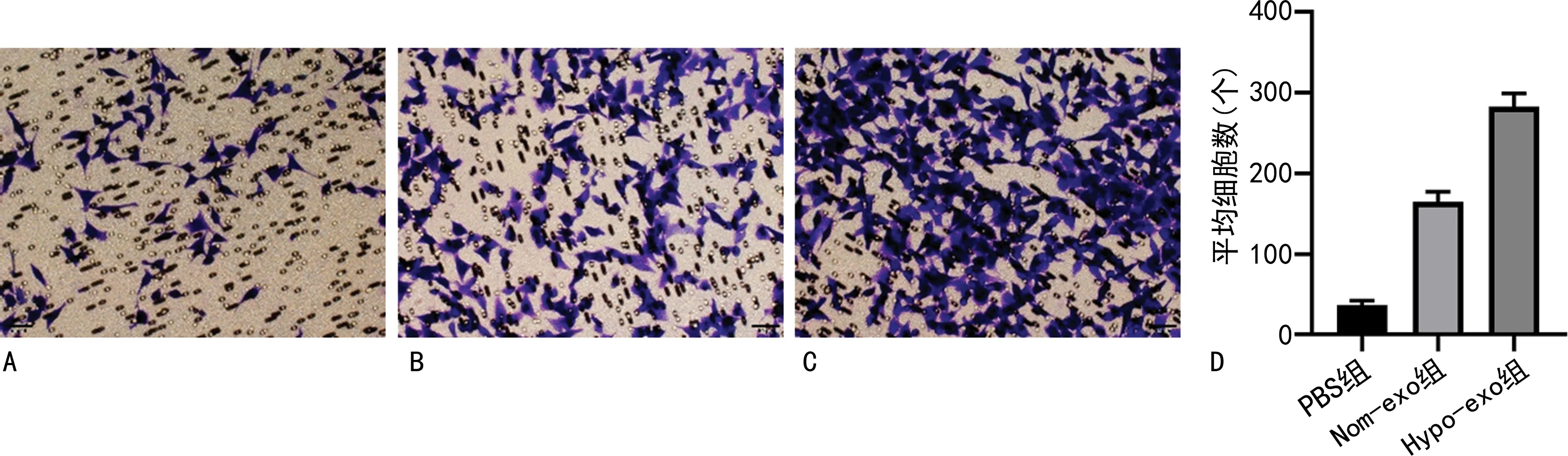
注:A、B、C分别为PBS组、Nom-exo组、Hypo-exo组细胞迁移图;D为平均细胞数的统计值图。
2.5缺氧条件下间充质干细胞外泌体对胃癌细胞侵袭能力的影响 Nom-exo组MGC-803细胞侵袭数目显著高于PBS组(P<0.05),Hypo-exo组MGC-803细胞侵袭数目显著高于PBS组(P<0.05);并且Hypo-exo组细胞侵袭数目显著高于Nom-exo组细胞侵袭数目(P<0.05)。见图6。
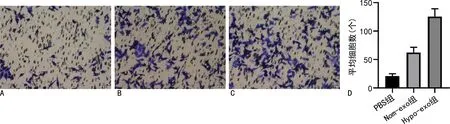
注:A、B、C分别为PBS组、Nom-exo组、Hypo-exo组细胞侵袭图;D为平均细胞数的统计值图。
2.6缺氧条件下间充质干细胞外泌体对胃癌细胞Wnt/β-连环素(β-catenin)信号通路的影响 相比于PBS组,Nom-exo和Hypo-exo组MGC-803细胞中β-catenin磷酸化水平显著升高(P<0.05),CD44、c-myc、G1/S-特异性周期蛋白-D1(Cyclin D1)表达显著上调(P<0.05),并且Hypo-exo组MGC-803细胞β-catenin磷酸化水平,CD44、c-myc、Cyclin D1表达水平均显著高于Nom-exo组(P<0.05)。见图7。
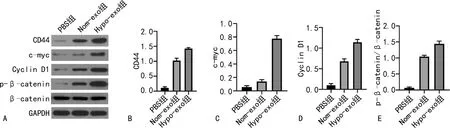
注:A为各组蛋白表达情况;B、C、D、E分别为CD44、c-myc、Cyclin D1、p-β-catenin/β-catenin表达水平的统计值图。
3 讨 论
在肿瘤的生长过程中,肿瘤细胞生长迅速并且超过肿瘤血管新生的速度,肿瘤细胞群周围毛细血管的氧有效弥散范围不能满足肿瘤快速生长的需要,导致肿瘤组织内毛细血管的氧和营养供应不均,由此形成肿瘤缺氧微环境。缺氧亦是肿瘤微环境的重要特征,研究表明,实体肿瘤中缺氧区域占0.35%~4.25%,中位氧含量约为2%[11]。缺氧的肿瘤微环境会调控肿瘤的血管新生、肿瘤代谢、免疫应答、生长、转移以及肿瘤耐药等过程[12]。间充质干细胞是肿瘤微环境中的重要基质细胞,在肿瘤的发生和发展过程中改造肿瘤微环境,调控肿瘤血管新生及免疫逃逸[13]。外泌体是肿瘤微环境中的重要组成部分,肿瘤微环境中的多种基质细胞均可通过分泌外泌体作为旁分泌介质而调控肿瘤的生长和转移。本研究探讨了缺氧诱导的间充质干细胞外泌体对胃癌细胞生长、转移的影响及其机制。
本研究通过差速离心法提取了Nom-exo和Hypo-exo,鉴定结果显示,所提取的Nom-exo和Hypo-exo形态结构和理化性质均符合外泌体的特征。有研究表明,缺氧条件下,间充质干细胞衍生的外泌体微小RNA(miR)-193a-3p、miR-210-3p、和miR-5100通过激活STAT3信号通路诱导上皮-间质转化(EMT),进而促进肺癌细胞的侵袭[14]。缺氧条件也可通过多种途径诱导胃癌细胞的增殖和转移,研究表明,低氧诱导的miR-224会促进胃癌细胞生长、迁移和侵袭,缺氧可通过诱导巨噬细胞活化而诱导胃癌的发生发展[15-16]。为了探究缺氧条件下间充质干细胞外泌体是否对胃癌细胞的生长和转移有影响,本研究将Nom-exo和Hypo-exo与胃癌细胞共孵育后发现,相比于Nom-exo组,Hypo-exo组胃癌细胞MGC-803的增殖能力显著增加,细胞迁移和细胞侵袭能力也显著增加,Hypo-exo组MGC-803细胞的水平显著低于Nom-exo组,提示缺氧条件下间充质干细胞外泌体也可以促进胃癌细胞的生长和转移。
Wnt/β-catenin信号通路是调控肿瘤细胞生长和转移的经典通路,该通路激活后β-catenin能够与其他蛋白分子结合形成复合物,在病理条件下可调控相关蛋白的表达以促进肿瘤的发生发展[17]。c-myc、CD44、cyclin D1是Wnt信号通路下游的靶基因,随着Wnt/β-catenin信号通路的激活而激活,调控原癌基因和抑癌基因的表达,进而促进肿瘤的生长和转移[18-19]。已有许多研究表明Wnt/β-catenin信号通路参与调控肿瘤细胞的生长和转移,例如,Wnt/β-catenin信号通路通过H3赖氨酸27乙酰化的表观遗传调控促进胃癌进展,Wnt/β-catenin途径与多种微小RNA(miRNA)之间的相互作用可调节胃癌EMT,Wnt/β-catenin信号通路是调控胃癌进展的关键信号通路。本研究发现,相比于Nom-exo组,Hypo-exo组MGC-803细胞c-myc、CD44、cyclin D1表达水平均显著升高,β-catenin磷酸化水平亦显著升高,即Wnt/β-catenin信号通路被激活,说明缺氧条件下间充质干细胞外泌体能够激活Wnt/β-catenin信号通路。
综上所述,Hypo-exo能够促进胃癌细胞的生长和转移,其机制为激活胃癌细胞中的Wnt/β-catenin信号通路,但是外泌体中包含多种物质,研究最广泛的是miRNA、长链非编码RNA等,所以间充质干细胞中何种物质发挥调控作用还需进一步研究。
