可溶性程序性死亡受体-1、可溶性程序性死亡配体-1和γ-干扰素在晚期肿瘤患者血清中的表达特征和临床意义*
2021-11-26孔评石陈美云滕凤猛
孔评石,陈美云,滕凤猛
江苏省第二中医院:1.检验科;2.肿瘤科,江苏南京 210017;3.南京中医药大学附属医院/江苏省中医院检验科,江苏南京 210004
随着近年来免疫检查点抑制剂(ICB)疗法在肿瘤治疗中取得的巨大进步,程序性死亡受体-1(PD-1)和程序性死亡配体-1(PD-L1)等免疫检查点分子的表达特征在临床治疗中的预测价值备受关注,病理组织中PD-1和PD-L1的表达水平联合其他指标的预测模式正在逐步建立。可溶性程序性死亡受体-1(sPD-1)和可溶性程序性死亡配体-1(sPD-L1)是PD-1和PD-L1的可溶性形式,与细胞膜型分子联系密切,在免疫平衡中发挥重要作用,对判断机体免疫状态、预测免疫治疗疗效和肿瘤转归具有潜在的重要价值,并且因PD-1/PD-L1通路在免疫检查点相关的免疫抑制中的关键性和广泛性作用而越发受到关注;然而sPD-1和sPD-L1在外周循环中的表达特征和表达水平仍缺乏更广泛的数据支持,国内的研究也相对较少。γ-干扰素(IFN-γ)在调控PD-L1中具有重要作用,有研究发现,IFN-γ联合PD-L1能够对肿瘤微环境的不同免疫特征进行有效划分,并具有一定的治疗预测价值[1],然而二者在外周血中同步观察的数据较少。本研究拟以健康人和良性疾病患者为对照,对晚期恶性实体肿瘤(包括肺癌和消化道肿瘤)患者血清sPD-1和sPD-L1的水平进行检测,同时分析其与IFN-γ及传统肿瘤标志物表达水平的相关性,旨在对肿瘤免疫中外周血可溶性免疫检查点分子的表达特征和临床意义进行初步探讨。
1 资料与方法
1.1一般资料 本研究纳入2020年5—7月江苏省第二中医院(简称本院)肿瘤科收治的非小细胞肺癌(NSCLC)患者21例(肺癌组),男13例,女8例,年龄55~80岁,平均(67.1±6.7)岁;消化道肿瘤患者13例(消化道肿瘤组),男8例,女5例,年龄58~82岁,平均(67.8±7.0)岁,包括胃癌3例,胰腺癌2例,食管癌2例,结肠癌6例。纳入病例均经过病理检查或细胞学检查确诊,既往进行过化疗且未进行过免疫治疗,TNM分期为Ⅲb~Ⅳ期,分别符合《原发性肺癌诊疗规范(2018版)》《食管癌诊疗规范(2018版)》《胃癌诊疗规范(2018版)》《胰腺癌诊疗规范(2018版)》《中国结直肠癌诊疗规范(2017版)》的诊断标准。另选取同期本院呼吸科住院的肺部良性疾病患者16例(肺炎组)及体检健康者12例(体检组)作为对照,肺炎组男9例,女7例,年龄51~77岁,平均(64.8±8.3)岁;体检组男6例,女6例,年龄40~74岁,平均(54.7±12.3)岁。各组人群性别及年龄比较,差异均无统计学意义(P>0.05),具有可比性。排除自身免疫性疾病和结核、梅毒、病毒性肝炎等传染性疾病及器官功能严重受损者。
1.2方法 受试者常规空腹抽取静脉血,离心分离血清。甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原153(CA153)、糖类抗原199(CA199)、糖类抗原724(CA724)、细胞角蛋白19片段(Cyfra211)、神经元特异性烯醇化酶(NSE)采用全自动化学发光检测;sPD-1、sPD-L1和IFN-γ检测分别按酶联免疫吸附试验(ELISA)试剂盒说明书操作,检测信号波长:450 nm,矫正波长:570 nm;采用双抗体夹心法,标准曲线采用四参数拟合。上述肿瘤标志物采用Roche公司Cobas e602电化学发光分析仪和配套Elecsys试剂检测;免疫标志物sPD-1、sPD-L1和IFN-γ采Thermo公司Multiskan FC酶标仪检测,试剂盒为上海爱必信公司产品。
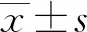
2 结 果
2.1各组肿瘤标志物水平比较 消化道肿瘤组CEA为18.35 (6.12,112.05)ng/mL,肺癌组CEA 为9.46(2.89,194.65)ng/mL,均高于肺炎组的1.73(1.48,3.56)ng/mL和体检组的1.46(1.27,1.92)ng/mL(P<0.01);消化道肿瘤组CA125为95.15(14.17,424.15)U/mL,高于肺炎组的14.11(5.96,34.56)U/mL(P<0.05);肺癌组CA153为13.17(8.27,25.58)U/mL,高于肺炎组的5.18(3.74,10.24)U/mL(P<0.05);消化道肿瘤组CA199为244.30(26.99,1 000.00) U/mL,高于体检组的8.05(6.35,12.82)U/mL(P<0.01);消化道肿瘤组CA724为7.03 (2.38,15.56)U/mL,高于肺炎组的1.54(0.77,3.11)U/mL(P<0.05);肺癌组Cyfra211为5.54(3.94,30.40)ng/mL,消化道肿瘤组Cyfra211为10.40 (5.27,108.65)ng/mL,均高于体检组的2.09(1.17,2.72)ng/mL和肺炎组的1.47(1.20,3.62)ng/mL(P<0.01);肺癌组NSE为17.10(12.01,34.87)ng/mL,高于体检组的11.14(9.41,12.99)ng/mL(P<0.05)。见图1。
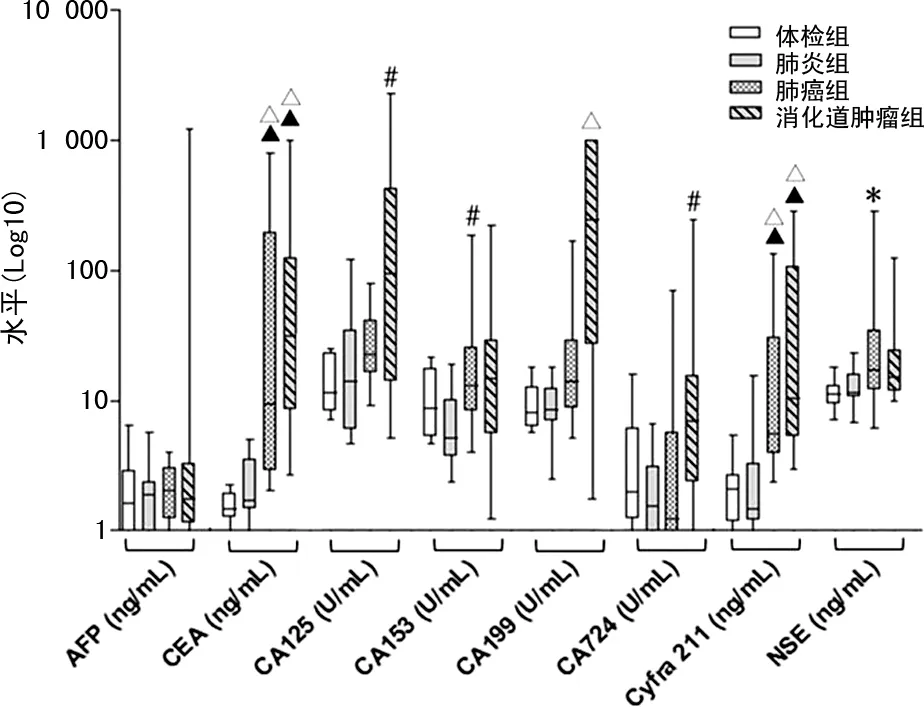
注:与体检组比较,△P<0.01;与肺炎组比较,▲P<0.01;与体检组比较,*P<0.05;与肺炎组比较,#P<0.05。
2.2各组免疫指标水平比较 肿瘤患者的sPD-1和sPD-L1水平有升高的趋势,其中消化道肿瘤组sPD-1为480.51 (235.34,4 745.00)pg/mL,显著高于体检组的182.13(104.79,320.37)pg/mL(P<0.05),sPD-L1/IFN-γ为27.32(5.15,194.01),高于肺炎组的5.39(2.99,7.48)(P<0.01);各组IFN-γ水平比较,差异无统计学意义(P>0.05)。见图2。
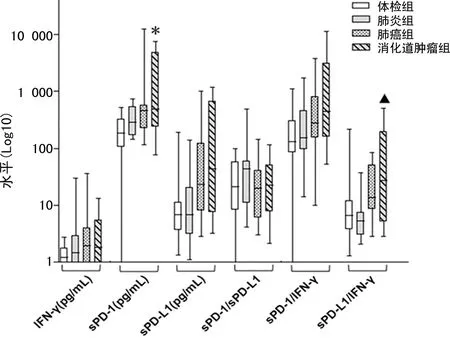
注:与体检组比较,*P<0.05;与肺炎组比较,▲P<0.01。
2.3不同水平肿瘤标志物和IFN-γ对sPD-1、sPD-L1的影响 34例肿瘤患者并非进行所有肿瘤标志物和免疫标志物的检测,其中CA125/CA153/CA724/Cyfra211各有2例患者未做检测因而未纳入统计。以肿瘤患者各项肿瘤标志物和IFN-γ水平中位数作为界值将其分为高水平和低水平,分析同水平肿瘤标志物和IFN-γ对sPD-1和sPD-L1表达高低的影响,结果显示仅IFN-γ水平对sPD-1和sPD-L1水平有影响(P<0.01)。见表1。

表1 不同水平肿瘤标志物和IFN-γ对sPD-1、sPD-L1的影响(n)
2.4各项免疫指标的相关性分析 在肺癌组、消化道肿瘤组及所有肿瘤患者中,sPD-1和sPD-L1呈正相关;在肺炎组中,IFN-γ与sPD-L1呈正相关。见图3。

注:A为肺癌组;B为消化道肿瘤组;C为肺癌组+消化道肿瘤组;D为肺炎组。
3 讨 论
近年来随着肿瘤免疫调控机制的逐渐清晰,PD-1/PD-L1作为新兴的生物标志物,其作用和价值在抗肿瘤疗效预测、病情监测和预后评估中得到迅速拓展[2]。PD-1作为共抑制分子广泛表达于T细胞等多种免疫细胞表面,在免疫平衡中发挥重要作用。肿瘤浸润淋巴细胞(TIL)持续高表达的PD-1被认为是T细胞耗竭的重要标志之一,在多种肿瘤的治疗中显示出一定的预测价值,同时也是目前ICB疗法最集中的抑制靶点[3]。PD-L1是PD-1的配体,组成性表达于多种免疫细胞,在激发后其表达上调。多种肿瘤细胞和肿瘤微环境中抗原呈递细胞亦高表达PD-L1,其与TIL上的PD-1结合,激活PD-1/PD-L1通路引起T细胞内一系列事件,最终导致T细胞耗竭、凋亡和肿瘤免疫耐受[4]。PD-L1在肿瘤组织中的表达水平是基于PD-1/PD-L1通路的多种ICB疗法的重要疗效预测标志物,近年来在肿瘤免疫治疗中得到了充分的发掘,PD-L1及其联合TIL浸润程度、IFN-γ共表达以及T细胞免疫球蛋白粘蛋白-3(TIM-3)等其他免疫检查点分子的共表达等特征成为评价TIL状态、划分肿瘤微环境免疫类型、选择合适疗法、预判获益人群以及预后评估的重要工具[4]。
sPD-1是PD-1的可溶性形式,近年来发现其具有重要的免疫调节作用。sPD-1是全长PD-1(flPD-1)mRNA剪接体的翻译产物之一,能与PD-L1结合从而阻断其与膜型PD-1(mPD-1)结合,具有抵抗T细胞抑制的功能;sPD-1能够促进树突状细胞(DC)的成熟从而提高T细胞的抗肿瘤效应。肿瘤特异性T细胞是sPD-1的主要来源,多种肿瘤患者sPD-1水平升高,提示其具有肿瘤生物标志物的潜能。有研究表明,sPD-1在肝癌、胰腺癌、晚期食管癌等多种肿瘤治疗前的高表达与疾病严重程度、临床病理特征及预后有关[5-7]。在乙型肝炎病毒(HBV)相关的肝细胞癌(HCC)中,通过评估sPD-1水平对HBV载量和HCC风险的影响发现,sPD-1水平升高的纵向效应有助于维持长期较高的病毒载量,并且与肝癌风险呈正相关[8]。也有研究发现,sPD-1水平的稳定或升高与肝癌手术、鼻咽癌放疗和肺癌的表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)治疗的预后改善有关[9-11]。经EGFR-TKIs治疗的NSCLC患者sPD-1水平升高,与无进展生存期(PFS)和总生存期(OS)的提高有关;使用PD-1单抗治疗后,sPD-1水平稳定或升高的NSCLC患者PFS和OS也得到改善[12],可能提示sPD-1对免疫抑制的抵抗能引起肿瘤特异性细胞毒性T细胞再激活。
sPD-L1是PD-L1的可溶性形式,主要由膜型PD-L1(mPD-L1)经基质金属蛋白酶(MMPs)剪切产生,通过与PD-1特异性结合发挥免疫抑制作用。sPD-L1可从PD-L1阳性的肿瘤细胞中释放,还来源于肿瘤微环境中的巨噬细胞、活化的DC等髓系细胞并受周围细胞因子、炎症环境等多因素调节。因此,sPD-L1水平是由患者的肿瘤负荷和肿瘤外炎性背景共同决定的。sPD-L1在多种肿瘤组织中表达,并已逐渐应用于肿瘤患者的病理特征、治疗反应和生存结局的预测[13-15]。高水平sPD-L1与肺癌、肝癌预后不良相关[14-15];sPD-L1还与肺癌的分期、淋巴结的转移、腹部的脏器转移等因素密切相关[16]。病情缓解的患者sPD-L1水平呈下降趋势,而病情进展的患者sPD-L1水平呈上升趋势,提示sPD-L1对PD-1阳性T细胞的抑制加强,有助于肿瘤细胞产生免疫逃逸。患者sPD-L1水平越高,机体免疫抑制越严重,预后越差。然而,亦有研究发现,在晚期胃癌患者的预后评估中,高水平的sPD-L1与肿瘤淋巴结转移无关,晚期胃腺癌患者sPD-L1水平越高,预后越好[17]。
sPD-1和sPD-L1可能在肿瘤的发病机制、免疫反应和疗效预测中发挥重要作用,但sPD-1/sPD-L1与肿瘤及mPD-1/mPD-L1之间的作用仍然十分复杂,现有的数据尚不能提供一致的预测模式。
本研究发现,在晚期肺癌和消化道肿瘤患者中,sPD-1和sPD-L1整体呈高表达,消化道肿瘤组sPD-1水平显著高于体检组,sPD-L1水平也具有一定的升高趋势;此外,肺癌组sPD-1、PD-L1和消化道肿瘤组sPD-1、sPD-L1水平范围较广,离散程度较大,推测一方面与患者病种和病理分型、分期的差异有关,另一方面也反映了肿瘤异质性和不同个体免疫反应强度的巨大差异。
本研究发现在肺癌组、消化道肿瘤组及全部肿瘤患者中,sPD-1与sPD-L1均呈正相关。sPD-1/sPD-L1的同步升高提示它们在免疫平衡中密切联系以对抗彼此消长的影响,即肿瘤特异性T细胞产生的sPD-1与癌细胞等分泌的sPD-L1维持一种有利于肿瘤细胞的免疫内稳态[18],sPD-1提升对sPD-L1/mPD-1的抵抗作用以避免T细胞过度抑制;相反,sPD-L1的增加进一步作用于mPD-1以加强T细胞抑制,增强肿瘤免疫逃避并导致不良预后。目前利用sPD-1缓解T细胞抑制的抗癌策略受到越来越多的关注,并在研究中显示出巨大的潜力[19]。
IFN-γ是由活化T细胞、自然杀伤细胞及巨噬细胞等释放的重要的抗肿瘤细胞因子,能够通过激活酪氨酸蛋白激酶2(JAK2)/信号传导与转录激活因子3(STAT1)通路抑制肿瘤细胞增殖,并通过上调肿瘤细胞表面组织相容性复合体抗原分子的表达促进杀伤性T细胞对肿瘤细胞的识别杀伤。同时IFN-γ也是PD-L1的最强诱导因素,在多种肿瘤中介导PD-L1上调进而激活PD-L1/PD-1通路并抑制T细胞的抗肿瘤免疫应答[20]。研究发现,IFN-γ与PD-L1双阳性患者的肿瘤细胞对治疗敏感,无病生存期较其他患者显著延长。IFN-γ与PD-L1双阳性的患者中,促进肿瘤生长的细胞周期相关基因的表达水平显著降低,因此IFN-γ和PD-L1双阳性表达可作为PD-1/PD-L1阻断治疗有效的预测指标[1,20]。高密度TIL是多种肿瘤患者的有利预后因素,肺腺癌组织中IFN-γ的表达量与癌巢中TIL数目和PD-1的表达量均呈正相关,表明IFN-γ的表达水平可反映肿瘤微环境中免疫应答的强弱。
本研究未发现IFN-γ在肿瘤和肺炎患者呈明显的高表达,然而在肺炎患者中IFN-γ与sPD-L1呈正相关,反映了炎症环境中sPD-L1对IFN-γ促炎性的平衡作用。本研究中肺癌组和消化道肿瘤组sPD-L1/IFN-γ相对于肺炎组及体检组有升高趋势,并且消化道肿瘤组显著高于肺炎组,可能提示IFN-γ对晚期肿瘤中sPD-L1的上调作用更为显著,体现了肿瘤内稳状态下外周循环中PD-L1的免疫抑制对IFN-γ的免疫促进优势。同时笔者发现在肿瘤患者中,不同IFN-γ水平的患者其sPD-1和sPD-L1分布有显著差异,反映了不同个体的免疫反应强度差异以及外周循环中IFN-γ/PD-L1/PD-1在参与肿瘤免疫调控中扮演着重要角色。本研究结果显示,反映肿瘤负荷的传统肿瘤标志物在肿瘤患者中多有不同程度的升高,但是与sPD-1/sPD-L1缺乏明显的相关性。以往的证据表明,sPD-1/sPD-L1的高表达与肿瘤的淋巴结转移关系密切[16],同时考虑到癌巢中TIL等免疫细胞密度以及mPD-1/mPD-L1表达的不同,晚期肿瘤患者外周循环sPD-1/sPD-L1水平整体呈高表达且又存在巨大个体差异的特征可能更具有划分患瘤机体整体的细胞免疫状态的潜在价值,进而可能为ICB疗法等免疫治疗及其他抗肿瘤治疗策略的选择提供方向性的指导作用,有待今后的深入研究。
目前临床常应用免疫组化法检测局部肿瘤组织中PD-1/PD-L1的表达,需要通过侵入性手段获取肿瘤组织,对于晚期非手术适应患者尤其是转移性肿瘤患者存在取材障碍的问题,并且组织样本检测技术平台标准难以统一,操作步骤复杂以及结果判定上存在主观差异,结果的可重复性不够理想,因此PD-1/PD-L1组织病理检测难以成为广泛适用的手段。而血清可溶性分子的检测具有无创性取材、能够动态连续观察指标变化的明显优势,并且在一定程度上可均质化肿瘤的异质性和多发转移性,能同时检测多个相关指标,更客观地反映机体整体的肿瘤免疫状态。sPD-1/sPD-L1的潜在应用价值已越来越受到关注,本研究仅为针对临床晚期肿瘤患者小样本量的探索,不同实体瘤病种及分期、分型中sPD-1/sPD-L1表达变化以及更精准的预后和治疗预测价值有待研究的进一步深入和拓展。
