纳米纤维素载体的超声辅助酶解法制备及表征
2021-11-26高骁隽
高骁隽, 李 灿
(延边大学附属医院 肾病科, 吉林 延吉 133000)
纤维素是一种丰富的可再生资源[1], 具有来源广泛、成本低等优点. 微晶纤维素(MCC)是重要的纤维素类型, 可用于医药等领域[2]. 但传统方法制得的MCC粒径大, 在溶液中分散不均匀, 这些缺点限制了其应用. 纳米载体的粒径较小, 其宽度约为5~70 nm, 长度为100 nm至几微米[3]. 通常, 纳米载体具有比表面积大、强度高、粒径小、细胞毒性低、生物相容性好和可生物降解等特性, 且不会引发免疫系统反应[4-5]. 近年来, 纳米晶体纤维素(NCC)作为纳米载体受到人们广泛关注. 多种官能团和生物活性分子可共价或非共价结合到NCC表面; NCC不能被肾脏清除, 具有良好的体内稳定性[6], 而巨噬细胞易将其从血流中转移到细胞中, 从而增强NCC的性能[7]. 因此, NCC在生物医学等领域应用广泛, 如生产屏障膜、抗菌膜、药物递送材料、组织工程和血管移植材料等[8-10].
目前多采用物理和化学方法制备NCC, 如蒸汽爆炸处理[11]、高压均质化[12]和酸/碱水解[13]等. 但传统的物理、化学制备方法有耗能大、易导致环境污染等缺点. 酶催化具有无污染、效率高和能耗低等优点[14]; 超声波具有均质化和加热效应, 还可增加酶与底物的接触面积, 加速酶与底物之间的反应[15-16]. 因此, 本文以MCC为原料, 采用超声辅助酶解法制备NCC, 并通过扫描电子显微镜(SEM)、粒度分析、Fourier变换红外光谱(FT-IR)和热重分析(TGA)对NCC进行表征和性质分析.
1 材料与方法
1.1 试剂和仪器
MCC购自国药集团化学试剂有限公司; 纤维素酶购自诺维信(中国)生物技术有限公司; 所有实验均使用去离子水; 其他化学品均为分析纯试剂.
S-3700N型扫描电子显微镜(上海日立高新技术集团); Zetasizer Nano ZS90型纳米粒度电位仪(英国马尔文仪器公司); IRPrestige-21型Fourier变换红外光谱(日本岛津公司); Q500TGA/DSC 1型热重分析仪(美国TA公司); Scientz-IID型超声破碎仪(宁波新芝生物科技股份有限公司); TGL-16型离心机(长沙盈泰仪器有限公司).
1.2 方 法
1.2.1 制备NCC
取5个250 mL锥形瓶, 先向每个锥形瓶中准确添加6 g MCC和200 mL 1 mol/L的Tris-HCl缓冲溶液(pH=7.0), 再添加终浓度分别为20,40,80,120,160 U/g的纤维素酶, 其中U定义为在50 ℃、pH=4.8条件下, 用纤维素酶水解滤纸1 min释放1 μg葡萄糖所需的酶量. 在恒温振荡水浴锅中, 于50 ℃水解12 h, 每隔2 h取样, 沸水浴5 min终止酶反应. 利用葡萄试剂盒法测定产生的葡萄糖量.
将所得反应液在超声破碎仪中以300 W的恒定功率处理1 h. 用离心机将混合物以3 000 r/min离心10 min, 以去除大于1 μm的颗粒. 将悬浮液以13 000 r/min离心10 min. 用去离子水洗涤沉淀, 沉淀物冻干保存.
1.2.2 SEM分析
用扫描电子显微镜观察, 样品进行喷金处理, 设置探针电流为 50 pA, 灯丝电流为2.7 A, 加速电压为10 kV, 工作距离为10 mm.
1.2.3 粒度分析
用纳米粒度电位仪分析样品的粒度分布. 取1.5 mL超声后的悬浮液, 沿比色皿壁缓慢加入, 防止产生气泡, 用聚苯乙烯测量池测量并进行分析, 以确定样品粒度分布和平均粒度.
1.2.4 FT-IR分析
将每个样品与溴化钾以质量比 1∶100 混匀后, 在玛瑙研钵中研磨至约 300目粉末, 于压片机上制成透明薄片. 用光谱仪在4 000~500 cm-1的波数范围内以4 cm-1光谱分辨率收集样品的FT-IR光谱, 在室温下进行64次扫描.
1.2.5 TGA分析
用热重分析仪测定样品的热稳定性. 以40 mL/min的恒定氮气流量进行分析, 确保质量变化归因于热降解. 样品以20 ℃/min升温, 在40~500 ℃测量随温度升高样品的质量损失或放出的热量.
2 结果与讨论
2.1 利用纤维素酶水解MCC
图1为纤维素酶浓度对葡萄糖产量的影响. 由图1可见, 用不同浓度纤维素酶水解MCC, 葡萄糖的释放量随时间延长而增加. 在20,40,80,120 U/g纤维素酶浓度下, 葡萄糖释放量增长较缓慢, 而在160 U/g纤维素酶作用下, 葡萄糖质量浓度增加较快, 在12 h时达到最大值, 为18.83 g/L. 通过纤维素酶的催化作用, 微晶纤维素被降解, 释放出葡萄糖, 同时微晶纤维素的大小及结构发生变化.

图1 纤维素酶浓度对葡萄糖产量的影响Fig.1 Effect of cellulase concentration on glucose yield
2.2 SEM结果
样品MCC和NCC的SEM照片如图2所示. 由图2(A)可见, 未经处理的MCC呈长杆状, 表面形态粗糙, 长度为几十到几百微米. 通常, MCC由数百个单独的小纤维素晶体以氢键连接构成[17], MCC表面粗糙, 可被纤维素酶水解生成纳米纤维素晶体[18]. 由图2(B)可见, MCC经超声辅助酶解处理后, 长杆状的MCC片段化, 形成粒状的NCC.
2.3 粒度分析结果
样品MCC和NCC的粒度分析结果如图3所示. 由图3可见, MCC样品的长度为2.67~5.56 μm, 平均长度为3.88 μm. NCC样品粒径和平均粒径显著降低, 直径为10.10~18.17 nm, 长度为531.20~1 106.00 nm. 结果表明, 经超声辅助酶解后, MCC的粒径减少, 形成了纳米级粒径的NCC[19].

图2 样品MCC(A)和NCC(B)的SEM照片Fig.2 SEM images of MCC sample (A) and NCC sample (B)
2.4 FT-IR分析结果
通过FT-IR研究超声辅助酶水解MCC生成NCC的化学结构变化, 结果如图4所示. 由图4可见, 3 400~3 100 cm-1间的峰值强度与—OH基团的拉伸振动有关[20]. 与MCC相比, NCC在该处的峰强度降低, 表明NCC分子间氢键被破坏. 1 621 cm-1附近的特征峰与水分子有关, 与MCC相比, NCC在该处的峰强度降低, 表明NCC吸收水分子的能力减弱[21]. 结果表明, MCC分子内、分子间氢键被破坏, 微晶纤维素被有效降解成NCC.

图3 样品MCC和NCC的粒度分布Fig.3 Particle size distribution of MCC and NCC samples
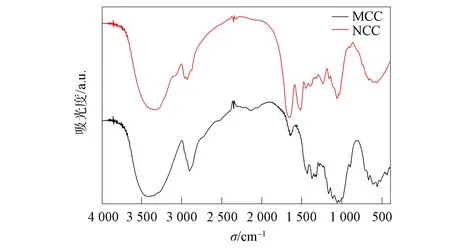
图4 样品MCC和NCC的FT-IR光谱Fig.4 FT-IR spectra of MCC and NCC samples
2.5 TGA分析结果
图5(A)和(B)分别为样品MCC和NCC的TGA和微商热重(DTG)曲线. 由图5可见, 样品的热谱存在3个阶段. 第一阶段在低温(<150 ℃)范围内, 由于水分或低分子量化合物的蒸发, 因此样品MCC和NCC的质量减小, 损失不超过总质量的3%. 第二阶段对应纤维素降解过程, 样品MCC在320~400 ℃内质量大幅度下降, 发生最大质量下降时的温度为370 ℃; 样品NCC分解起始温度为170 ℃, 最大分解速率的温度为380 ℃, 在410 ℃分解完成. 与MCC相比, NCC的热稳定性降低[22], 这是因为超声辅助的纤维素酶水解使NCC的分子量降低, 比表面积增加, 暴露出更多的活性基团, 导致热稳定性降低[23]. 与硫酸水解法[24]相比, 本文获得的NCC样品具有更好的热稳定性. 在第三阶段, 焦化残渣氧化和分解, 形成低分子量的气态产物. 样品MCC和NCC的残炭量分别为8.67%和28.16%.
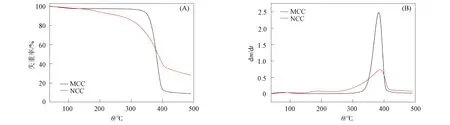
图5 样品MCC和NCC的TGA曲线(A)和DTG曲线(B)Fig.5 TGA curves (A) and DTG curves (B) of MCC and NCC samples
综上所述, 本文以MCC为原料, 采用超声辅助酶解法制备了纳米纤维素载体(NCC), 远小于MCC的颗粒尺寸, 其直径为10.10~18.17 nm, 长度为531.20~1 106.00 nm. 与MCC相比, NCC中纤维素结构变化主要为氢键减少. 超声辅助酶解法制备NCC的过程具有绿色、温和、高效等优点, 且制备NCC的稳定性较好, 因此该方法在生物医学等领域应用前景广阔.
