维生素A对呼吸道上皮细胞线粒体功能的作用机制
2021-11-26曹海霞黄登亮张耀刚袁馥梅马艳艳
张 轩,侯 静,曹海霞,黄登亮,张耀刚,袁馥梅,马艳艳
0 引 言
维生素A(Vitamin A, VA)是一种机体所必需、能维持细胞正常代谢且极易被忽视并造成缺乏的脂溶性维生素。在促进呼吸道上皮细胞增殖、分化中起重要的作用[1- 2]。临床研究发现血清VA水平与儿童呼吸道感染关系密切,机体VA越低,呼吸道感染的概率越高,感染症状越严重[3],这可能与适当浓度VA能促进免疫细胞的分化成熟、提高机体的免疫能力有关[4]。众所周知线粒体是细胞的动力源泉,并且在调节免疫细胞激活、分化过程中也起着重要作用[5],线粒体DNA能够激活主要的先天免疫信号通路[6]。研究显示免疫反应程度与细胞代谢状态有关,而线粒体作为细胞代谢的主要细胞器,对维持和建立免疫应答至关重要[7]。如氨基酸代谢影响T细胞分化和巨噬细胞极化;三羧酸循环部分中间产物,也参与了先天性和获得性免疫与炎症反应的部分过程[8]。因此,VA可能会通过影响线粒体功能对呼吸道上皮细胞起到一定的保护作用。故本研究通过用VA处理人主支气管上皮细胞(HNTEC),检测线粒体相关指标的变化,初步探索VA对呼吸道上皮细胞线粒体功能的作用。
1 材料与方法
1.1 实验材料
1.1.1 细胞株人正常主支气管上皮细胞(HNTEC)购自中国科学院细胞库。
1.1.2试剂与仪器维生素A(Selleck,S5592),二甲基亚砜DMSO(Solarbio,D8370),特级胎牛血清(Biological Industries,04-001-1ACS),0.25%胰酶(Gibco,27250018),1640培养基(Gibco,23400-021),CCK-8试剂盒(TransGen,FC101-04),Taq DNA聚合酶(Invitrogen),质粒抽提试剂盒(Qiagen),DNA纯化试剂盒(Sangon Biotech),Trizol(TaKaRa,9109),反转录试剂盒(TransGen,AT311-03),FastStart Universal SYBR Green Master(Roche,04913914001),细胞成像微孔板检测系统(BioTek Cytation5),细胞能量代谢分析仪(Agilent Seahorse XFe 96),实时荧光定量PCR仪(LightCycler© 480),超微量核酸蛋白浓度测定仪(Nanodrop 2000C)
1.2方法
1.2.1VA处理浓度的筛选将HNTEC细胞以100 μL,1×104个/孔接入96孔板,分为对照组、VA-0.1 mg/L组、VA-0.5 mg/L组、VA-2 mg/L组、VA-4 mg/L组、VA-8 mg/L组、VA-16 mg/L组、VA-32mg/L组,每组5个复孔,培养24 h后加入10 μL CCK8溶液,37 ℃、5% CO2培养箱中孵育2 h,450 nm波长检测吸光值,根据吸光值计算细胞存活率[9]。最终确定VA的给药量为0.1、0.5、2 mg/L。
1.2.2细胞样本的制备本实验均采用复苏后传至同一代的细胞进行实验。将细胞置于37 ℃、5% CO2培养箱中,用含有10%胎牛血清的1640细胞培养基培养,根据细胞状态及数量,每1~2天进行传代。取对数生长期的HNTEC细胞,弃掉旧培养基,2 mL 1×PBS洗1遍,1 mL 0.1%胰酶消化后制备成细胞悬液,以1.3×106个/皿的细胞密度接种90 mm培养皿,随机分为对照组、VA-0.1 mg/L组、VA-0.5 mg/L组、VA-2mg/L组加入相应浓度的VA,在37 ℃、5% CO2培养箱中培养24、48 h,收集细胞后存入-80 ℃冰箱备用。
1.2.3细胞线粒体能量代谢分析将HNTEC细胞以80 μL,7×103个/孔接种于Seahorse XFe 96孔检测板,接种细胞时同时加入不同浓度VA,每组3个复孔,将接种好的细胞静置20 min后放入培养箱培养;24 h后,以同样方式接种细胞,继续培养24 h后,用Seahorse XFe线粒体压力检测试剂盒检测上述各组细胞的线粒体功能状态。在Seahorse XFe细胞代谢分析时依次用寡霉素、FCCP、鱼藤酮/抗霉素A干预线粒体电子传递及氧化磷酸化,并实时监测记录细胞耗氧率;通过专用分析软件Wave处理所测数据,得到线粒体代谢相关的参数。实验中使用寡霉素、FCCP、鱼藤酮/抗霉素A浓度分别为2、1.5、0.5 μmol/L。
1.2.4线粒体DNA拷贝数分析线粒体DNA标准品的制备[10]:用Platinum© Taq DNA聚合酶对MT-CYB基因片段进行PCR扩增,产物经琼脂糖凝胶电泳后,胶回收纯化,克隆至pEASY-T1载体(3829 bp)中,转化至感受态细胞并克隆至大肠埃希菌扩增后,筛选鉴定含有插入片段的阳性菌株并提取质粒,提取的质粒作为标准品。
细胞线粒体DNA拷贝数分析:使用酚-氯仿法提取细胞样本的DNA,测定DNA浓度。以无菌去离子水10倍梯度稀释MT-CYB重组质粒,制备浓度为103~108拷贝/μL的荧光定量PCR标准曲线模板;将待测样品稀释为5 ng/μL。总反应体系为15 μL,DNA 2 μL、2×SYBR Green 7.5 μL 、上下游引物(10 μmol/L)共3 μL、ddH2O 2.5 μL,使用实时荧光定量PCR仪进行不同浓度梯度标准品与待测样品MT-CYB基因定量PCR扩增,扩增条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸34 s,共40个循环。根据标准曲线计算待测样品中线粒体DNA拷贝数。
1.2.5线粒体自噬相关基因P62的表达Trizol法提取待测样品中的总RNA,测定浓度,反转录为cDNA。使用实时荧光定量PCR仪进行待测样品扩增,总反应体系为15 μL,cDNA 2 μL、2×SYBR Green 7.5 μL、上下游引物共3 μL、ddH2O 2.5 μL,扩增条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火、延伸34 s,共40个循环。P62基因上游引物:5'-TGTGTAGCGTCTGCGAGGGAAA-3',下游引物:5'-AGTGTCCGTGTTTCACCTTCCG-3';GAPDH基因上游引物:5'- ACCACAGTCCATGCCATCAC -3',下游引物:5'-TCCACCACCCTGTTGCTGTA -3';CYB上游引物:5'- ATGACCCCAATACGCAAAACTAAC-3',下游引物:5'-GGCCCATTTGAGTATTTTGTTTTCA-3'。P62基因的表达采用-ΔΔCT法分析,GAPDH为内参基因。
2 结 果
2.1 VA提高人主支气管上皮细胞线粒体有氧代谢功能实验结果显示VA处理HNTEC细胞24 h后线粒体耗氧量相较于对照组增高,处理浓度为0.5 mg/L时细胞线粒体耗氧量最高、ATP生成最多、最大呼吸潜能最高、质子漏增加;处理48 h,0.1、0.5 mg/L处理组的结果与24 h一致,VA为2 mg/L时结果相较于对照组降低,差异有统计学意义(P<0.05),见图1。
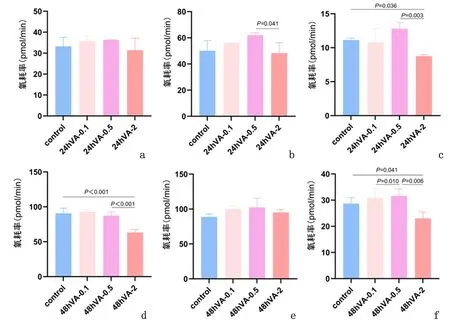
a、d:分别为24、48 h ATP产生; b、e:分别为24、48 h最大呼吸潜能; c、f:分别为24、48 h质子漏
2.2VA增加人主支气管上皮细胞线粒体拷贝数与对照组和VA-0.1 mg/L组比较,VA-0.5 mg/L组、VA-2 mg/L组24 h线粒体拷贝数明显升高(P<0.01);VA-2 mg/L组、VA-0.5 mg/L组24 h线粒体拷贝数较VA-0.1 mg/L组明显升高(P<0.01);VA-2 mg/L组24 h线粒体拷贝数较VA-0.5 mg/L组明显升高(P<0.05)。与对照组比较,VA-0.1 mg/L组48 h线粒体拷贝数明显升高(P<0.01);VA-2 mg/L组、VA-0.5 mg/L组48 h线粒体拷贝数较VA-0.1 mg/L组明显降低(P<0.01);VA-2 mg/L组48 h线粒体拷贝数较VA-0.5 mg/L组明显降低(P<0.01)。见表1。

表 1 VA处理后HNTEC细胞线粒体DNA拷贝数的变化
2.3VA抑制人主支气管上皮细胞线粒体自噬结果表明在VA处理24、48 h后,P62基因的表达较对照组明显升高,且随着VA浓度的增加而增加,差异有统计学意义(P<0.01),但在48 h,干预浓度为2 mg/L较0.5 mg/LP62基因表达稍降低(P<0.05)。见表2。

表 2 VA处理后HNTEC细胞P62基因的变化
3 讨 论
VA 缺乏是一个世界性的营养问题,尤其是在处于生长发育阶段的儿童,其维生素缺乏情况远较成人严重[11]。在发达国家,普通膳食VA的供给量也处于不足水平的边缘,我国属于中度缺乏国家,且VA缺乏地区分布不平衡,边远地区缺乏尤为严重,有调查显示抚顺地区2018年亚临床VA缺乏为10.5%,可疑亚临床VA缺乏达45.3%[12]。既往研究显示VA是有效的炎症反应调节因子[13-14],在影响Th细胞分化维持免疫平衡[15]、保持上皮细胞完整性有关键作用[16],但关于VA对呼吸道上皮细胞的作用机制研究鲜有报道。因此,明确VA的作用机制对预防反复呼吸道感染的发病有较为重要的临床意义。研究发现体内VA代谢中间产物9-顺式维甲酸、全反式维甲酸可通过RIP140/PGC-1α轴诱导人神经细胞线粒体形态和功能成熟[17]。增加膳食VA的摄入水平可以上调控制线粒体DNA转录和复制的经典转录因子TFAM水平,显著增加线粒体生物发生和耗氧量[18]。同时维甲酸(Retinoic acid ,RA)促进了与线粒体生物发生有关的PGC-1α基因表达水平,增加了线粒体含量标志物SDHA-1水平,还可以影响骨骼肌细胞、肝细胞线粒体功能[19-20]。由此推测VA可能会通过调节呼吸道上皮细胞线粒体功能影响机体状态。故本研究首先通过细胞能量代谢仪分析不同浓度VA处理HNTEC细胞的线粒体代谢水平,检测指标包含基础氧耗、ATP生成量、线粒体最大耗氧能力、细胞呼吸潜力等。结果显示0.1、0.5 mg/L VA处理组较对照组线粒体ATP生成、最大呼吸能力增加,而高剂量的VA反而会降低ATP生成。提示适量VA可以增强线粒体功能。线粒体自噬是线粒体质量控制的重要机制[21],因此通过检测线粒体DNA拷贝数及线粒体自噬相关基因P62的水平来探索VA影响线粒体功能的可能机制。
线粒体DNA拷贝数代表了每个细胞的线粒体数目及线粒体基因组数目,是衡量线粒体功能的指标之一[22]。线粒体DNA拷贝数的减少可能直接引起线粒体数量下降、损害线粒体呼吸功能甚至引发细胞凋亡[23]。p62作为多种泛素化底物选择性自噬受体的载体,是线粒体自噬信号通路中的重要连接蛋白,通过与LC3结合来将泛素化蛋白、受损的线粒体转移到自噬小体中将其降解。自噬过程被抑制会导致p62积聚,因此其含量与自噬水平成反比[24]。本研究结果提示短时间内随着VA浓度的增加,细胞线粒体DNA拷贝数、P62基因的表达水平增高;而长时间高剂量的VA处理后细胞线粒体DNA拷贝、P62基因的表达则降低。表明适当的VA补充能增加线粒体数量及线粒体代谢状态,促进细胞代谢;但长时间大量给予VA反而会影响线粒体功能,可对细胞造成代谢负担。这验证了RA的水平必须受到严格控制,缺乏或过量都会导致机体代谢及各器官发育异常的报道[25],同时也提示适量补充VA可以促进呼吸道上皮细胞生长代谢。
综上所述,本研究提示VA可以通过降低线粒体自噬及增加线粒体DNA拷贝数增强正常呼吸道上皮细胞线粒体功能,但对炎症呼吸道上皮细胞是否有同样作用,有待进一步研究。同时VA是否通过RA信号通路调节人主支气管上皮细胞线粒体功能也是后续重点研究方向,以期为临床VA适量补充提供更多的理论支撑。