GSDME通过p53、caspase3增强小细胞肺癌细胞的紫杉醇敏感
2021-11-26高世华李植锋蔡键锋
高世华 李植锋 蔡键锋
肺癌根据组织形态学特征可分为小细胞肺癌(small-cell lung cancer, SCLC)和非小细胞癌(non-small-cell lung ancer, NSCLC),其中SCLC占据肺癌的15%~20%,与NSCLC比较,SCLC的侵袭性更强、早期转移率更高、预后效果更差[1]。SCLC对化疗较为敏感,第一疗程治疗后症状通常能得到改善,但很快会产生多药耐药性,导致其预后依然欠佳,中位总生存期不足6个月[2]。因此,探究增强SCLC对化疗药物的敏感度具有重要意义。随着科技的发展,多种细胞死亡形式被逐渐发现,包括细胞坏死(necrocytosis)、细胞凋亡(apoptosis)、细胞自噬(autophagy)以及细胞焦亡(pyroptosis)等。其中,细胞焦亡是一种介于凋亡与坏死之间的死亡方式,发生速度快,可诱发机体强烈的炎性反应。Gasdermin蛋白E(gasdermin E, GSDME)是细胞焦亡的最终执行蛋白,同时其剪切活化也是焦亡发生的标志[3]。由于GSDME可介导化疗药物引起的组织损伤,肿瘤中GSDME的表达量较高,此肿瘤可能对化疗药物更为敏感[4]。紫杉醇(paclitaxel,PTX)是一种有丝分裂抑制剂,是近年来最有效的广谱化疗药物之一,治疗晚期NSCLC有效率高达20%~42%[5]。本研究拟探讨过表达GSDME在紫杉醇治疗SCLC中的增敏作用及其可能的分子机制。
材料与方法
1.组织标本、细胞系和主要试剂:人小细胞肺癌细胞株(H69、H146、H209、H446、H1688、H2227)、人支气管上皮细胞株(16HBE)、过表达GSDME的H69细胞株(H69-GSDMEhight)购自广州赛业生物科技有限公司;RPMI-1640培养基、胎牛血清、青链霉素混合液(×100)购自美国 Gibco公司;p53通路抑制剂(PFT-α)、caspase3抑制剂(Ac-DEVD-CHO, DEVD)购自美国Selleck公司;GSDME、β-actin多克隆抗体购自上海圣克鲁斯生物技术公司;通用RT-PCR试剂盒、LDH细胞毒性试剂盒、CCK-8试剂盒购自北京索莱宝科技有限公司。
2.细胞培养:使用含10%小牛血清、1%青链霉素双抗的RPMI-1640培养基作为完全培养液,培养于37℃、5%CO2培养箱中。
3.实时荧光定量PCR(RT-qPCR)检测GSDME水平:利用Trizol法提取细胞总RNA,测定浓度和纯度后,反转成cDNA。以cDNA为模板,进行RT-qPCR,程序为预变性95℃,10min,变性95℃,10s,退火60℃,20s,延伸72℃,30s,40个循环。以GAPDH为内参进行分析,使用2-ΔΔCt法分析计算GSDME基因的相对表达量,每个样品均重复3次。引物: GSDME-上游引物:5′-CGTAGAGAGCCAGTCTTCATTT-3′; GSDME-下游引物:5′-GTTCCAGGACCATGAGTAGTTC-3′; GAPDH-上游引物:5′-CAAGGACCTCTACGCCAACAC-3′; GAPDH-下游引物:5′-TGGAGGCGCGATGATCTT-3′。
4.Western blot(WB)法检测GSDME蛋白表达:细胞分组处理后,收集细胞提取总蛋白,BCA法测定蛋白裂解液浓度,取等量蛋白进行SDS-PAGE电泳,然后将蛋白转至PVDF膜上。2%脱脂牛奶封闭;一抗4℃孵育过夜,洗膜后与二抗室温孵育30min; 洗膜后加ECL显影液,放入凝胶分析系统中曝光,拍照存储并用Image J软件分析计算各条带的灰度值,以每组目的蛋白和内参蛋白灰度值的比值表示各组蛋白的表达水平。
5.乳酸脱氢酶(lactic dehydrogenase, LDH)检测:细胞经药物处理后,收集各孔的上清液120μl,加入到一新的96孔板相应孔中,随即进行样品测定。用酶标仪测量A450值,根据标准曲线求出相应的LDH含量。具体步骤按试剂盒说明书操作。
6.CCK-8:收集对数生长期细胞,PBS洗涤后使用完全培养基重悬,浓度调至4×104个细胞/毫升,以100微升/孔接种于96孔板。培养箱孵育过夜后,分别加入不同浓度的紫杉醇(0、30、60、80、100μmol/L)处理细胞,每组均有6个平行孔,药物作用时间分为0、4、8、12、16h。在各组实验终止前4h,加入现配的CCK-8溶液(10微升/孔),孵育培养4h后,酶标仪测定450nm处的吸光度,计算存活率,绘制曲线。
7.流式细胞术:使用不含EDTA胰酶消化并收集细胞,细胞筛过滤后进行计数,然后将细胞密度稀释调整为1×106个/毫升,用0.3ml Buffer缓冲液重悬细胞于流式。然后加5μl Annexin V-FITC,室温避光染色30min,再加10μl PI染液,室温避光染色20min,通过流式细胞仪仪检测细胞焦亡情况。
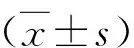
结 果
1.GSDME在SCLC细胞株中的表达:在SCLC细胞系H69、H146、H209、H446、H1688、H2227细胞中GSDME mRNA表达水平明显低于对照组16HBE细胞(P<0.01,图1A),且在H69细胞中的表达量最低(0.37±0.03)。在各细胞系中,GSDME蛋白表达水平的表达也显著低于对照组(P<0.01,图1B)。
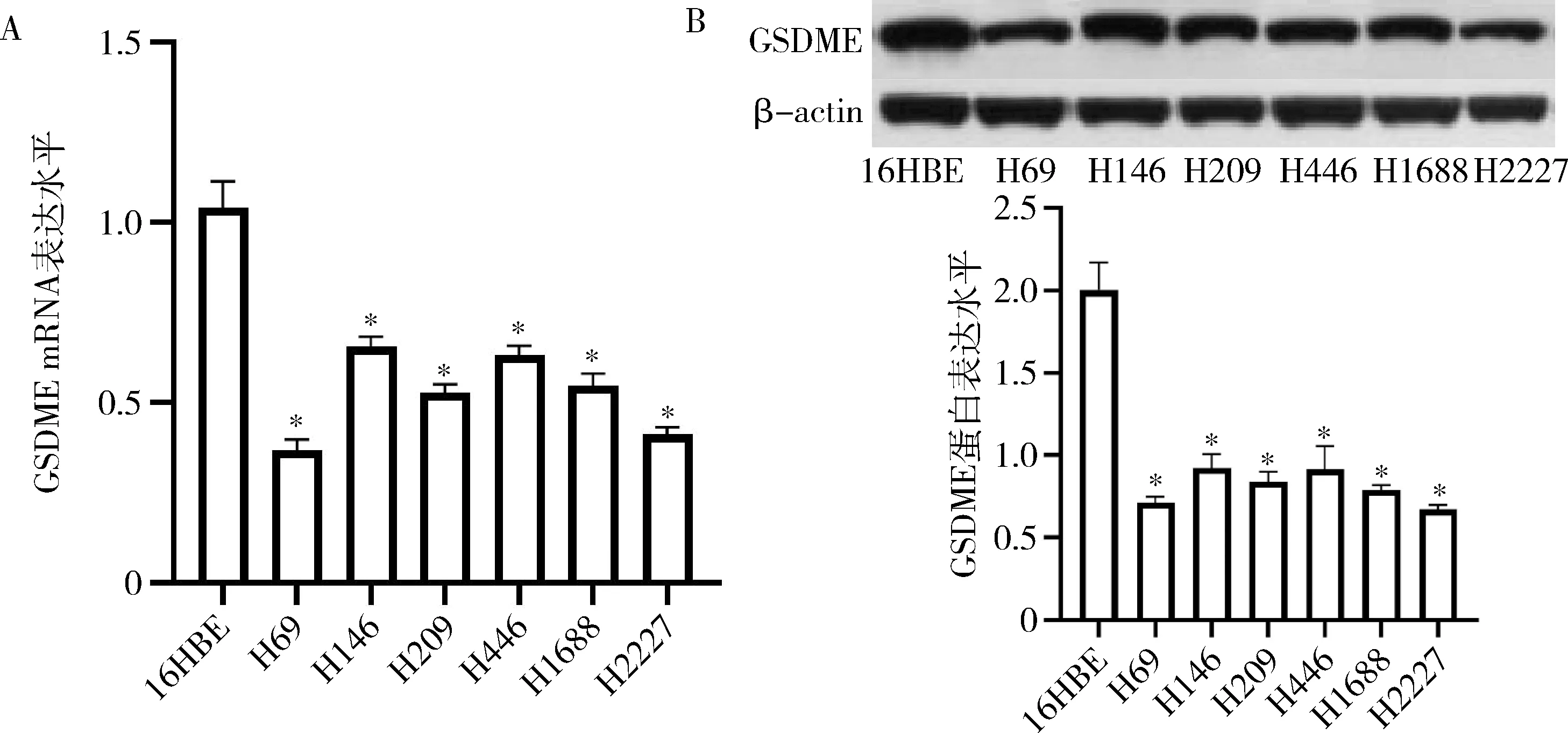
图1 GSDME在SCLC细胞株中的表达A.SCLC细胞株中GSDME mRNA的表达量;B.SCLC细胞株中GSDM蛋白的表达量;与16HBE细胞比较,*P<0.01
2.过表达GSDME增强SCLC细胞对紫杉醇的敏感度:与H69细胞组比较,经30、60、80、100μmol/L浓度紫杉醇处理后,H69-GSDMEhight细胞的生存率均显著降低(P<0.01,图2A);与H69细胞组比较,经紫杉醇作用4、8、12、16h后,H69-GSDMEhight细胞生存率均显著降低(P<0.05,图2B)。与0μmol/L紫杉醇处理组比较,GSDME-NT水平在30、60、80、100μmol/L紫杉醇处理组均显著增加(P<0.01);与30μmol/L紫杉醇处理组比较,GSDME-NT水平在60、80、100μmol/L紫杉醇处理组均显著增加(P<0.05);与60μmol/L紫杉醇处理组比较,GSDME-NT水平在80、100μmol/L紫杉醇处理组均显著增加(P<0.01,图2C)。
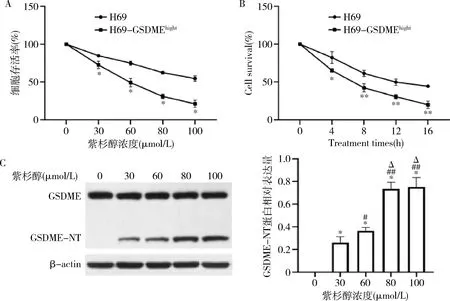
图2 紫杉醇影响SCLC细胞生存率和GSDME的切割A.紫杉醇处理剂量与细胞生存率的关系,与H69组比较,*P<0.01;B.紫杉醇处理时间与细胞生存率的关系,与H69组比较,*P<0.05,**P<0.01;C.紫杉醇诱发GSDME切割成GSDME-NT的剂量依赖性;与0μmol/L组比较,*P<0.01;与30μmol/L组比较,#P<0.05,##P<0.01;与60μmol/L组比较,ΔP<0.01
3.紫杉醇诱导过表达GSDME的SCLC细胞发生细胞焦亡:紫杉醇处理(80μmol/L,8h) H69-GSDMEhight细胞后培养上清中LDH酶活为17.70±1.10U/L,未处理组的LDH酶活力为5.53±0.53U/L,差异有统计学意义(P<0.01,图3A)。紫杉醇诱导H69-GSDMEhight细胞死亡以焦亡(Annexin-V FITC+/IP+细胞)为主(图3B)。

图3 紫杉醇诱导SCLC细胞的死亡方式A.LDH水平检测,与未处理组比较,**P<0.01;B.流式细胞术检测H69-GSDMEhight细胞的死亡方式
4.阻断p53或caspase3影响紫杉醇通过GSDME介导SCLC细胞焦亡:使用caspase3抑制剂(DEVD, 10μmol/L)和p53抑制剂(PFT-α, 10μmol/L)分别对H69-GSDMEhight细胞进行预处理,再经过紫杉醇(80μmol/L)处理,观察各组细胞焦亡情况。与PTX处理组比较,PTX+DEVD处理组和PTX+PFT-α处理组H69-GSDMEhight细胞中的GSDME-NT水平均显著降低(P<0.01,图4)。
讨 论
SCLC是一种起源于支气管黏膜上皮的神经内分泌肿瘤,其特点是恶性程度高、侵袭性高、进展快、早期出现远处转移,广泛期小细胞肺癌预后极差[6]。目前,对SCLC的治疗没有绝对有效的方案,因此探究新的治疗方法提高生存收益具有重要意义。近年来,细胞焦亡被证实是一种新的细胞程序性死亡方式,通过caspase家族蛋白切割并激活gasdermin家族蛋白,进而导致细胞膜穿孔和破裂,引起细胞内容物的释放诱导细胞死亡,并且伴随强烈的炎性反应[7]。已有多项研究报道GSDME介导了肿瘤患者化疗时的细胞焦亡[8]。本研究通过检测多株SCLC细胞中的GSDME的表达量,分析GSDME与SCLC的相关性。与对照相比较,SCLC肿瘤细胞系中DSDME的mRNA水平和蛋白水平均显著下调,说明GSDME的表达与SCLC的发生、发展可能存在关系。
临床上一线治疗对大多数SCLC患者均有较好的疗效,但是在治疗后2年内复发的患者甚多,尤其是广泛期患者2年复发率接近100%,患者复发后的平均生存时间也极低[9]。因此在患者体能状态允许情况下,临床多推荐建议复发者采纳二线化疗法,以期延长患者总生存期和无进展生存时间,减少肿瘤负荷。目前,二线化疗方案多是选择伊立替康、紫杉醇、多西他赛、吉西他滨中的一种药物与铂类联合用药[10]。化疗药物可通过细胞凋亡和继发性坏死等一系列调控细胞死亡途径诱导癌细胞死亡,有研究指出化疗药物诱导细胞焦亡过程由GSDME介导[11]。GSDME蛋白表达水平在不同肿瘤细胞中存在差异,其本底表达水平与化疗药物敏感度有着密切联系[12]。GSDME在大多数肿瘤组织中表达缺失或发生突变,有研究显示上调GSDME在肝细胞癌中的表达可使其增殖被显著抑制[13]。因此,本研究探讨了紫杉醇在过表达GSDME的SCLC肿瘤细胞的作用效果,结果显示过表达GSDME能够增强SCLC细胞对紫杉醇的敏感度。
细胞焦亡和凋亡是细胞程序性死亡的两种形式。与凋亡相反,细胞焦亡是肿瘤细胞继发性坏死的主要形式,它是由caspase-3依赖性的GSDME裂解引起的。GSDME蛋白裂解产生的GSDME-NT可在细胞膜上成孔,电解质失去平衡,细胞内容物外泄,进而导致细胞继发性坏死/焦亡,因此GSDME-NT也被认为细胞焦亡的标志性蛋白[14]。已知化疗药物可以通过激活caspase-3介导的细胞凋亡来杀死细胞,Wang等[11]研究发现,化疗药物在体外诱导GSDME细胞凋亡,使其被caspase-3裂解,该机制被认为是在细胞凋亡后引起继发性坏死。GSDME是抑癌基因p53的转录调控靶点,协同p53参与了肿瘤细胞的DNA损伤应激等[15]。本研究通过caspase-3抑制剂和p53抑制剂分别处理过表达GSDME的SCLC细胞,会显著降低紫杉醇导致的GSDME活化,即阻断紫杉醇诱导SCLC细胞的焦亡。
综上所述,GSDME在SCLC中低表达,体外通过过表达细胞中GSDME的表达,能够有效增强SCLC细胞对紫杉醇的敏感度,且该过程受p53、caspase-3活化的影响。本研究结果表明GSDME在SCLC的治疗中具有一定的研究价值,为深入了解SCLC的发病机制提供了理论依据。
