胃癌根治术后不同淋巴结取材方式的临床价值
2021-11-26刘宥苡王嘉鑫沈仕俊胡义波代佑果
刘宥苡 王嘉鑫 吕 煜 沈仕俊 胡义波 代佑果
胃癌是常见的消化道恶性肿瘤,其发生率和病死率分别居全球癌症发生率和病死率的第5位和第4位[1]。在我国,以死亡例数排序,胃癌居于全性别癌症死亡第2位;以发病例数排序,胃癌居于最常见癌种的第3位[2]。目前,以TNM分期为导向制定个体化诊疗方案是胃癌治疗的基本原则,在TNM分期系统中,淋巴结转移状态具有更大的可变性,直接影响N分期的准确性[3]。对于可手术胃癌患者来说,根治性手术是胃癌的主要治疗手段,术后病理诊断是术后辅助治疗选择的重要参考依据,其中淋巴结病理信息对于患者的预后评估以及最佳辅助治疗方案选择十分重要[4,5]。离体标本淋巴结取材数目是否达到能准确评估临床病情的标准是手术质量控制的重要评价指标[6]。然而,各种原因导致我国胃癌根治术后淋巴结检出率处于较低水平。本研究拟通过淋巴结取材总数、转移性淋巴结数、取材耗时等方面分析胃癌根治术后标本精细淋巴结分拣与区块分拣的优缺点,评估区块淋巴结取材的临床应用价值。
对象与方法
1.研究对象:收集2018年9月~2020年12月就诊于云南省肿瘤医院并接受胃癌根治术的116例胃癌患者的临床病理资料。根据随机抽样决定胃癌根治术后淋巴结取材方式,并将病例分为A组和B组,A组(59例)为精细淋巴结分拣组,B组(57例)为区块淋巴结分拣组。病例选择标准:①术前病理确诊为胃癌;②接受规范胃癌根治术(全胃切除/胃大部切除)+淋巴结清扫(D1/D1+/D2)的患者;③患者临床和病理资料完整;④患者术后病理证实为R0切除。该研究符合《世界医学大会赫尔辛基宣言》,书面知情同意书得到了患者同意,方案获得云南省肿瘤医院医学伦理学审查委员会的批准(批准号:KY201724)。
2.淋巴结取材方法:因胃周淋巴结主要沿胃周血管和腹腔干及其三大分支根部排列,淋巴结清扫完全需使得腹腔干及其分支周围达到完全脉络化,No.8组、No.9组、No.10组、No.11p组、No.12a组等淋巴结在术中更易准确分组,上述淋巴结由主刀医生在术中完成分拣收集。而离体标本所含的淋巴结(No.1组、No.2组、No.3a组、No.3b组、No.4sa组、No.4sb组、No.4d组、No.5组、No.6组、No.7组等)根据随机分组确定的取材方式进行分拣。具体取材方法如下:①精细分拣法:胃癌根治术离体标本由外科医生按照胃周各区域淋巴结部位(图1)进行精细分拣,将每一组别的淋巴结与其周围组织(血管、神经、脂肪等)逐一精细分离,并记录取材时长,随后分装固定送病理检测;②区块分拣法:胃癌根治术离体标本由外科医生根据胃周血管解剖,准确标记淋巴结组别后将不同组别淋巴结连同周围组织一起分剪固定(图2),并记录取材时长,分装固定后送病理检测。

图1 精细分拣示意图

图2 区块分拣示意图
3.观察指标:记录不同组别所有患者的N分期情况、淋巴结送检总数、淋巴结阳性数等临床病理指标以及取材时长,将上述指标进行比较分析。
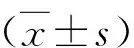
结 果
1.一般资料:两组患者性别、年龄、手术方式(开腹、腹腔镜)、T分期(T1、T2、T3、T4)、手术部位(近端胃、远端胃、全胃切除)、体重指数(BMI)等比较,差异均无统计学意义(P>0.05,表1),两组资料具有可比性。
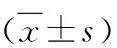
表1 两组患者一般资料比较
2.两组淋巴结总数及阳性淋巴结数比较:A组淋巴结总数为42.75±16.52枚,B组淋巴结总数为36.51±14.04枚,两组比较差异有统计学意义(P<0.05)。A组阳性淋巴结数目为1(0,10)枚,B组阳性淋巴结数目为3(0,11)枚,两组比较差异无统计学意义(P>0.05,表2)。
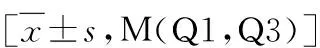
表2 两组患者临床病理指标及取材时长比较
3.两组患者N分期比较:A组N0期(无淋巴结转移)患者共计27例,N1期(1~2枚淋巴结转移)患者为8例,N2期(3~6枚淋巴结转移)患者为7例,N3a期(7~15枚淋巴结转移)患者为9例,N3b期(大于15枚淋巴结转移)患者为8例;B组N0期患者共计17例,N1期患者为8例,N2期患者为10例,N3a期患者为12例,N3b期患者为10例,两组比较差异无统计学意义(P>0.05,表2)。
4.两组取材时长比较:A组取材耗时为81.86±15.33min,B组取材耗时为27.39±3.81min,两组比较差异有统计学意义(P<0.05,表2)。
讨 论
胃癌淋巴结转移的恶性生物学行为贯穿整个疾病过程,是术后复发和死亡的独立影响因素,与预后密切相关[7]。胃癌淋巴结转移数目是胃癌分期的重要指标,对于没有淋巴结转移的病例而言,检出15枚以上淋巴结可以显著提高患者预后。对于无淋巴结转移的低分化、未分化癌病例而言,清扫20枚以上淋巴结可以提高远期生存[8]。我国多中心研究显示,送检淋巴结数目必须不低于16枚才能保证术后病理学分期考虑为pN0期患者的淋巴结分期准确[9],而非早期胃癌最佳的术后送检淋巴结数目应≥30枚才能达到准确评估患者预后的要求[10]。可见,术后收集足够的淋巴结信息才能更全面地了解患者的淋巴结转移情况,协助明确分期、制定治疗方案,在此基础上的个体化诊疗更符合大数据时代精准医疗的发展方向[11]。
虽然胃癌根治术淋巴结清扫范围已在全球范围内达成共识,但各国之间的淋巴结取材数目仍有较大差异。在日本胃癌根治术后平均淋巴结取材送检数目为39.4枚,居全球第1位;在韩国平均送检淋巴结数目为34枚,仅次于日本[12]。而我国胃癌术后标本通常由病理科医生进行分拣,平均淋巴结检出数仅为24.8枚,明显低于国际水平[6]。我国既往并没有相关的共识指导术后淋巴结取材,取材方式不同可能会导致检出淋巴结数目发生偏倚[13]。由于对规范化淋巴结送检的认识尚有不足,取材、送检过程中会出现淋巴结漏检,导致淋巴结信息不够全面[14,15]。而我国进展期胃癌患者占主体,有必要提高胃癌根治术后送检淋巴结数目以保证淋巴结转移分期的准确率[16]。推广普及易操作、易统一且准确性较高的淋巴结取材方式是促进淋巴结取材规范化的重要途径。
本研究结果表明,从淋巴结清扫总数目来看,对胃癌根治术后离体标本进行精细分拣相较于区块分拣能明显提高淋巴结检出率,这与以往报道的研究结果相同[12]。淋巴结精细分拣的确为术后提供了更为全面的淋巴结分布信息,但从N分期和淋巴结转移数目方面看,区块分拣相较于精细分拣取材并无明显的劣势,这可能是由于两种取材方式所获取的转移性淋巴结数目已接近实际值且趋于稳定。而且,从两组的取材时间来看,精细取材耗时明显多于区块分拣。在临床工作中,精细淋巴结取材需要有专业的取材条件,如取材室、冰箱等,还需要专门的外科医生进行操作。而区块分拣相对比较容易操作,只需术后由手术医生或助手按照淋巴引流区域将胃周淋巴脂肪组织剪下固定分装,在手术室即可完成。此外,无论何种取材方式,标本从离体到固定的时间不宜过长,一般建议在半小时内完成固定[17]。离体标本长时间未固定保存,可能会导致组织结构破坏、蛋白质变性,从而增加影响病理检查的干扰因素,尤其影响HER-2检测结果[18]。本研究显示淋巴结精细分拣耗时明显多于区块分拣,虽然这可能与分拣者对胃周淋巴结定位、淋巴结与周围组织的区分等方面的熟练程度相关,但更重要的原因是,精细分拣需要仔细解剖胃周血管、网膜、脂肪等组织,尽可能获取所有可发现的淋巴结,由此增加了时间成本的投入。
综上所述,基于卫生经济学和利于推广方面的考量,胃癌根治术后标本淋巴结精细分拣虽然能够提高淋巴结的检出率,但其需要投入更多的时间、人力,且在淋巴结阳性检出率方面相较于区块分拣并未表现出明显的优势[19]。对于我国大多数医院现状而言,时间成本、人力成本相对紧张,区块分拣虽然在淋巴结检出总数上低于精细分拣,但其清扫数目能作为有效评估病情的指标,且区块分拣相对较为简便,易于在大多数基层医院推广[20]。因此,胃癌根治术后淋巴结区块分拣法可作为提高淋巴结检出率的有效方法应用于临床。
当然,本研究仍存在一定局限性:①纳入研究的患者样本量不够大;②本研究术中清扫淋巴结是否彻底是由外科医生根据血管脉络化程度判断,未采用淋巴结示踪剂等验证,可能会存在些许的偏差;③因纳入本研究的患者随访时间较短,所获得的生存数据不够全面,故未将生存分析作为研究目标。因此,需开展深入研究予以进一步证实。
