新疆传统泡菜中乳酸菌的分离鉴定及其益生性能评价
2021-11-26夏勒合特巴克尔拜刘晶晶贺红军林祥娜刘云国
夏勒合特·巴克尔拜,刘晶晶,贺红军,林祥娜,刘云国,*
(1. 新疆大学生命科学与技术学院,新疆 乌鲁木齐 830002;2. 临沂大学生命科学学院,山东 临沂 276000;3. 烟台大学生命科学学院,山东 烟台 264005)
泡菜是新鲜蔬菜经过发酵加工成的传统发酵食品,新疆泡菜的经典做法是将大白菜或萝卜与红辣椒、大蒜、姜、葱等各种香料混合后盐渍或醋渍。泡菜是利用蔬菜表面附着的或外源添加的乳酸菌(Lactic acid bacteria, LAB)作为主导微生物的发酵制品[1]。泡菜拥有独特的风味和口感,还含有多种乳酸菌以及丰富的维生素和矿物质等营养物质[2]。LAB 为革兰氏阳性,无芽孢的球菌或棒状细菌,广泛存在于发酵食品中,也是人体内具有重要生理功能的菌群[3],能够调节和改善胃肠微生物生态平衡,并预防由病原体引起的腹泻[4-5],LAB 还具有增强免疫力、减少血清总胆固醇、抗癌等作用[6-7]。
传统泡菜常常是自然发酵而成,无需外源添加任何发酵剂。然而,近年来为了提高泡菜的质量、功能性和益生性,在泡菜制作过程中还可以添加一些优良的发酵剂,该类发酵剂应具有益生菌所需的特性,即能在人体肠道中存活、增殖并发挥其益生特性。研究学者从发酵食品中分离得到具有不同发酵性能和益生特性的菌株,如耐盐菌株[8]、拮抗性菌株[9-10]等。熊蝶等[11]从陕西泡菜中筛选出可作为发酵菌种的乳酸菌,其发酵性和耐盐性均较强;发酵食品中微生物的耐药性已成为食品安全的重要隐患,许女等[12]对醋醅、泡菜和发酵乳制品中乳酸菌的抗生素耐药性进行了评估,并对其耐药基因进行了分析,所分离的97 株乳酸菌对所有测试抗生素均呈不同程度的耐药性;栗永乐[13]从传统农户自制的酸菜中分离筛选出了对人工胃肠液表现出良好耐受性的乳酸菌。优良发酵剂的开发不仅可以提升泡菜的营养价值,还可使益生菌菌种多样性。
本试验组人员通过传统方法结合16S rRNA 分子鉴定对分离于传统自然发酵泡菜中的乳酸菌进行了鉴定,在此基础上,从对低pH 的耐受性、耐盐性、在人工模拟胃肠液中的存活情况和对抗生素的耐受性以及对常见致病菌的抑制性等方面对分离出的乳酸菌生长代谢特征进行了测定分析,为开发具有益生作用的新型泡菜发酵剂提供理论依据与原料来源。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
收集新疆乌鲁木齐市不同家庭自制的泡菜于无菌袋中,密封置于冰盒内并迅速带回实验室进行乳酸菌的扩培及分离等相关试验。
指示菌:大肠杆菌(Escherichia coli)ATCC 25922,金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923,鼠伤寒沙门氏菌(Salmonella typhimurium)CTCC 10982,单核细胞增生李斯特菌(Listeria monocytogenes)ATCC 19115。
培养基:MRS 肉汤培养基、MRS 琼脂培养基,购自北京陆桥技术股份有限公司。
细菌基因组DNA 提取试剂盒,购自北京索莱宝科技有限公司;红霉素(E)、诺氟沙星(NOR)、环丙沙星(CIP)、复方新诺明(SXT)、青霉素(P)、氯霉素(C)、氨苄西林(AM)、头孢唑啉(CZ)、丁胺卡那霉素(AK)、庆大霉素(GM)抗菌药物药敏纸片(以上每片药物含量均为10 μg)、革兰氏染色液试剂盒、牛胆盐等,购自杭州微生物试剂有限公司;胰蛋白酶(3 000 U/g)、胃蛋白酶(250 U/g),购于广州赛国生物科技有限公司;氯化钠、重碳酸钠等试剂均为分析纯。
1.1.2 仪器与设备
LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-2FD 超净工作台,上海一恒科学仪器有限公司;MJX-250B-Z 电热恒温培养箱,上海博讯实业有限公司;LC-LX-H185C 台式高速离心机,上海力辰邦西仪器科技有限公司;MIKRO220R 752 紫外可见分光光度计,上海光学仪器一厂;S1000 Thermal Cycler PCR 仪、DYY-6D 电泳仪、JY04S-3E 凝胶成像系统,北京六一生物科技有限公司。
1.2 方法
1.2.1 乳酸菌的筛选
从7 份自然发酵的泡菜中分别取25 g 样品置于装有225 mL 无菌生理盐水的三角瓶中,摇匀后进行梯度稀释。分别取0.1 mL 106、107、108稀释液涂布MRS 平板,37 ℃培养48 h。挑取单菌落分别在MRS琼脂培养基上划线分离,反复纯化。将纯化后的菌落进行革兰氏染色、镜检及过氧化氢酶试验,挑选出无芽孢、过氧化氢酶阴性且革兰氏染色呈阳性的菌株[14-15]。挑选出的菌株置于-80 ℃保存备用。
1.2.2 耐酸性能测试
将纯化后获得的乳酸菌进行活化并培养24 h,调节OD600为0.5,以1%的接种量分别接种至pH 值为4.0、3.0 和2.5 的MRS 液体培养基中(pH 值用4 mol/L的盐酸调节),37 ℃厌氧培养24 h,600 nm 下测定各组菌液的吸光度值。以未接种的相应pH 值的培养基作为对照,并选取耐酸性能较好的乳酸菌进行后续试验。
1.2.3 胆盐耐受性能测试
在MRS 肉汤培养基中分别添加0、1、2、3.0 g/L的牛胆盐,灭菌。活化后的菌株以1%的接种量接入MRS 肉汤培养基中,37 ℃培养3 h,于600 nm 下测定吸光度值,以未添加牛胆盐的培养基作为对照。
1.2.4 生物学鉴定
参照Yang 等[16]的方法,采用CTAB 法提取待鉴定菌株的基因组DNA,使用细菌基因通用引物(上游引物27F 和下游引物1492R)进行PCR 扩增。以1%的琼脂糖凝胶电泳法检测PCR 产物后,送至上海生工公司测序。测序结果在NCBI 数据库中进行BLAST 分析[17]。
1.2.5 生长曲线的测定
将乳酸菌活化两代,每次活化按1.0%接种量接种到MRS 培养基中,于培养箱中37 ℃培养24 h,以不接种的MRS 培养基作为空白对照,每2 h 对发酵液进行取样,于600 nm 波长下测定菌液的吸光度值。吸光度值越大,菌液浓度越高。
1.2.6 耐盐性能的测定
将供试菌以1%的接种量接种至NaCl 浓度分别为2.0%、4.0%、6.0%、8.0%和10.0%的MRS 肉汤培养基中,以未添加NaCl 的MRS 肉汤培养基为对照(CK),37 ℃培养24 h,于600 nm 波长下测定发酵液吸光度值,每组试验设置3 次重复,以不添加NaCl 的MRS液体培养基作为空白对照。
1.2.7 模拟胃肠道环境试验
1.2.7.1 模拟胃液和模拟肠液的配制
模拟胃液:氯化钠为0.2 g/100 mL,胃蛋白酶为0.35 g/100 mL,用HCI 将pH 值调整为3.0,过滤除菌备用。
模拟肠液:a 液配方为重碳酸钠1.1 g/100 mL,氯化钠0.2 g/100 mL,胰蛋白酶0.1 g/100 mL,用NaOH将pH 值调整为8.0,过滤除菌备用;b 液配方为牛胆盐1.8 g/100 mL,用NaOH 将pH 值调整为8.0,过滤除菌备用。将a 液和b 液以2∶1(V/V)的比例混合,过滤除菌备用。
1.2.7.2 模拟胃肠道环境试验方法
参考陈明等[18]的方法,稍作修改,供试菌培养18 h,4 ℃、4 500 r/min 离心,用0.01 mol/L 的PBS(pH 7.2)缓冲液洗涤2 次,最后用1 mL PBS 重悬菌体并混于9 mL 的模拟胃液中,37 ℃培养,分别于0 h 和2 h 取出适量培养液,涂布MRS 平板,37 ℃培养48 h,计算乳酸菌存活率;然后取1 mL 模拟胃液处理后的培养液重悬于9 mL 的模拟肠液中,37 ℃培养6 h,分别于3 h 和6 h 取样,涂布MRS 平板于37 ℃孵育48 h 后,根据MRS 平板上的活菌数进行耐受性评价,计数菌数为30~300 个的平板,计算乳酸菌存活率。
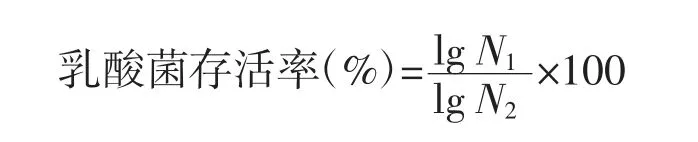
式中:N1为经过模拟胃、肠液培养后的乳酸菌数,CFU/mL;N0为模拟胃液培养前的乳酸菌数,CFU/mL。
1.2.8 乳酸菌抑菌性能研究
以大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 25923、鼠伤寒沙门氏菌CTCC 10982 和单核细胞增生李斯特菌ATCC 19115 做为指示菌,以LB 培养基作为指示菌培养基,使用牛津杯法[19]进行抑菌活性的测定。按1%的接种量重新转接以上4 种致病菌,28 ℃、180 r/min 振荡培养17 h,使其菌体浓度达107CFU/mL。取2 mL 上述指示菌液与200 mL 经融化后保持在50 ℃左右的LB 培养基混合。在平板上放置4 个无菌牛津杯,吸取20 mL 上述混合液覆盖平板,待平板凝固后取出牛津杯,在孔中分别加入100 μL 已制备好的乳酸菌菌株发酵上清液,于37 ℃下培养24 h,测量每个孔周围区域的直径,以空白MRS 肉汤培养基为对照,每组试验重复3 次。
1.2.9 乳酸菌抗生素敏感性研究
参照Weinstein 等[20]的研究方法,采用K-B 药敏纸片琼脂扩散法测定乳酸菌对10 种抗生素的敏感性。将乳酸菌培养液浓度调整为1×108CFU/mL,吸取100 μL 涂布于MRS 琼脂培养基上,贴药敏片,37 ℃培养24 h,测量抑菌圈直径,每种药敏片进行3个重复。测定结果以抗性(抑菌圈直径小于等于15 mm),中等(抑菌圈直径为15~21mm)和敏感(抑菌圈直径大于等于21 mm)表示[21]。
1.2.10 数据处理
试验数据以3 次重复的平均值±标准差表示;采用SPSS v24.0 软件对数据进行分析、Duncan 多重比较法进行差异显著性分析,使用Origin 8.0 软件绘图。
2 结果与分析
2.1 乳酸菌的分离与筛选
从7 份泡菜样品中共分离得到85 株菌株,经革兰氏染色镜检和过氧化氢酶阴性试验初步判断,其中45 株为乳酸菌。pH 值和胆汁耐受性对乳酸菌在胃肠道运输过程中的生存、生长和发挥作用至关重要。因此,通过对45 株菌进行耐酸、耐胆盐试验(结果见表1),发现有5 株菌株能在pH 4.0 条件下生长较好。将这5 株菌分别编号为:R53、R62、R63、R73 和R2。其中R2 在pH 2.5 条件下无法生长。胆盐是细菌生长繁殖的抑制因素之一,对5 株菌株进行耐胆盐试验。结果显示:R2 菌株在1 g/L 和2 g/L 的浓度条件下生长一般,在3 g/L 浓度条件下无法生长。

表1 菌株在不同pH 和牛胆盐质量浓度下的生长情况Table 1 Growth of strains under different pH values and bovine bile salt concentrations
2.2 对筛选出的5 株乳酸菌的鉴定
将5 株乳酸菌的16S rRNA 扩增产物测序结果在NCBI 数据库中进行BLAST 比对分析(见表2),从表2 可以看出,5 株乳酸菌与Gene Bank 数据库中参考菌株的同源性均达97%以上。该结果也与乳酸菌的形态学特征分类与生理生化鉴定结果一致。
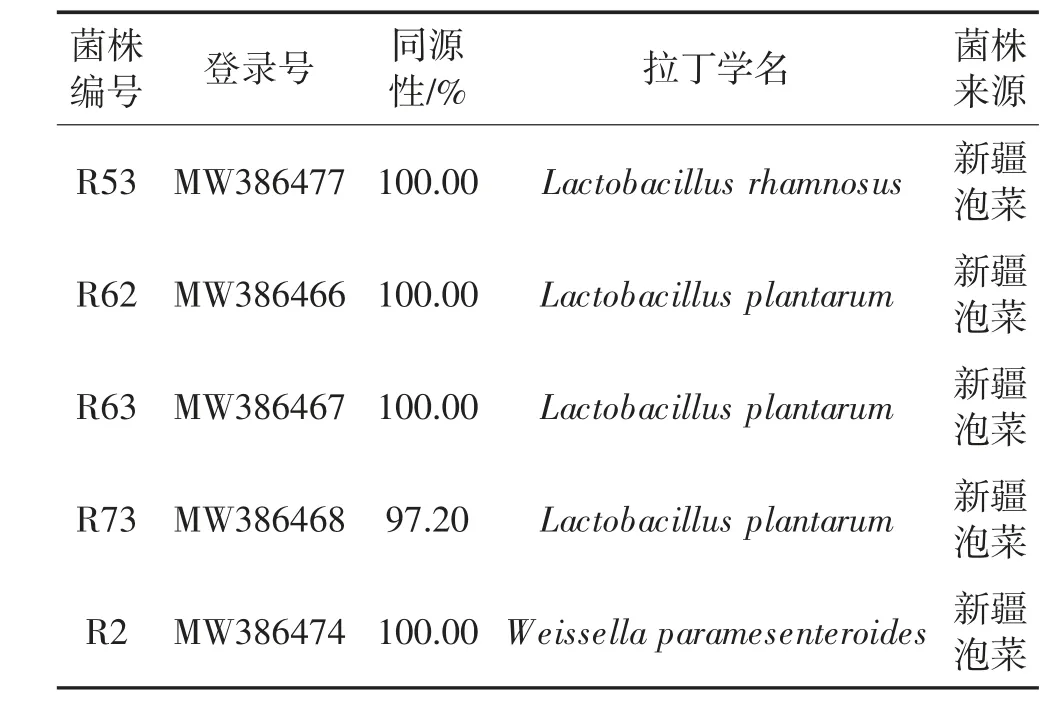
表2 乳酸菌菌株的16S rRNA 鉴定结果Table 2 Results of lactic acid bacteria strains by 16S rRNA identification
2.3 乳酸菌菌株的生长曲线
图1 为筛选出的5 株乳酸菌生长曲线图,由图1可知,植物乳杆菌R62 和R63 生长速度最快,R73 次之,而鼠李糖乳杆菌R53 与肠膜魏斯氏菌R2 最差。0~2 h 为上述乳酸菌的生长延滞期,菌体浓度没有明显增加,2 h 后进入对数生长期,菌体生长代谢旺盛,快速消耗碳源,菌株R63 在14 h 时达到稳定期,最大吸光度值为8.50;菌株R62、R73 和R53,均在18 h 时菌体浓度逐渐趋于稳定,吸光度值分别达到8.31、8.02 和7.76;菌株R2 在16 h 时达到稳定期,吸光度值为7.68。杨静等[22]在研究乳酸菌生长的试验中,发现植物乳杆菌及粪肠球菌分别培养6 h 和8 h 后进入对数生长期,并于18 h 和16 h 吸光度值达到最大。杨英歌等[23]研究了耐酸乳酸菌的生长特性,其试验乳酸菌株进入对数生长期和稳定期时间分别为4 h 和14 h。由此发现,种类不相同的乳酸菌进入对数生长期及稳定期所对应的培养时间不相同,对于同种乳酸菌,其试验培养方法的不同也会影响对数生长期及稳定期时间。
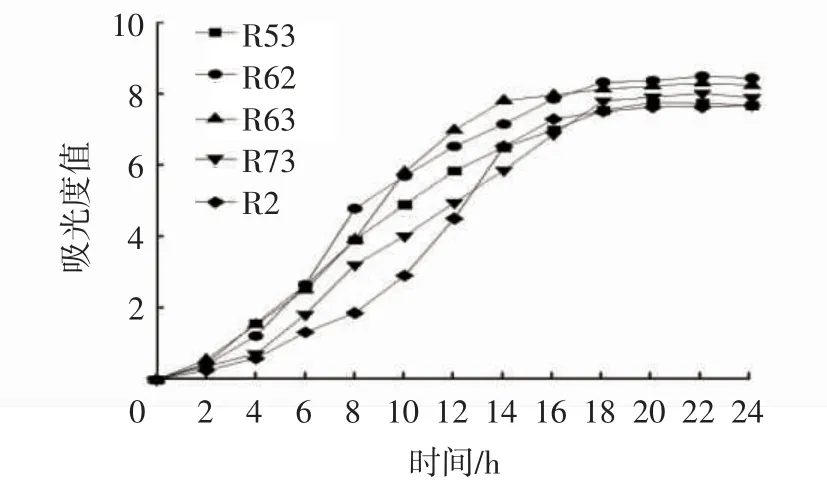
图1 乳酸菌菌株生长曲线Fig.1 Growth curves of lactic acid bacteria strains
2.4 乳酸菌菌株耐盐性能
泡菜发酵时通常加入一定量的食盐,既能调节泡菜风味,也能在一定程度上抑制杂菌生长,因此适用于发酵泡菜的乳酸菌应该具备较强的耐盐性。5 株乳酸菌的耐盐试验结果如图2 所示,乳酸菌的生长与NaCl 的浓度成反比,随着NaCl 浓度的增加,各菌株的生长受到了不同程度的抑制,所有菌株在2% NaCl的MRS 肉汤培养基中生长最强,在NaCl 浓度为4%和6%时,乳酸菌生长没有受到明显的抑制,但高浓度(10%以上)的NaCl 在一定程度上会抑制乳酸菌的生长,盐胁迫会损伤细胞膜结构,进而导致胞内各种代谢紊乱甚至细胞死亡。当NaCl 含量提高至8%时,菌株R53、R63、R62、R73 和R2 的吸光度值分别为1.03、0.31、0.23、0.17、0.15,NaCl 含量达到10%时上述菌株生长最差。
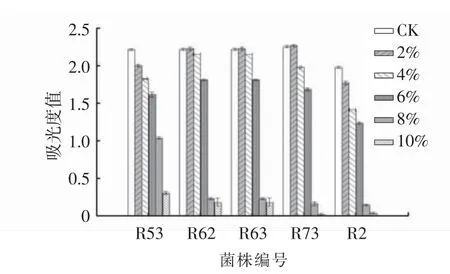
图2 乳酸菌菌株在不同NaCl 浓度培养基中的生长情况Fig.2 Growth of lactic acid bacteria strains in media with different NaCl concentrations
2.5 乳酸菌菌株对模拟胃肠液的耐受情况
耐受胃肠液能力是益生菌筛选的另一个重要指标[24]。本研究采用pH 3.0 的人工模拟胃液和pH 8.0的人工模拟肠液评价筛选菌株对胃肠液的耐受能力,结果如图3 所示,所有菌株均具有很强的耐受胃液能力。在胃液中培养2 h 后,R2 菌株的存活率为91%,其他菌株的存活率均达到98%以上。乳酸菌经过胃部后要在肠道定殖才能发挥其益生特性。在人工模拟肠液试验中,所有菌株均具有很强的耐受肠液能力,在肠液中培养3 h 的存活率仍达到85%以上;6 h 时菌株R2 的存活力稍弱,为77%,其余菌株的存活率仍为83%以上;结果表明,人工肠液在pH 8.0 条件下对筛选菌株生长影响不大。
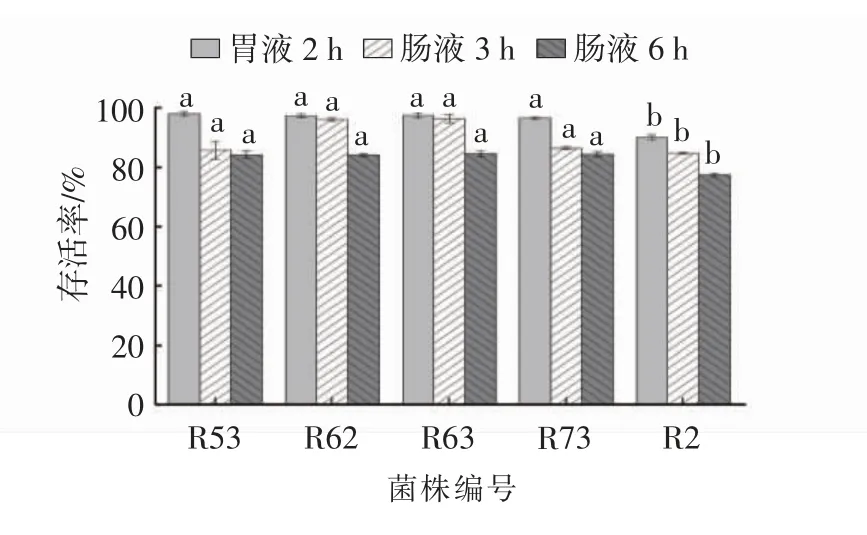
图3 乳酸菌菌株的人工胃肠液存活率Fig.3 Survival rates of lactic acid bacteria strains in artificial gastrointestinal fluids
2.6 乳酸菌菌株的抑菌性能
乳酸菌生长过程中产生的代谢产物(包括有机酸、抗菌肽和细菌素等)有助于抑制其他食源性致病菌的增殖[25]。本试验评估了分离出的5 株乳酸菌对发酵食品中常见的革兰氏阳性致病菌(金黄色葡萄球菌和单核细胞增生李斯特菌)和革兰氏阴性致病菌(大肠杆菌和鼠伤寒沙门氏菌)的抑制作用(见表3)。结果表明R62、R53 和R63 对指示菌均有明显的抑制效果,R73 菌株对金黄色葡萄球菌无抑制作用,R2 菌株对金黄色葡萄球菌和单核细胞增生李斯特菌无抑制作用。不同种属的乳酸菌产生的抑菌代谢产物不同,导致其对病原菌的抑制活性和抑制机理不同。张会生等[26]研究表明,乳酸菌发酵上清液对金黄色葡萄球菌的抑制直径为23.10 mm,鼠伤寒沙门氏菌的抑制直径为19.75 mm,大肠杆菌的抑制直径为17.20 mm,这与本试验结果相似,说明不同乳酸菌菌株的培养液均对测试致病菌株的生长具有抑制作用[27]。

表3 乳酸菌菌株对不同致病菌的抑制效果Table 3 Inhibitory effects of lactic acid bacteria strains on different pathogenic bacteria 单位:mm
2.7 乳酸菌菌株耐药试验
乳酸菌对抗生素的敏感性是评估潜在益生菌安全性的重要指标[28],因为它们可能使宿主含有抗生素耐药基因,并可横向传播给病原体[29]。研究均表明,乳酸菌对不同抗生素的敏感性因菌种而异,且不同菌种之间的敏感性相差可达数倍[30-31]。根据CLSI 的药敏试验标准[32]对乳酸菌菌株进行敏感性试验,结果如表4 所示,乳酸菌对氨基糖苷类药物普遍耐药,所有分离菌株对庆大霉素、丁胺卡那霉素均具有耐药性,对红霉素、青霉素、氯霉素、氨苄西林、头孢唑啉敏感。

表4 乳酸菌菌株对不同抗生素的敏感性Table 4 Sensitivities of lactic acid bacteria strains to different antibiotics
3 结论
从新疆地区农家自然发酵泡菜中共分离筛选出5 株性能优良的乳酸菌,经形态学分析和生理生化试验并结合16S rRNA 分子鉴定为3 株Lactobacillus plantarum、1 株Lactobacillus rhamnosus、1 株Weissellaparamesenteroides,并对其进行了益生性能评价试验。结果表明:在pH 2.5 条件下R2 菌株的生长较弱,在1 g/L 和2 g/L 的胆盐浓度下生长一般,在3 g/L 浓度下无法生长,但其余4 株菌株R53、R62、R63 和R73耐酸和耐胆盐能力相对较好,甚至对pH 2.5 及3 g/L牛胆盐的严苛条件也具有一定耐受性;植物乳杆菌R62 和R63 生长速度最快,R73 次之,而鼠李糖乳杆菌R53 与类肠膜魏斯氏菌R2 最差;在NaCl 浓度为4%时所有菌株均具有较强的生长能力;在pH 为3.0的模拟胃液中培养2 h 菌株存活率仍达90%以上,在pH 为8.0 的模拟肠液中培养6 h 存活率仍保留77%以上。益生菌最重要的特性之一是产生短链脂肪酸和细菌素等化合物从而提高对病原体的抗菌活性,对大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌和单核细胞增生李斯特菌的抑制作用进行试验,结果表明R53、R62、R63 菌株的发酵上清液对4 种致病菌都有抑制作用,R2 菌株对金黄色葡萄球菌和单核细胞增生李斯特菌无抑制作用,R73 菌株对金黄色葡萄球菌无抑制作用。此外对常见的10 种抗生素(青霉素、氨苄青霉素、头孢唑林、丁胺卡那、庆大霉素、红霉素、复方新诺明、氯霉素)的敏感性研究发现,所有菌株对红霉素、青霉素、氯霉素、氨苄西林、头孢唑啉均敏感,对人体健康不存在潜在威胁,但对其他抗生素均有不同程度的耐药性,其中对诺氟沙星和环丙沙星耐药性一般,对丁胺卡那和庆大霉素耐药性较高。
