山楂食用酵素抗氧化及对脂肪酶活性
2021-11-25聂俊莲苏嘉烨张存莉
聂俊莲,苏嘉烨,张存莉
1.西北农林科技大学化学与药学院(杨凌 712100);2.陕西五丁生物科技有限公司,汉中市食用植物酵素研发与检测重点实验室(宁强 724400)
食用植物酵素是以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品[1],2019年被国家发改委列入《产业结构调整指导目录》鼓励类产业。但目前社会上对酵素产品争议较大,褒贬不一。山楂(Crataegus pinnatifidaBunge)为蔷薇科植物山里红或山楂的干燥成熟果实,其含有丰富的黄酮、多糖、酚和有机酸等化合物,具有显著的降脂减肥、降血糖、抗动脉粥样硬化、抗氧化等作用[2-6],目前国内对山楂酵素的研究多集中于发酵工艺研究[7-9]。因此,此次试验以山楂为原料,采用多菌种混合发酵,探究山楂发酵前后的抗氧化和对胰脂肪酶的活性作用,以期为山楂资源的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
山楂,市售;葡萄酒高活性干酵母,安琪酵母有限公司产品;乳酸菌(植物乳杆菌),台湾亚芯生物科技有限公司;醋酸菌,沪酿1.01号醋酸菌,上海佳民酿造食品有限公司;纤维素酶,广东永信食品配料有限公司;脂肪酶、磷酸氢二钠(分析纯)、磷酸二氢钠(分析纯)、DPPH(分析纯)、ABTS(分析纯)、总抗氧化能力检测试剂盒,北京索莱宝科技有限公司;水杨酸(分析纯),天津市天力化学试剂有限公司;七水合硫酸亚铁(分析纯),广东光华科技股份有限公司;橄榄油(分析纯)、聚乙烯醇(分析纯)、95%乙醇(分析纯),上海麦克林生化科技有限公司。
1.2 仪器与设备
UV-1801型紫外分光光度计(日本岛津公司);LDZX-50KBS型高压灭菌锅(上海申安医疗器械厂);SW-CJ-2FD型超净工作台(苏州安泰空气技术有限公司);DHP-9052B型电热恒温培养箱(上海精宏实验设备有限公司);BPG-9056A型精密鼓风干燥箱(上海一恒科学仪器有限公司);ME204E/02型精密和分析天平[梅特勒-托利多仪器(上海)有限公司]。
1.3 试验方法
1.3.1 试验材料
山楂酵素:取500 g山楂,按适当比例加水,取纤维素酶酶解后的山楂浆,将活化好的酵母菌、乳酸菌和醋酸菌先后接种到待发酵液中,发酵90 d左右。
1.3.2 有效成分的测定
1.3.2.1 黄酮的测定
以空白试剂为对照,在510 nm波长处测定不同浓度芦丁标准液吸光度,制定标准曲线。芦丁浓度X与吸光度Y间的回归方程为Y=11.391X+0.006 4,相关系数为0.999 9。
精密吸取2.0 mL样品溶液,置于10 mL具塞试管中,加入0.3 mL 5% NaNO2溶液,反应6 min,再加入0.3 mL 10% Al(NO3)3溶液,摇匀,反应6 min,再加4 mL 1 mol/L NaOH溶液终止反应,最后加入50%乙醇至10 mL,摇匀,以空白试剂为对照,在510 nm波长处测定吸光度,根据标准曲线计算出样品中总黄酮的浓度[10]。
1.3.2.2 粗多糖的测定
以空白试剂为对照,在620 nm波长处测定不同浓度葡萄糖吸光度。以吸光度(A)为纵坐标Y,以对照品浓度(μg/mL)为横坐标X,做标准曲线,得到回归方程Y=38.658X-0.002 4,相关系数为0.999 6。
精密吸取1.0 mL样品溶液,置于10 mL具塞试管中,加入4 mL蒽酮试剂(0.2 g蒽酮溶于100 mL浓H2SO4),迅速置于冰水浴中冷却。待各管加完后一起浸于沸水中煮沸10 min,取出后用流水冷却,室温放置10 min,摇匀,以空白试剂为对照,在620 nm波长处测定吸光度,根据标准曲线计算出样品中多糖的含量[11]。
1.3.2.3 多酚的测定
按照GB/T 8313—2018[12]中规定的茶多酚的检测方法测定。以空白试剂为对照,在765 nm波长处测定不同浓度没食子酸标准液吸光度,以吸光度(A)为纵坐标Y,以对照品取样量(mg)为横坐标X,进行线性回归,得到回归方程Y=0.001 6X+0.007 6,相关系数为0.999 1。
精密吸取1 mL样品溶液,置于10 mL具塞试管中,加5 mL 10%福林酚试剂,摇匀。反应3~8 min内,加入4.0 mL 7.5% Na2CO3溶液,摇匀,室温下放置60 min,以空白试剂为对照,在765 nm波长处测定吸光度,根据标准曲线计算出样品中多酚的浓度。
1.3.2.4 总酸的测定
按GB/T 12456—2008[13]酸碱滴定法测定发酵液中总酸浓度。
1.3.3 抗氧化活性研究
1.3.3.1 DPPH自由基清除率的测定
参考You等[14]的方法,准确配制4×10-4mol/L的DPPH溶液,置于冰箱内冷冻避光保存。将体积分数100%的山楂果醋,分别按5%,10%,15%,20%,25%和30%的体积分数加水稀释,制备不同体积浓度的样液。取0.5 mL样液,准确加入3 mL DPPH溶液,充分混匀后在避光的环境下放置30 min后,在517 nm条件下测定吸光度Ai。同时测定0.5 mL样液与3 mL无水乙醇混合液的吸光度Aj,以及无水乙醇0.5 mL与3 mL DPPH溶液混合液的吸光度A0。按式(1)计算。
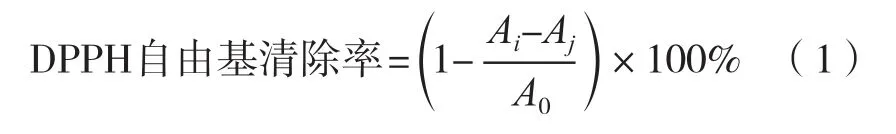
标准曲线的绘制:依次配制50,100,150,200和250 μg/mL的VC标准溶液,按照上述样品测定方法测定吸光度,以VC浓度为横坐标,清除率纵坐标绘制标准曲线,VC质量浓度X与清除率Y间的回归方程为Y=0.003 8X+0.035 8,相关系数为0.991 4。
1.3.3.2 ABTS自由基清除率的测定
参考闫亚美等[15]的方法,准确称取0.038 4 g的ABTS自由基和0.013 4 g的过硫酸钾样品,分别用纯水定容至10 mL;之后按照1∶1混合均匀避光保存12 h,形成ABTS+工作液,使用前纯水稀释10倍。将体积分数100%的山楂果醋,分别按5%,10%,15%,20%,25%和30%的体积浓度加水稀释,制备不同体积浓度的样液。在样品管中加入200 μL稀释好的样液和3 mL ABTS+溶液静置6 min,在734 nm处测定溶液的吸光度Ai。同时测定200 μL样品液和3 mL超纯水的吸光度Aj,以及200 μL蒸馏水和3 mL ABTS混合溶液的吸光度A0。按式(2)计算。
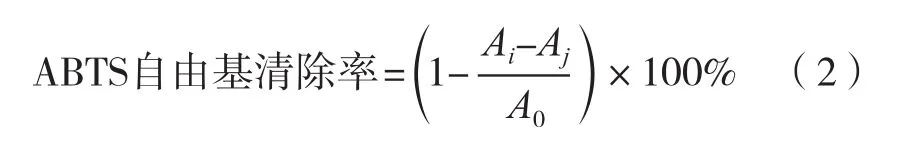
标准曲线的绘制:依次配制50,100,150,200和250 μg/mL的VC标准液,按照上述样品测定方法测定A值,以VC浓度为横坐标,清除率为纵坐标绘制标准曲线,VC质量浓度X与清除率Y间的回归方程为Y=0.004X-0.033 6,相关系数为0.995 8。
1.3.3.3 总抗氧化能力测定
依据北京索莱宝科技有限公司总抗氧化能力(T-AOC)试剂盒说明书,稍加改动,首先将体积分数100%的山楂果醋,分别按5%,10%,15%,20%,25%和30%的体积浓度加水稀释,制备不同体积浓度的样液。按照试剂盒规定的方法测定593 nm处的吸光度,计算ΔA=A标准-A空白。以Fe2+浓度为横坐标X,ΔA为纵坐标Y绘制标准曲线,得到线性方程Y=11.186X-0.080 2,将A样品带入方程求得X(μmol/mL)。则总抗氧化能力(μmol/mL)按式(3)计算。
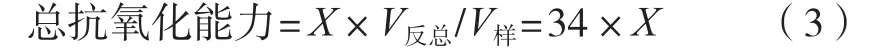
式中:X为Fe2+浓度,μmol/mL;V反总为反应总体积,1.02 mL;V样为反应中样本体积,0.03 mL。
1.3.4 胰脂肪酶活性测定
参考祁静等[16]的方法,在干净锥形瓶中准确移入8 mL橄榄油乳液、5 mL 0.1 mol/L pH 7.2的PBS缓冲液,然后分别准确移入3 mL提前调至pH 7.2的山楂果醋,置于磁力搅拌器上充分搅拌均匀,最后准确移入1 mL 0.20 mg/mL的胰脂肪酶液,再次充分搅拌均匀。将上述反应液置于37 ℃下的恒温培养振荡器中反应1.5 h,然后加入15 mL 95%乙醇终止酶反应。于反应液中滴加2滴酚酞指示剂,使用0.02 mol/L NaOH滴定体系中产生的脂肪酸量。
对胰脂肪酶的活性进行检测,平行试验3次,胰脂肪酶的酶活计算采用胰脂肪酶的活力测定公式(4),胰脂肪酶的活性抑制率计算公式如式(5)所示。
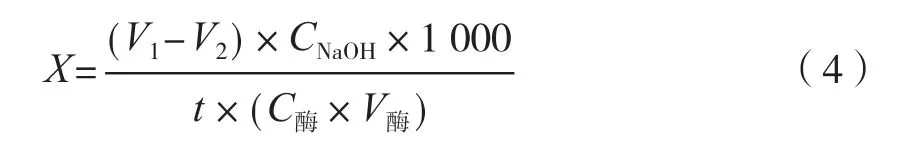
式中:X为样品的酶活,μmol/(min·mg);V1为滴定样品时消耗的NaOH标准溶液的体积,mL;V2为滴定空白时消耗的NaOH标准溶液的体积,mL;CNaOH为NaOH标准溶液的浓度,mol/L;t为反应时间,min;C酶为胰脂肪酶的质量浓度,mg/mL;V酶为胰脂肪酶的添加体积,mL。

式中:抑制率为胰脂肪酶的活性抑制率,%;X1为对照组酶活,μmol/(min·mg);X2为样品组酶活,μmol/(min·mg)。
2 结果与分析
2.1 有效成分变化
山楂发酵前后有效成分变化如图1所示。

图1 山楂发酵前后有效成分含量变化
由图1可知:山楂原液中黄酮、多酚、粗多糖和总酸质量浓度分别为4.5,4.7,14.6和10.4 mg/mL;山楂酵素中它们的质量分数分别为7.4,6.7,13.7和36 mg/mL,其中黄酮、多酚、总酸浓度分别提高了64%,43%和246%。
2.2 抗氧化性结果分析
将不同体积分数(5%~30%)的山楂原液和山楂酵素进行清除DPPH、ABTS清除率和总抗氧化能力进行对比,结果如图2所示。
由图2(A)可知,不同体积分数山楂原液和酵素对DPPH清除率均呈现先上升后逐渐平缓的趋势,当体积分数为5%和10%时,酵素的清除率高于原液,当体积分数为30%时二者的清除率相差不大,在95%和97%左右,原液和酵素分别相当于241和246 μg/mL VC的清除作用。说明山楂本身含有的有效成分和微生物发酵产生的代谢物对DPPH自由基的清除具有显著作用,经发酵后清除作用增强,随着体积分数增加,两者清除作用趋于一致,由此可以看出发酵引起的成分变化对DPPH自由基影响不大。
由图2(B)可知,体积分数在5%~30%区间内,山楂原液对ABTS自由基的清除率低于酵素,原液在25%~30%区间逐渐平稳,清除率在85%左右,而酵素在20%时对ABTS的清除率达到最大值(99%左右),原液和酵素分别相当于221和250 μg/mL左右VC的清除作用。说明微生物发酵后引起营养成分变化,产生的代谢物在清除ABTS自由基方面优于原液,且不会随酵素体积分数增加而变化。
由图2(C)可知,在5%~30%范围内,山楂原液和酵素总抗氧化能力整体均呈逐渐上升趋势,且酵素的总抗氧化能力明显高于原液。当体积分数为30%时,山楂原液和酵素的总抗氧化性分别为6.9和8.8 μmol/mL,酵素的总抗氧化性高于原液。说明微生物生长代谢产生的成分变化对总抗氧化能力T-AOC值影响显著,山楂经过多菌种发酵更有利于山楂中抗氧化活性成分的保持且随着体积分数的增加对总抗氧化能力的影响逐渐增大。
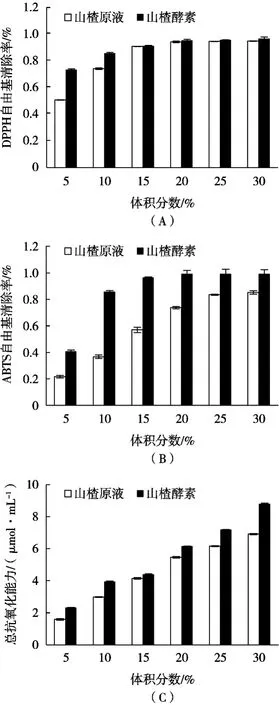
图2 山楂原液和山楂酵素对DPPH自由基(A)、ABTS自由基(B)清除率和总抗氧化能力(C)
2.3 山楂酵素对脂肪酶活性测定结果分析
山楂原液和山楂酵素对脂肪酶活性研究如图3所示。
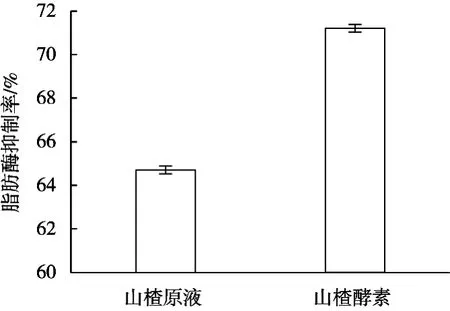
图3 山楂酵素和山楂原液对脂肪酶抑制率
由图3可知,山楂酵素和原液均对脂肪酶有抑制作用,山楂酵素、原液对脂肪酶的抑制率分别为71.2%和64.7%,酵素的抑制率高于原液,说明经混合菌种发酵后,产生的成分变化和代谢物能够促进对脂肪酶的抑制作用,提高对脂肪酶的抑制率。
3 结论与讨论
研究结果表明:山楂酵素中黄酮、多酚、总酸浓度分别比原液提高了64%,43%和246%,对DPPH、ABTS自由基清除率、总抗氧化能力和体外对脂肪酶抑制率分别提高了2%,16.5%,27.5%和246%,差异显著,表明山楂酵素的抗氧化能力和对脂肪酶抑制活性优于山楂原液,与相关研究结论一致[17-19]。
酵素产品中主要有机酸为乳酸、乙酸、苹果酸等[20],山楂酵素总酸含量大幅上升的原因是体系中的酵母菌、乳酸菌利用可发酵的碳水化合物,转化成乙醇和乳酸,醋酸菌利用体系中的乙醇将其转化成乙酸;另外山楂本身也含有大量有机酸,随着发酵时间延长,有机酸逐渐溶出;山楂酵素黄酮类物质含量上升的原因,可能是由于:①酵母菌发酵过程中能产生果胶酶;②前处理过程中加入纤维素酶,二者可破坏植物细胞壁,促进细胞内黄酮类物质溶出[21-22]。酚类化合物含量上升,可能是由于乳酸菌产生的酶及有机酸能增加发酵液中的总酚含量,酵母菌、醋酸菌和乳酸菌的混菌体系在饮料发酵过程中可将大分子酚类物质降解成小分子酚类物质[23-24];山楂发酵后,抗氧化活性明显增强,可能是黄酮和多酚类物质含量增加的原因,与相关研究一致[25]。对脂肪酶活性抑制增加,可能是体系中的黄酮类以及乙酸[26]、乳酸[27]等物质含量增加所致,因为三者均具有显著调节血脂的功效[28]。相比山楂原液,山楂酵素的抗氧化能力增强,可以降低氧化应激反应,从而对肥胖、高血脂和糖尿病等代谢综合征产生一定防治作用;抑制胰脂肪酶活性,可有效抑制脂质代谢过程,降低人体对膳食脂肪的消化率和代谢产物的吸收率,从而控制血浆脂原浓度的升高,达到降血脂的功效[17],这可能也就是2019年国家将食用酵素列为《产业结构调整指导目录》鼓励类产业原因之一。
