超高效液相色谱法测定饮料中的25种常见和新型食品添加剂
2021-11-25李志全
刘 芸,刘 红,李志全
(1.湖北省药品监督检验研究院,武汉 430000;2.武汉大学 化学与分子科学学院,武汉 430072;3.广州检验检测认证集团有限公司武汉分公司,武汉 430000)
随着我国食品工业的快速发展,食品添加剂已成为现代食品工业的重要组成部分。常用的食品添加剂包括甜味剂(安赛蜜、糖精钠、阿斯巴甜、纽甜)、防腐剂(苯甲酸、山梨酸、脱氢乙酸、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、纳他霉素)、着色剂(新红、苋菜红、胭脂红、赤藓红、日落黄、靛蓝、诱惑红、偶氮玉红、罗丹明B、碱性橙2、碱性橙22)及生物碱(咖啡因和茶碱),国家标准GB 2760-2014《食品安全国家标准 食品添加剂使用标准》[1]规定了这些常规食品添加剂的限量。专利蓝V 是一种可在中国香港、欧盟、俄罗斯限量使用的着色剂。爱德万甜是一种甜度为蔗糖20 000倍的甜味剂[2],欧洲食品安全局和美国食品药品监督管理局规定其每日允许摄入限量分别为5,32.8 mg·kg-1。在国家卫生和计划生育委员会2017年10月20日发布的第8号公告中,爱德万甜被正式列入可使用的食品添加剂名单中。在食品加工和生产过程中,一些企业为了延长食品的保质期,增加口感和色泽,可能会过量添加食品添加剂,这些产品一旦被长期摄入,将会损害人体的神经系统、消化系统[3-4],甚至可能致畸、致癌。因此,有必要建立一种准确、可靠、快速地测定食品中常规和新型食品添加剂含量的方法,以监控食品中食品添加剂的添加水平,更好地保障消费者的健康权益。
目前,检测食品添加剂的国家标准方法主要有液相色谱法、气相色谱法、衍生光谱法以及色谱-质谱法[5-11],但其检测对象不包括爱德万甜和茶碱。文献报道的检测爱德万甜的方法主要有高效液相色谱法(HPLC)[12]和超高效液相色谱-串联质谱法(UHPLC-MS/MS)[13],检测茶碱的方法主要为HPLC[14],但这些方法存在前处理方法不一致和检测对象单一的缺点。为了减少现有检测方法带来的安全漏洞,填补新型甜味剂爱德万甜、着色剂专利蓝V 和其他常用食品添加剂同时测定的空白,本工作建立了UHPLC同时测定饮料中25种食品添加剂的方法,以期为食品中添加剂使用情况的筛查以及相关部门的食品监管和执法提供技术支撑和方法储备。
1 试验部分
1.1 仪器与试剂
Waters H class型超高效液相色谱仪,配光电二极管阵列检测器;Milli-Q A10 型超纯水机;0.45μm 聚四氟乙烯(PTFE)滤膜。
苯甲酸、山梨酸、糖精钠、安赛蜜、脱氢乙酸、靛蓝、诱惑红标准溶液的质量浓度均为1.00 g·L-1。
日落黄、胭脂红标准溶液的质量浓度均为0.500 g·L-1。
对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、爱德万甜、碱性橙2、纳他霉素、碱性橙22、罗丹明B单标准储备溶液:1.00 g·L-1,介质为甲醇。
新红、苋菜红、茶碱、咖啡因、阿斯巴甜、偶氮玉红、专利蓝V、赤藓红、纽甜单标准储备溶液:1.00 g·L-1,介质为水。
其他所用标准溶液或混合标准溶液均由上述单标准溶液或单标准储备溶液用相应的溶剂逐级稀释制得。
苋菜红的纯度为79.80%;茶碱、咖啡因、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、碱性橙2、纽甜等的纯度均为100%;罗丹明B 的纯度为97.30%;阿斯巴甜的纯度为97.70%;偶氮玉红的纯度为92%;专利蓝V 的纯度为89.70%;纳他霉素的纯度为91.30%;新红的纯度为88.90%;赤藓红的纯度为80%;爱德万甜的纯度为97.00%;碱性橙22的纯度为99.90%。
甲醇为色谱纯;乙酸铵为优级纯;试验用水为超纯水。
1.2 仪器工作条件
ACQUITY UPLC®HSS T3 色谱柱(100 mm×2.1 mm,1.8μm);柱温35 ℃;流动相A为甲醇,B 为0.02 mol·L-1乙酸铵溶液;流量0.3 mL·min-1;进样量3μL;梯度洗脱程序:0~2 min时,A 由3%升至10%;2~4 min 时,A 由10%升至15%;4~8 min时,A 由15%升至40%;8~16 min时,A 由40%升至85%;16~17 min时,A 由85%降至3%,保持2 min。检测波长见表1。

表1 25种食品添加剂的检测波长Tab.1 Detection wavelengths of 25 food additives
1.3 试验方法
取样品2.5 g,用50%(体积分数,下同)甲醇溶液稀释至25 mL,涡旋振荡2 min 后超声提取20 min,用0.45 μm PTFE 滤膜过滤,滤液供UHPLC分析。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 流动相和梯度洗脱程序
流动相主要由缓冲体系和有机相组成,缓冲体系主要有磷酸盐缓冲体系和乙酸盐缓冲体系。乙酸盐缓冲体系具有分离效果和水溶性好,且不易在色谱柱上残留等优点,因此试验以甲醇-乙酸盐缓冲体系作为流动相,通过调整甲醇在流动相中的比例来对极性相差较大的25种食品添加剂进行梯度洗脱,洗脱程序见1.2节。
2.1.2 检测波长
按照仪器工作条件在200~800 nm 内对25种添加剂进行紫外-可见扫描,所选的检测波长见表1。
2.2 前处理条件的选择
2.2.1 滤 膜
滤膜会不同程度地吸附着色剂,因此试验考察了分别以尼龙、聚醚砜和PTFE 等3种材质制备的滤膜(孔径均为0.45μm)过滤加标样品时对其中25种食品添加剂回收率的影响。结果显示:以尼龙膜和聚醚砜膜过滤时,新红、苋菜红、靛蓝、胭脂红、偶氮玉红和赤藓红的回收率几乎为0,说明上述添加剂已被滤膜完全吸附;以PTFE 滤膜过滤后所得的25种食品添加剂的回收率为80.0%~110%。因此,试验选择用PTFE滤膜过滤样品溶液。
2.2.2 提取溶剂甲醇的体积分数
试验考察了甲醇的体积分数分别为0,10%,20%,30%,40%,50%,60%,70%,80%,90%,100%(以水作稀释剂)时对加标样品中25种食品添加剂回收率的影响。结果显示,在以不同体积分数甲醇溶液提取时,25 种食品添加剂的回收率为5.3%~117%,其中,以水作为提取溶剂时,醇溶性的碱性橙2、碱性橙22、罗丹明B 回收率为5.3%~16.2%;以甲醇作为提取溶剂时,水溶性的防腐剂和色素类添加剂的回收率为17.5%~36.4%;以50%甲醇溶液作为提取溶剂时,25种食品添加剂的回收率均在80.0%以上。综合考虑,试验选择甲醇溶液的体积分数为50%。
2.3 色谱行为
在优化的试验条件下,25种食品添加剂的混合标准溶液的色谱图见图1。

图1 混合标准溶液的色谱图Fig.1 Chromatogram of mixed standard solution
2.4 标准曲线和检出限
按照试验方法测定25种食品添加剂的标准溶液系列,以各添加剂的质量浓度为横坐标,其对应的色谱峰面积为纵坐标绘制标准曲线,线性参数见表2。
分别以3 倍、10 倍信噪比(S/N)计算检出限(3S/N)和测定下限(10S/N),结果见表2。

表2 25种食品添加剂的线性参数、检出限及测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination of 25 food additives
2.5 精密度和回收试验
对空白茶饮料样品进行低、中、高等3个浓度水平的加标回收试验,加标量分别为各食品添加剂测定下限的3,10,20倍,每个加标水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
由表3 可知:25 种食品添加剂的回收率为82.1%~111%,RSD 均小于3.5%,方法的精密度和准确度均能满足实际样品的检测要求。
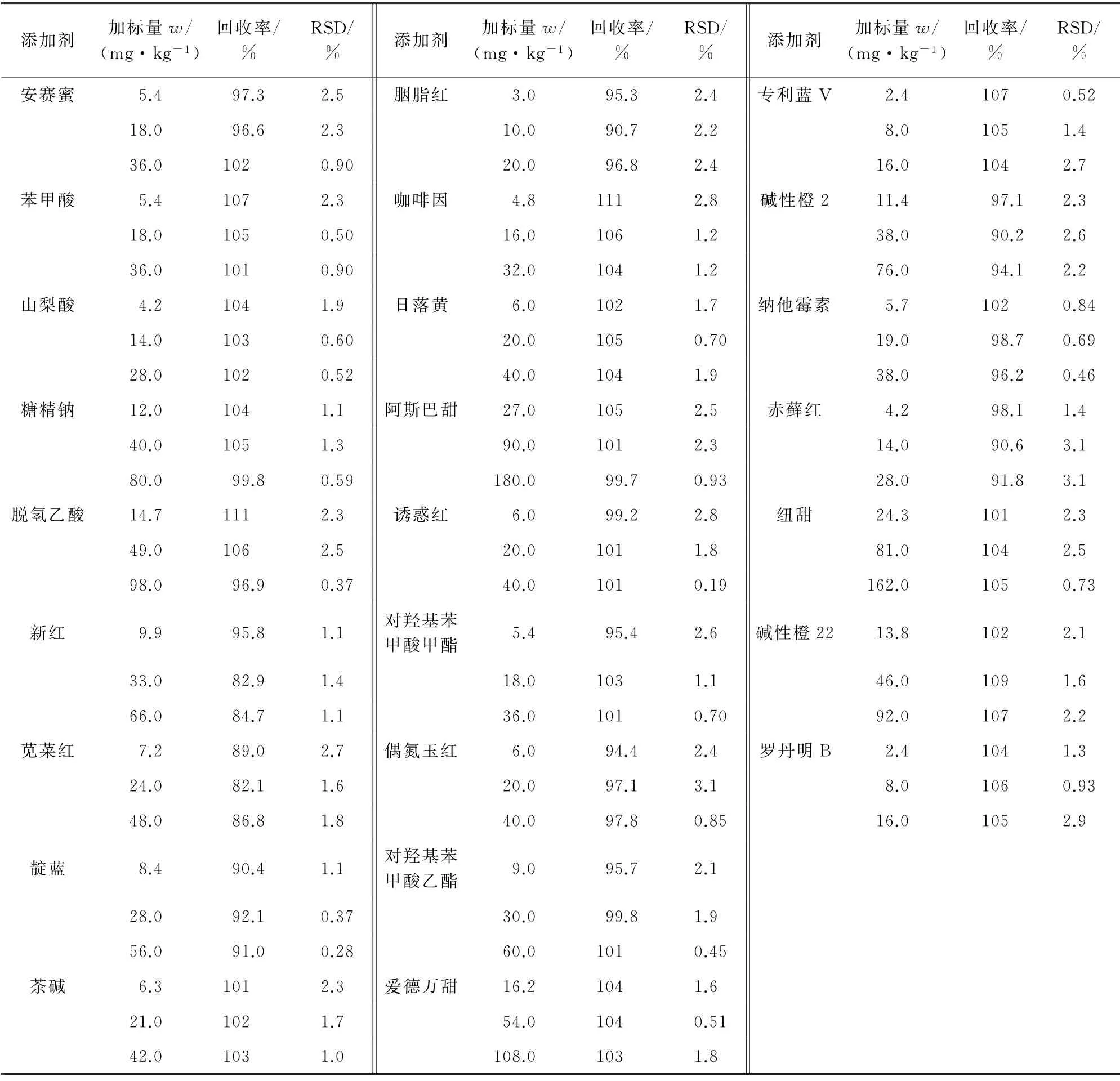
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
2.6 样品分析
应用本方法分析7 种果蔬汁饮料和3 种茶饮料,结果显示:在3个茶饮料中均检出了咖啡因,检出量分别为95.3,98.4,124.9 mg·kg-1,推测与原料茶叶中咖啡因的带入有关;在1个果蔬汁饮料中检出了安赛蜜,检出量为20.2 mg·kg-1,在2个果蔬汁饮料中检出了山梨酸,检出量分别为15.8,18.9 mg·kg-1。为了验证本方法定性结果是否准确,参考文献[1]方法采用液相色谱-质谱法中多反应监测(MRM)模式对检出成分进行了分析,结果显示,两种方法的定性结果相同,说明本方法满足实际应用需求。
本工作建立了UHPLC 测定饮料中25种常见和新型食品添加剂含量的方法,该方法简便、快速、准确度高、精密度好,可为食品安全监管提供有效保障。
