一株针对猪繁殖与呼吸综合征病毒NADC30-like毒株GP5蛋白的单克隆抗体制备及鉴定
2021-11-25秦义娴高金源吴华伟
秦义娴,刘 丹,邓 永,高金源,苏 佳,朱 真,吴华伟
(中国兽医药品监察所,北京100081)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)引起的猪的一种以母猪繁殖障碍及仔猪出现严重呼吸道症状的疾病[1]。该病毒于1991年由荷兰学者首先分离报道[2]。我国于1996年首次分离出病原[3],并在2006年爆发了由 PRRSV经典毒株突变株引起的高致病性猪繁殖与呼吸综合征,2012年以来PRRSV NADC30-like毒株已逐步成为我国的PRRSV优势流行毒株。
精准诊断是防控PRRS的基础。国内外已建立了许多可鉴别诊断PRRSV NADC30-like毒株的检测试剂,绝大多数为RT-PCR方法[4],但尚未有可特异性用于PRRSV NADC30-like毒株鉴定用单克隆抗体的报道。GP5蛋白作为PRRSV毒的主要糖基化结构蛋白,可诱导机体产生中和抗体,常用于单克隆抗体制备和诊断试剂研制的靶标。本研究以原核表达纯化的GP5蛋白[5]作为抗原免疫小鼠,通过间接免疫荧光筛选,获得1株针对PRRSV NADC30-like毒株GP5蛋白的单克隆抗体,为PRRSV NADC30-like诊断试剂的研制提供了坚实基础。
1 材料与方法
1.1 细胞、毒株、GP5蛋白及实验动物 SP2/0细胞、Marc-145细胞、PRRSV 46D(NADC30-like毒株)、PRRSV 30D(NADC30-like毒株)、猪瘟病毒(CSFV)、猪圆环病毒2型 (PCV2)、牛病毒性腹泻病毒(BVDV),由中国兽医药品监察所保存;PRRSV CH-1R株、TJM-F92株、HuN4-F112株、GDr180株、R98株、JXA1-R株均为商品化疫苗;GP5蛋白由中国兽医药品监察所制备保存;8周龄Balb/c雌性小鼠,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂 Protein Marker购于TaKaRa公司; SDS-PAGE凝胶制备试剂盒购于碧云天生物技术有限公司; HRP标记的羊抗鼠IgG为Invitrogen公司产品;FITC标记的山羊抗小鼠IgG为Sigma公司产品;Mouse单克隆抗体亚型鉴定试剂盒为proteintech公司产品;QuickAntibody-Mouse3 W佐剂为北京博奥龙免疫技术有限公司产品。
1.3 动物免疫 将GP5蛋白与QuickAntibody-Mouse3 W佐剂等体积混匀,通过后腿肌肉注射免疫小鼠,每只小鼠注射100 μL,此后第14天按相同剂量、相同途径加强免疫,共免疫2次。融合前3日使用200 μL抗原加强免疫一次。
1.4 细胞融合及筛选 无菌条件下取免疫小鼠的脾细胞,与处于对数生长期的SP2/0细胞采用常规方法(50% PEG法)进行细胞融合,并将融合的细胞分置于96孔板中,放置于37 ℃、5% CO2培养箱内培养。10 d后收集杂交瘤细胞上清采用间接免疫荧光方法(IFA)进行检测,具体方法如下:将处于对数生长期的Marc-145细胞消化后分散至96孔细胞培养板,长成良好单层后(24 h左右)加入PRRSV 46D,每孔100 μL,放置于37 ℃、5% CO2培养箱内继续培养。当细胞出现30%~50%病变时,加入预冷的无水乙醇4 ℃固定细胞。每孔加入50 μL杂交瘤细胞上清,37 ℃作用1 h,PBS洗3次,加入1∶100稀释的FITC标记的山羊抗小鼠IgG,37 ℃作用1 h,PBS洗涤3次。荧光显微镜下观察结果。将筛选出来的阳性杂交瘤细胞,按有限稀释法进行亚克隆,连续克隆3次获得稳定分泌抗体的杂交瘤细胞株。
1.5 杂交瘤细胞的鉴定
1.5.1 效价测定 用PBS将杂交瘤细胞上清分别稀释为1∶10、1∶20、1∶40、1∶80、1∶160后按照1.4项间接免疫荧光方法进行检测,可观察到特异性荧光的最高稀释度即为杂交瘤细胞上清的效价。
1.5.2 类及亚类的鉴定 采用单克隆抗体亚型鉴定试剂盒测定单克隆抗体类及亚类,操作方法按试剂盒说明书进行,OD值最高孔对应的即为相应亚型。
1.5.3 稳定性检测 将杂交瘤细胞株体外连续培养20代,分别取其第5、10、15和20代细胞上清,按照1.4间接免疫荧光方法测定效价。
1.5.4 Western blot鉴定 将GP5蛋白经SDS-PAGE后进行Western blot,一抗采用1∶5稀释的杂交瘤细胞上清,二抗采用工作浓度的HRP标记的羊抗鼠IgG。以经诱导的pCold-TF空载体作为对照。
1.6 单克隆抗体的制备 鼠腹腔注射液体石蜡致敏,每只0.5 mL。7 d后经腹腔注射杂交瘤细胞,将杂交瘤细胞浓度调整为2×106/mL,每只小鼠注射0.5 mL。待小鼠腹腔膨大时,收取腹水,4 ℃ 9500 r/min离心10 min,收集上清液,即为单克隆抗体。
1.7 单克隆抗体的纯化与鉴定
1.7.1 单克隆抗体的纯化 采用HiTrap MabSelect亲和纯化对腹水进行纯化,具体方法如下:将腹水4 ℃ 10000 r/min 离心10 min,取上清,用小型滤器过滤后置于冰上;将样品用冰冷的20 mmol/L PB 3 mol/L NaCl pH7.4溶液稀释5倍;用冰冷的20 mmol/L PB 3 mol/L NaCl pH7.4溶液平衡5 mL的HiTrap MabSelect亲和纯化亲和柱10个柱体积;将25 mL稀释样品上柱结合;上样完毕用冰冷的20 mmol/L PB 3 mol/L NaCl pH7.4溶液平衡2.5 mL的HiTrap MabSelect亲和纯化亲和柱10个柱体积;用200 mmol/L甘氨酸缓冲液,pH3.0溶液洗脱,收集完毕,立即加入调节溶液300 μL,轻轻混匀;收集完毕后,用冰冷的20 mmol/L PB 3 mol/L NaCl pH7.4溶液平衡HiTrap MabSelect亲和柱10个柱体积;收集的组分用SDS-PAGE检测。
1.7.2 浓度鉴定 采用紫外分光光度计测定纯化后的单克隆抗体浓度。
1.7.3 效价测定 用PBS将单克隆抗体稀释为1∶20、1∶100、1∶200、1∶400、1∶800、1∶1600后按照1.4项间接免疫荧光方法进行检测,可观察到特异性荧光的最高稀释度即为单克隆抗体的效价。
1.7.4 特异性检测 取PRRSV活疫苗CH-1R株、R98株、GDr180株、HuN4-F112株、JXA1-R株、TJM-F92株、PRRSV 46D和PRRSV30D分别接种已长成良好单层的Marc-145细胞,待细胞出现30%~50%病变时使用预冷的无水乙醇进行固定,按1.4方法进行单克隆抗体的特异性检测。将CSFV、PCV2接种PK15细胞,将BVDV接种MDBK细胞后,37 ℃、5% CO2条件下培养72 h,经预冷的无水乙醇固定细胞后按1.4方法进行单克隆抗体的特异性检测。
2 结果与分析
2.1 杂交瘤细胞株的建立及鉴定 采用纯化的GP5重组蛋白免疫8周龄Balb/c雌性小鼠,免疫3次后无菌采集小鼠的脾细胞,与处于对数生长期的S/P20细胞融合,通过间接免疫荧光方法筛选到1株针对GP5蛋白的杂交瘤细胞株,命名为3E10(图1)。对3E10按有限稀释法进行亚克隆,连续克隆3次获得稳定分泌抗体的杂交瘤细胞株。

1. 3E10杂交瘤细胞上清;2. 正常细胞对照
2.2 类及亚类的鉴定 采用Mouse单克隆抗体亚型鉴定试剂盒对3E10杂交瘤细胞进行鉴定,结果显示重链类型为IgM,轻链类型为Kappa(表1)。

表1 ELISA法测定单克隆抗体类及亚类
2.3 效价测定 将3E10杂交瘤细胞上清进行1∶10、1∶20、1∶40、1∶80、1∶160稀释后按照1.4项间接免疫荧光方法进行检测。结果1∶10、1∶20、1∶40均可观察到特异性荧光,3E10杂交瘤细胞上清效价为1∶40。
2.4 稳定性检测 使用间接免疫荧光方法对5代、10代、15代、20代杂交瘤细胞上清进行检测,结果效价均不低于1∶40,表明已获得能够稳定分泌单克隆抗体的杂交瘤细胞株。
2.5 Western blot鉴定 图2结果显示,3E10可与纯化的pCold-TF-GP5发生特异性结合,在72 ku的位置上出现特异性条带,阴性对照没有条带出现,这进一步表明单抗是针对GP5蛋白。

M.蛋白分子质量标准;1.诱导的pCold-TF空载体;2. GP5蛋白
2.6 腹水的纯化 待小鼠腹腔膨大时采集腹水,采集三次后对小鼠安乐死处死。将三次采集的腹水混合后采用HiTrap MabSelect亲和纯化方法进行纯化,SDS-PAGE检测结果表明单抗由2条清晰的带(轻链、重链各1条)组成,而无其他杂带(图3)。
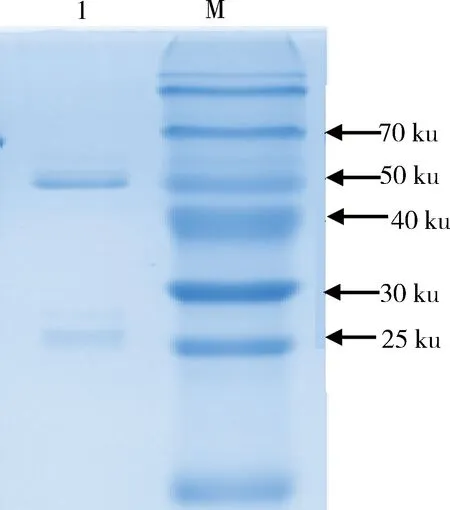
M. 蛋白分子质量标准; 1. 纯化的3E10单克隆抗体
2.7 腹水浓度及效价的测定 采用紫外分光光度计检测抗体纯度为0.204 mg/mL。将单克隆抗体进行系列稀释后进行间接免疫荧光检测,结果表明单克隆抗体效价为1∶200。
2.8 单克隆抗体的特异性检测 图4结果表明,3E10仅与PRRSV 46D、PRRSV30D反应,与PRRSV CH-1R株、R98株、GDr180株、HuN4-F112株、JXA1-R株、TJM-F92株其他分离株无荧光反应,与CSFV、PCV2、BVDV及正常Marc-145细胞无荧光反应。
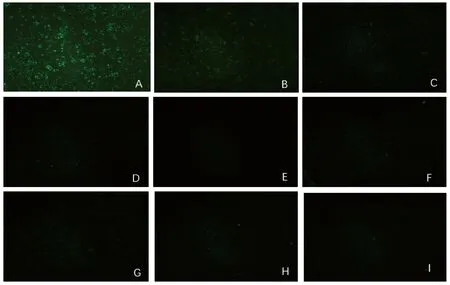
A.PRRSV 46D; B.PRRSV 30D; C. CH-1R; D. R98; E.GDr180; F. HuN4-F92;G. JXA1-R; H. TJM-F92; I. Normal Marc-145 cell
3 讨 论
目前PRRSV的诊断有间接免疫荧光、免疫组化、RT-PCR等方法,通常采用RT-PCR方法用于PRRSV经典株、高致病性毒株和NADC30-like毒株的鉴别检验[4]。相较于其他方法,间接免疫荧光方法具有操作简单、准确性高、特异性好的特点。此外,基于GP5蛋白的单抗也有用于中和试验的价值,国内已有成功制备具有中和活性IgM亚类单抗的报道[6]。本研究制备的3E10单克隆抗体,亚类鉴定为IgM,效价仅为1∶200,可能与纯化的方式不合适、腹水浓度较低有关。IgM抗体以五聚体结构存在,纯化难度极大,需要结合盐析及IEC或者SEC的多步操作,不仅繁琐且预期产量低。据报道,采用蛋白质L亲和层析和山羊抗鼠IgM抗体亲和层析效果较好[7],可以作为下一步3E10单克隆抗体纯化的参考。
PRRSV极易变异,这给该病防控工作带来了挑战。自1996年郭宝清等首次从我国分离到PRRSV[3],该病毒在我国已存在二十余年。根据田间自然分离株的基因组及致病性特征,可人为地将我国PRRS的流行大致分为三个阶段:第一个阶段为经典毒株流行阶段,第二个阶段为高致病性变异株的流行阶段,第三个阶段为NADC30-like毒株的流行[8]。自2012年周峰等[9]首次发现并报道NADC30-like毒株以来,该病毒已在我国猪群内广泛传播。通过对GP5氨基酸序列进行比对发现,NADC30-like毒株与经典PRRSV、高致病性PRRSV的氨基酸同源性较低,分别为83.6%~84.9%、83.6%~86.6%[10],比较适合用于PRRSV鉴别用单克隆抗体制备用免疫原。本研究采用纯化表达的PRRSV NADC30-like毒株GP5,成功筛选出一株可有效区分PRRSV NADC30-like毒株与经典株的单克隆抗体,证明了采用GP5蛋白用于PRRSV鉴别用单克隆抗体制备的可行性,也为下一步建立区分类NADC30毒株与经典株和变异株的诊断试剂奠定了基础。
