白蛋白结合型紫杉醇联合铂类药物治疗头颈肿瘤的疗效及对自然杀伤细胞活性的影响
2021-11-25葛方红曹剑锋何云华单桂芹
王 娟, 葛方红, 曹剑锋, 何云华, 单桂芹
(1. 南通大学附属通州医院 肿瘤科, 江苏 南通, 226300;2. 南通大学附属肿瘤医院 放疗科, 江苏 南通, 226361)
头颈肿瘤是指发生在咽喉部、口腔、唇部的恶性肿瘤。受多种因素影响,近年来头颈肿瘤患病率不断升高,经流行病学[1]估算统计, 2012年全球新发病例约52万例,占所有新发恶性肿瘤病例的3%。目前,头颈肿瘤的非手术治疗方式主要为化疗,紫杉醇(PTX)是化疗常用药,属于大分子细胞毒性药物,作为双萜紫杉烷类抗肿瘤药, PTX能够有效杀灭肿瘤细胞,抑制癌变因子转移、复制[2-3]。但此类药物需要借助聚氧乙烯蓖麻油作为助溶剂,极易诱发过敏反应,甚至可加重骨髓抑制,引发脱髓鞘反应和外周神经轴突变性[4]。
随着医疗技术的完善和改进,白蛋白结合型紫杉醇(nab-PTX)得到大力推广,作为纳米微粒白蛋白的载体, nab-PTX能够弥补传统PTX不足,改变助溶剂,无需类固醇药物处理,有效减少毒副反应,且通过半胱氨酸的酸性分泌蛋白途径和白蛋白受体穿胞途径来提高肿瘤外药物浓度,提高药效利用率,有效抑制肿瘤组织生长,获取满意的治疗效果[5]。目前,临床上关于nab-PTX联合铂类的疗效报道较多,但将其运用于头颈肿瘤患者治疗的研究仍较少。本研究以自然杀伤(NK)细胞活性、毒副反应、疾病缓解率、1年后生存率作为预后评估指标,分析nab-PTX联合铂类方案的近远期疗效,现报告如下。
1 资料与方法
1.1 一般资料
前瞻性选取2019年1月—2020年6月收治的头颈肿瘤患者75例,男44例,女31例,平均年龄(62.35±4.15)岁; 临床分期为Ⅲ期48例, Ⅳ期27例; 口咽癌13例,鼻腔癌16例,鼻咽癌22例,口腔癌9例,喉癌11例,外耳道癌4例。本研究符合《赫尔辛基宣言》的伦理审查标准。纳入标准: ① 符合头颈肿瘤临床诊断标准者[6]; ② 预计生存时间≥3个月者; ③ 无化疗药物过敏者; ④ 签署书面知情同意书者。排除标准: ① 同时接受其他抗肿瘤治疗方案者; ② 未完成治疗方案者; ③ 存在化疗禁忌证者。将75例患者随机分为观察组37例和对照组38例, 2组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
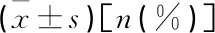
表1 2组患者一般资料比较
1.2 方法
所有患者给予卡铂(齐鲁制药,国药准字H20020181)静脉滴注300 mg/m2, 滴注时间超过60 min, 第1天; 或顺铂(齐鲁制药有限公司,国药准字H37021358)静脉注射25 mg/m2第1~3天。对照组静脉滴注PTX(扬子江药业,国药准字H20053001), 第1天,每次135 mg/m2, 且在给药前30 min肌肉注射25 mg异丙嗪(酒泉大得利制药,国药准字H62020337), 静脉滴注100 mg雷尼替丁(福建省闽东力捷迅药业,国药准字H20041735)、10 mg地塞米松(江苏吴中医药集团,国药准字H32021399)。观察组静脉滴注nad-PTX(江苏恒瑞医药股份有限公司,国药准字H20183378)130 mg/m2, 第1、8天静脉滴注,注射前无需预处理。2组均以21 d为1个周期,连续治疗4个周期。
1.3 观察指标
① 采用赛默飞公司Attune NxT流式细胞仪测定NK细胞活性; ② 观察并记录毒副反应,包括周围神经炎、腹泻、恶心呕吐、贫血、白细胞减少、血小板减少等; ③ 随访12个月,统计2组患者生存率,计算平均生存时间。
1.4 判定标准[7]
疾病控制率(DCR)=[完全缓解(CR)+部分缓解(PR)+疾病稳定(SD)]/总例数×100%。CR: 靶病灶消失; PR: 靶病灶直径之和减少≥30%; SD: 直径之和减少<30%或增加<20%; 疾病进展(PD): 病灶直径之和增大≥20%或出现新的病变。
1.5 统计学处理
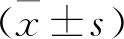
2 结 果
2.1 2组不同时点DCR比较
治疗后1、2、4个周期时, 2组组内不同时点DCR比较,差异有统计学意义(P<0.01); 观察组治疗后1、2、4个周期时DCR均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组不同时点DCR比较[n(%)]
2.2 2组不同时点NK细胞活性比较
治疗前, 2组NK细胞活性比较,差异无统计学意义(P>0.05); 治疗后2、4个周期, 2组NK细胞活性均较治疗前逐步升高,且组内不同时点NK细胞活性比较,差异均有统计学意义(P<0.05); 观察组治疗后2、4个周期时NK细胞活性均高于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组不同时点NK细胞活性比较 %
2.3 2组毒副反应比较
观察组周围神经炎、腹泻、恶心呕吐、白细胞减少、血小板减少等毒副反应发生率低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组毒副反应比较[n(%)]
2.4 2组生存情况比较
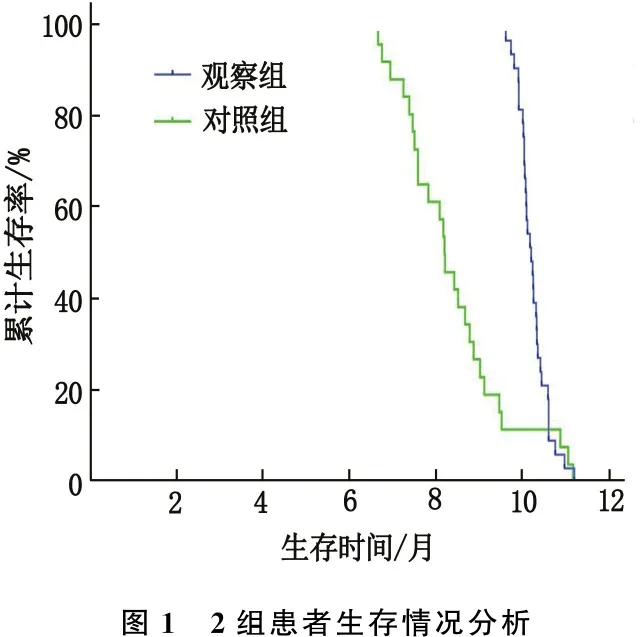
观察组1年后生存率高于对照组,生存时间长于对照组,差异有统计学意义(P<0.05或P<0.01), 见表5、图1。
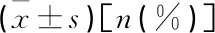
表5 2组生存率和生存时间比较
3 讨 论
研究[8]显示,头颈肿瘤占全身肿瘤的22%,位居所有恶性肿瘤的第6位,早期病例可通过手术治疗切除病变组织,阻止癌变因子转移,但头颈肿瘤症状发病隐匿,易被忽略,患者确诊时大多为中晚期,故多采取化疗干预。卡铂作为第2代铂类化合物,能够作用于DNA鸟嘌呤上,引起链内交联及DNA链间交联,阻止螺旋解链,破坏DNA分子,干扰其合成,发挥一定的抗肿瘤功效,但单用效果欠佳,故常作为辅助类用药。PTX是紫杉烷类二萜化合物,能够通过被动扩散进细胞膜,并直接作用于细胞微管网,抑制纺锤体正常形成,加速微管二聚体聚合速度,阻断癌细胞周期形成,促使肿瘤细胞异常有丝分裂,具有极为独特的抗肿瘤机制[9-10]。PTX水溶性极低,不溶于水,常需以无水乙醇、聚氧乙烯蓖麻油作为助溶剂,但以上两种成分存在生物学效应,在体内释放组胺、降解后,可引起血液毒性、神经毒性、严重过敏等不良反应。
作为一种不含聚氧乙烯蓖麻油的全新PTX制剂, nab-PTX以人血白蛋白为载体,利用高压振动技术将人血白蛋白和PTX制成纳米微粒冻干剂,通过静脉滴注能够形成粒径约为130 nm的纳米悬浮液,利用肿瘤摄取营养生物制剂的特性,药效可直接作用至肿瘤部位,避免助溶剂引起的不良反应,安全性较高[11-12]。本研究中,观察组各时间点DCR均高于对照组,说明nab-PTX在抗肿瘤功效中具有显著作用。作为新型PTX药, nab-PTX不仅与PTX作用相似,能够将细胞周期阻断于G2/M周期,有效抑制肿瘤细胞异常有丝分裂,还可增强PTX水溶性,增强对肿瘤细胞靶向识别,有效抑制癌变因子转移、生长、复制,更具有消除半衰期长、血药浓度-时间曲线下面积小、清除率高优势[13-14]。
有研究[15]表明, NK细胞活性是反映抗肿瘤效应的重要预后评估指标。本研究结果显示, 2组接受相应化疗方案干预后的NK细胞活性均有所改善,说明PTX具有一定抗肿瘤作用,但观察组治疗后NK细胞活性改善情况更优,说明nab-PTX能够将抗肿瘤效应发挥至最大。与传统PTX制剂比较, nab-PTX能够更快离开血液并分布至组织,不仅可与血管内皮细胞膜表面特异性白蛋白细胞结合,激活细胞膜囊泡,导致受体介导的白蛋白药物进入细胞膜,完成跨膜运转,使得药物更易进入肿瘤细胞,而且对组织亲和力较高,有效促使药物从组织间靶向聚集至肿瘤细胞内,获取满意的治疗效果[16]。本研究还显示, nab-PTX治疗安全性较高,即使出现不良反应,也多为轻度,患者大多可耐受,原因是nab-PTX作为新型紫杉醇,无需使用助溶剂,可大大降低不良反应发生率,且最大血药浓度是传统紫杉醇的6.5倍,以白蛋白作为载体,并不影响紫杉醇代谢,且无需通过正常组织,减少对正常细胞毒性反应,降低神经病变等不良反应。从远期疗效分析,观察组1年后生存率高于对照组,进一步证明nab-PTX具有显著的抗肿瘤效果,在微囊蛋白-1(caveolin-1)帮助下利于胞吞作用将nab-PTX送至组织间隙,并在肿瘤组织内蓄积,可提高药物吸收利用度,更好抑制肿瘤细胞生长,延长患者生存时间[17]。
综上所述, nab-PTX联合铂类具有显著的抗肿瘤作用,不仅能够增加药效分布面积,提高药物吸收利用率,还可提高用药安全性。本研究也存在样本量较少、纳入人群不广泛等局限性,后续需扩大样本进行深入研究。
