促红细胞生成素对视网膜Müller细胞光损伤的作用及机制
2021-11-25贡亦清孟娜娜
贡亦清, 孟娜娜
(江苏大学附属人民医院/镇江第一人民医院 眼科, 江苏 镇江, 212002)
年龄相关性黄斑变性是老年人群不可逆致盲的主要原因,长期慢性光损伤是发病的主要因素,过度的紫外线辐射容易导致年龄相关性黄斑变性。Müller细胞是视网膜的神经胶质细胞,对视网膜神经细胞有支持、营养功能,与年龄相关性黄斑变性的发病有关。近年来研究表明,促红细胞生成素(EPO)在保护神经元抗氧化、减少缺血导致的细胞凋亡等方面有明显作用[1], 但关于其对视网膜Müller细胞光损伤保护机制的报道较少。本研究利用紫外线光损伤的小鼠Müller细胞模型探讨EPO对Müller细胞光损伤的作用机制,并初步研究EPO玻璃体腔注射对小鼠光损伤的作用,为 Müller细胞参与介导多种年龄相关性黄斑变性等视网膜光损伤相关疾病的病理机制及治疗研究提供新思路,现报告如下。
1 材料与方法
1.1 材料
研究对象为小鼠原代Müller细胞(来自南京医科大学附属眼科医院实验室)和24只小鼠。主要试剂为促红细胞生成素(EPO, Sigma-Aldrich公司); 蛋白激酶B(Akt)抗体(Cell Signaling Technology公司); MK-2206(Akt抑制剂, Selleck公司)。
1.2 实验方法
1.2.1 Müller细胞紫外线光损伤模型建立: 实验时选取前期培养的小鼠原代Müller细胞,接种于培养皿中。待细胞生长融合至 70%~80%时,弃旧培养液。培养皿中加入新磷酸缓冲盐溶液(PBS)并清洗 2~3遍,然后更换新鲜不含血清的达尔伯克改良伊格尔培养基(DMEM)培养液继续培养 24 h。采用紫外线仪对暗室中的无菌操作台进行照射。紫外线仪照射剂量为30 mJ/cm2。
1.2.2 MTT法检测细胞活性: 本部分实验分两部分,首先检测药物对紫外线损伤的作用,将Müller细胞分为无紫外线组和紫外线组,每组均用不同浓度药物处理。采用指定浓度的EPO(0、0.1、1、10 μg/mL)预处理Müller细胞30 min, 进行紫外线照射(30 mJ/cm2)后,细胞进一步培养24 h。通过MTT法检测细胞活性,酶标仪放置490 nm处检测吸光度(OD)值,每组重复6次, OD值越高代表细胞损伤程度越小,细胞活性越强。根据此阶段的实验结果选择适合的EPO浓度(1 μg/mL)并用于之后的实验步骤。其次检测Akt抑制剂预处理后对上述实验的影响,并将Müller细胞分2组: 二甲基亚砜(DMSO)对照组(DMSO组)和Akt抑制剂MK-2206组(MK-2206组)。Müller细胞分别采用0.1% DMSO 5 μmol/L预处理1 h、Akt抑制剂MK-2206(5 μmol/L)预处理1 h。以上细胞均以3种方式进行处理: ① 无紫外线组,不处理; ② 紫外线组,采用UV辐射(30 mJ/cm2) 30 min; ③ 紫外线+药物组,采用1 μg/mL的EPO预处理30 min, 再进行紫外线(30 mJ/cm2)辐射30 min细胞进一步按照指定时间培养。分别用MTT检测细胞活性,每组重复6次。
1.2.3 蛋白质免疫印迹法(Western blot)检测Akt信号通路: 采用指定浓度的EPO(0、0.1、1、10 μg/mL)处理Müller细胞1 h,采用蛋白质免疫印迹法检测磷酸化Akt、p-Akt(Ser-473)和Akt1的表达。
1.2.4 小鼠眼内注药实验: 将24只小鼠分为无注射组(小鼠右眼,n=6)、注射组(小鼠左眼,n=6)、光照组(无注射眼接受光照,n=6)、光照+注射组(注射眼接受光照,n=6)共4小组,分别检查视网膜电图(ERG)的A波和B波。选用小鼠(6~8周龄)6只,小鼠在黑暗中适应24 h。然后,给小鼠0.5%盐酸去氧肾上腺素使其瞳孔放大,暴露在白色荧光灯下(5 000 lux)。为了评估EPO的活性,在光前暴露30 min。左眼玻璃体腔内注射EPO(50 ng), 右眼为未注射EPO。在光暴露前及24 h以后,检测ERG, ERG记录过程是在昏暗红光下进行的。① 眼内注射EPO: 水合氯醛溶液麻醉小鼠,将小鼠固定。使用微量注射器抽取EPO(50 ng/5 μL),距角巩缘约1.0 mm处眼球睫状体平坦部刺入玻璃体腔,避开视网膜血管和晶状体; 轻柔缓慢地将EPO推注入玻璃体腔内。② 光损伤模型: 小鼠在暗室24 h。将散瞳后的小鼠暴露于5 000 lux白色荧光灯下2 h, 再将小鼠放置暗室24 h。③ 视觉电生理检查: 光损伤模型建立24 h, 对各组小鼠进行闪光ERG检查,以评估视觉功能受损情况。暗适应2 h后,在暗光下对小鼠进行浅麻醉,并将小鼠固定; 卧于平台,头部完全伸入全视野刺激器; 调整电极,使正极放置于角膜表面,负极放置于同侧面颊部皮下,地级放置于耳后或尾部皮下; 行电生理程序,测量A波及B波。
1.3 统计学分析
采用Graphpad 6.0软件对数据进行处理,采用独立样本t检验和Scheff′s 法多重比较,P<0.05 为差异有统计学意义。
2 结 果
2.1 细胞活性检测
紫外线组不同浓度EPO预处理后的细胞MTT检测的OD值与无紫外线组比较,差异有统计学意义(P<0.05), 表明UV辐射诱导的Müller细胞活性下降,死亡数量增多。Scheff′s法多重比较显示, EPO(0.1、1、10 μg/mL)预处理后的细胞MTT检测的OD值较未处理细胞大幅提高,差异有统计学意义(P<0.01)。EPO诱导的Müller细胞保护作用也随EPO浓度的增高(0.1、1 μg/mL)而增强,差异有统计学意义(P<0.05), 而1、10 μg/mL浓度处理的细胞保护作用比较,差异无统计学意义(P=0.114), 见表1。由于1 μg/mL的EPO就能显著保护Müller细胞,所以将这个浓度用于接下来的研究。

表1 2组Müller细胞不同浓度EPO预处理后MTT检测的OD值比较
采用DMSO或MK-2206预处理Müller细胞后检测紫外线对细胞损伤的作用。结果显示,采用DMSO组和MK-2206处理的无紫外线组细胞损伤程度比较,差异无统计学意义(P>0.05); DMSO和MK-2206处理后的紫外线组细胞损伤程度比较,差异有统计学意义(P<0.05)。DMSO和MK-2206处理后的紫外线+药物组[采用MK-2206预处理Müller细胞后再用EPO(1 μg/mL)进行预处理]细胞损伤程度比较,差异有统计学意义(P<0.05)。Scheff′s法多重比较显示,紫外线+药物组与紫外线组DMSO处理的细胞损伤程度比较,差异有统计学意义(P<0.05); 紫外线+药物组与紫外线组MK-2206处理的细胞损伤程度比较,差异无统计学意义(P=0.06), 见表2。

表2 不同组别MTT检测的OD值比较
2.2 信号通路检查
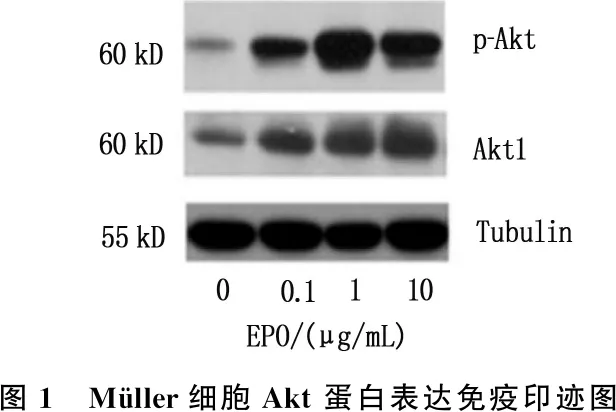
采用指定浓度的EPO(0、0.1、1、10 μg/mL)处理Müller细胞1 h, 采用Western blot检测p-Akt(Ser-473)和Akt1的表达,结果显示, Müller细胞中蛋白表达水平增高,且在0.1、1 μg/mL浓度存在浓度依赖性,见图1。
2.3 小鼠视网膜光损伤和ERG比较
无注射组和注射组A波和B波振幅比较,差异无统计学意义(P=0.17)。无注射组与光照组及光照+注射组振幅比较,差异均有统计学意义(P<0.05)。光照+注射组与光照组振幅比较,差异有统计学意义(P<0.05)。见图2。

3 讨 论
人眼面对室外紫外线或室内荧光屏均会产生光损伤,长期慢性光损伤引起的凋亡可以引起老年性黄斑变性,导致视力逐渐丧失。Müller细胞是视网膜中十分重要的神经胶质细胞,占神经胶质细胞的90%以上,整个细胞分布于视网膜内界膜和外界膜之间,包绕光感受器细胞、双极细胞、神经节细胞等大部分神经元。Müller细胞有丰富的线粒体和高尔基体,能合成和存储糖原、分泌多种生长因子,为神经细胞提供营养支持[2]。Müller细胞在视网膜神经元的发育、营养、代谢中均发挥着重要作用[3]。
促红细胞生成素为Ⅰ型细胞因子超家族的糖蛋白激素。EPO通过与促红细胞生成素受体(EPOR)结合发挥神经保护功能。EPOR除了肾脏以外,还存在于大脑[4]和视网膜[5]中。EPO与EPOR结合后,引起EPOR构象改变,活化的JAK2激酶磷酸化下游激酶,从而引起多个下游信号通路活化,这些信号通路主要包括转录因子5(STAT5)、促分裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K/Akt)等。视网膜中的EPOR主要位于感受器内外段,外核层、内核层以及节细胞层均有表达[6], 光损伤后24 h, 在感受器内外段表达明显增强, 72 h后全层表达都增多。在正常大鼠视网膜中, Müller细胞是EPO产生的主要来源[7]。研究[9]证实,外源性EPO对缺血性视网膜神经细胞有保护作用[8],对高浓度葡萄糖培养的大鼠视网膜Müller细胞有保护作用。视网膜最常见的损伤为光损伤,既往文献[10]发现, EPO对视网膜光损伤有保护作用,但机制方面研究较少,尤其未针对Müller细胞进行研究。
本研究小鼠细胞实验证明,在小鼠原代视网膜Müller细胞中,紫外线照射后细胞活性明显下降,但采用EPO(0.1、1、10 μg/mL)对Müller细胞预处理30 min后,紫外线诱导的Müller死亡细胞减少,说明EPO能减轻紫外线对Müller细胞的损伤。既往研究[11]表明, EPO能够上调PI3K/Akt和JAK2途径,有助于维持视网膜色素上皮细胞(RPE)和Müller细胞的渗透压。此外, Akt1的磷酸化随后促进RPE细胞对氧诱导损伤的抵抗力。糖尿病大鼠中EPO通过下调缺氧诱导因子-1α(HIF-1α)和c-Jun氨基末端激酶(JNK)信号发挥对视网膜的保护作用[12]。为了探讨EPO对Müller细胞抗紫外线损伤的分子机制,本研究采用Western blot法证实了EPO能够激活Müller细胞的Akt, 且存在浓度依赖性。
PI3K/Akt是细胞存活的经典信号通路,保护机制包括产生神经生长因子和神经营养因子抑制神经元凋亡,磷酸化激活下游底物抑制细胞凋亡,通过线粒体通路干预神经细胞凋亡等,而Akt处于该通路的中心环节。Akt是丝/苏氨酸蛋白激酶,家族成员有Akt1、Akt2、Akt3 3个亚型,可以通过磷酸化作用或抑制其下游靶蛋白激活Akt, 继而介导多种生长因子诱发细胞生长,经过多种途径促进细胞存活[13]。常用的检测Akt磷酸化的位点有308和473[14]。EPO可以通过PI13K/Akt和ERK1/2信号传导通路对钙内流进行调节,从而保护神经细胞。
为了进一步确认Akt信号系统的作用,实验中引入了Akt的抑制剂MK-2206, 从而反证Akt信号通路的作用。MK-2206是第1个进入临床阶段的Akt小分子抑制剂, MK-2206限制Akt构象改变,同时可以阻止Akt调节的下游信号分子的磷酸化[15]。实验表明, MK-2206预处理增强了紫外线对Müller细胞的损伤,且经MK-2206预处理后, EPO对Müller细胞保护作用也明显减弱,说明MK-2206阻断了EPO对 Müller细胞抗UV的保护作用,反证了EPO对Müller细胞保护作用可能是通过Akt信号通路实现的。
EPO对于青光眼、年龄相关性黄斑变性等疾病有一定的治疗作用[16], 除了传统全身给药途经外,近年来有局部给药研究。研究[17]表明,小鼠鼻内给药是一种将EPO输送至视网膜的无创且有效的方法。糖尿病大鼠单次玻璃体内注射EPO, 可以有效发挥神经保护和神经营养作用[18]。因此,在细胞实验基础上,本研究进一步开展了动物实验,对小鼠实行眼内玻璃体注射EPO。闪光ERG能够客观、敏感地反映全视网膜的整体功能[19], 小鼠暴露于白色荧光灯下2 h后,闪光ERG的A波和B波增幅下降,说明光照损伤了视网膜; 小鼠玻璃体腔注射EPO后,闪光ERG的A波、B波下降程度明显减轻,说明眼内注射EPO对小鼠视网膜光损伤有改善作用。
综上所述, EPO对小鼠视网膜光损伤Müller细胞有保护作用,其作用可能是通过PI3K/Akt信号通路实现的, EPO玻璃体腔注射能减轻小鼠视网膜光损伤。年龄相关性黄斑变性是一种复杂的疾病,其病理与光损伤诱发的氧化应激有关。因此, EPO可能对年龄相关性黄斑变性和其他视网膜退行性疾病有一定治疗作用。
