甘肃省庆阳市辣椒镰孢菌根腐病病原鉴定及生物学特性
2021-11-25连芸芸李焕宇李惠霞姜伟李金鸿石明明韩变
连芸芸,李焕宇,李惠霞,姜伟,李金鸿,石明明,韩变
(甘肃农业大学植物保护学院,甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
辣椒(CapsicumannuumL.)是茄科辣椒属植物,原产于中拉丁美洲热带地区,现于世界各国普遍种植[1-2],既可作调料、蔬菜和观赏植物,还可用作药物、天然色素、化妆品和驱虫剂活性成份的提取原料[3].辣椒根腐病是一种常见的土传病害[4],在国外已有报道[5],国内自20世纪50年代俞大紱首次报道以来[6],现已遍及全国.已报道的辣椒根腐病致病菌有镰孢属[7]、疫霉属[8]和腐霉属[9]等,其中镰孢菌是引起辣椒根腐病的主要病原菌.由镰孢菌引起的辣椒根腐病发生周期长,在幼苗期及生长期均能发生,主要侵染辣椒根及根茎部,导致辣椒减产造成严重的经济损失.镰孢菌产生的毒素等次生代谢产物可引起人畜中毒,严重时甚至造成死亡[10].郝蓉蓉等[11]发现引起西藏地区辣椒根腐病的镰孢菌是尖孢镰孢菌(Fusariumoxysporum),蔡高磊等[12]报道了湖北省十堰市的辣椒根腐病是由茄镰孢菌(F.solani)引起的,黄建都等[13]认为茄镰孢菌(F.solani)是福州地区辣椒根腐病的致病菌,但对甘肃省庆阳市辣椒根腐病菌的研究尚未见报道.
本试验以庆阳地区辣椒根腐病2株代表性菌株67R5c和68R5b为材料,通过致病性测定、基于形态学和翻译延伸因子TEF-1α基因序列分析病原菌种类,并测定其生物学特性,为明确其病原菌组成和该病害的有效防治提供理论依据.
1 材料与方法
1.1 试验材料
供试菌株:菌株67R5c和68R5b保存于甘肃农业大学植物保护学院植物病原真菌学实验室.
供试培养基:PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,自来水1 L;WA培养基:琼脂粉20 g,自来水1 L;CLA培养基:琼脂粉20 g,自来水1 L,培养皿在倒入培养基前加入10~12片无菌康乃馨叶片(3~5 mm2);查氏培养基:NaNO32.0 g,KCl 0.5 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,FeSO40.01 g,蔗糖30 g,琼脂粉15 g,蒸馏水1 L.
以上4种培养基在121 ℃高压蒸汽灭菌30 min后备用.
1.2 试验方法
1.2.1 病原菌纯化 供试病原菌在PDA培养基上活化后,按常规方法在WA平板上单孢纯化[14],纯化菌株保存于4 ℃冰箱备用.
1.2.2 病原菌致病性测定 采用改良平皿法[15]测定供试菌的致病性.将直径5 mm菌饼接于WA培养基小烧杯中,盖上灭菌铝箔培养3 d.将发芽的辣椒种子均匀插入菌饼周围,置于25 ℃光照培养箱中恒温培养15 d后观察发病情况.以相同条件下培养的辣椒为对照.试验重复3次,每重复15株.
1.2.3 形态学鉴定 菌株接种于PDA培养基后,置于25 ℃培养箱中培养,5 d后观察菌落性状.菌株接种CLA培养基后,于25 ℃人工智能培养箱内12 h,光照/黑暗交替培养,14 d后观察形态特征,并拍照记录.根据菌株形态特征进行病原鉴定[16-18].
1.2.4 分子生物学鉴定 将菌株接种于PD培养液后,在(25±0.5)℃ 120 r/min摇床中振荡培养7 d,过滤菌液获得菌丝.取新鲜菌丝100 mg,加入液氮后充分研磨后转移至1.5 mL无菌离心管中,用试剂盒E.Z.N.A.TMHP Fugal DNA Kit(OMEGA)提取基因组DNA,用引物EF1(5′-ATGGGTAAGGARGACAAGAC-3′)和EF2(5′-GGARGTACCAGTSATCATG-3′)进行PCR扩增[19].扩增体系为25.0 μL:DNA模板1.0 μL、Taq酶0.25 μL、上下游引物各1.0 μL(10 μmol/L)、10×Buffer(Mg+)2.5 μL、dNTP(10 mM)0.5 μL,ddH2O 18.75 μL.PCR扩增程序:94 ℃预变性3 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,进行34个循环,72 ℃终延伸10 min.
电泳检测PCR产物后,将有特异性条带的PCR扩增样品送至北京擎科生物科技有限公司西安分公司测序.将获得的序列校对拼接后,在GenBank中进行BLAST搜索并下载相似度较高的序列,经序列比对后用PAUP软件以最大简约法(MP)构建系统发育树.
1.2.5 病原菌生物学特性研究
1.2.5.1 不同培养温度、光照条件对病原菌生长和产孢的影响 以查氏培养基为基础培养基,接种后分别放置于5、10、15、20、25、30、35、40 ℃培养箱中培养;放置于全光照、全黑暗、光暗交替(各12 h)的培养箱中25 ℃暗培养.每处理3次重复.病原菌培养5 d后,用十字交叉法测量菌落直径,培养12 d时,以每皿5 mL 0.1%吐温洗脱孢子,采用血球计数板法测量病原菌产孢量.
1.2.5.2 不同碳、氮源对病原菌生长和产孢的影响 称取与蔗糖等量的葡萄糖、乳糖、麦芽糖、甘露醇和淀粉制成Czapek培养基,以不加碳的为对照培养基.选用与硝酸钠等量的硫酸铵、牛肉膏、蛋白胨、硝酸钾和硝酸铵制成Czapek培养基,以不加氮的为对照培养基.将病原菌接种于不同碳氮源培养基后,25 ℃暗培养.每处理重复3次.测定菌落直径和产孢量同1.2.5.1.
1.3 数据处理
所得数据用Excel 2010进行整理,用SPSS 22.0进行差异显著性统计分析.
2 结果与分析
2.1 供试菌株的致病性
辣椒种子接种供试病原菌15 d后的发病情况如图1所示.对照辣椒幼苗健康不发病,根部无任何症状.接种菌株68R5b的辣椒苗茎基部及根部有黑色或褐色病斑,后期呈水渍状,辣椒叶片有萎蔫症状.接种菌株67R5c的辣椒幼苗茎基部有黑色或褐色病斑,病斑面积小,后期呈水渍状.表明2个菌株均能侵染辣椒根部及茎基部,引起辣椒根腐,菌株68R5b致病力强于菌株67R5c.
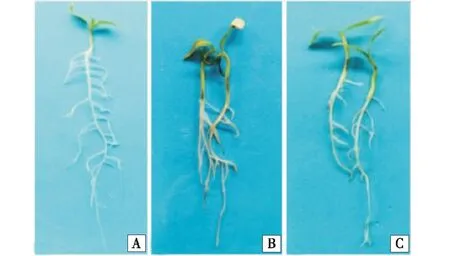
A:对照;B:接种菌株为68R5b;C:接种菌株为67R5c.
2.2 病原形态特征
菌株68R5b在PDA平板上生长较快,菌落平展,边缘圆形,菌丝较稠密,菌落正反面浅紫色,菌丝稀疏呈卷毛状;产孢细胞结构为单瓶梗;大孢子数目多,1~6隔,大小为(16.1~39.7)μm×(3.5~6.3)μm,纺锤形,基胞足跟较尖,呈钩状;小孢子0~1隔,大小为(5.4~14.8)μm×(2.8~5.2)μm,椭圆形或卵形或肾形;厚垣孢子单生或串生,壁光滑(图2).
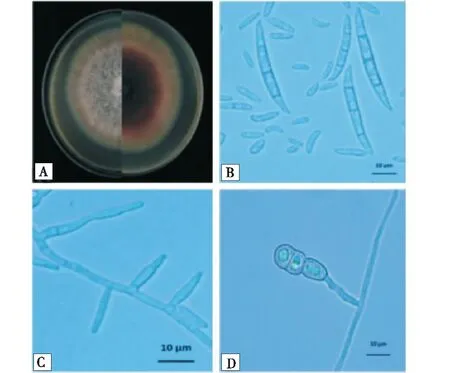
A:菌落性状;B:分生孢子;C:分生孢子梗;D:厚垣孢子.
菌株67R5c在PDA平板上生长快,菌落平展,边缘为毛状,菌落正反面为白色或灰白色,菌丝稠密呈絮状;产孢结构为单瓶梗;大孢子数目多,1~5隔,大小为(16.9~30.0)μm×(3.3~5.5)μm,马特型,两端钝,顶胞稍尖,基胞有圆形足跟;小孢子数目较多,0~1隔,大小为(6.1~14.9)μm×(2.2~4.3)μm,卵形或椭圆形或肾形;厚垣孢子单生或串生,壁粗糙(图3).
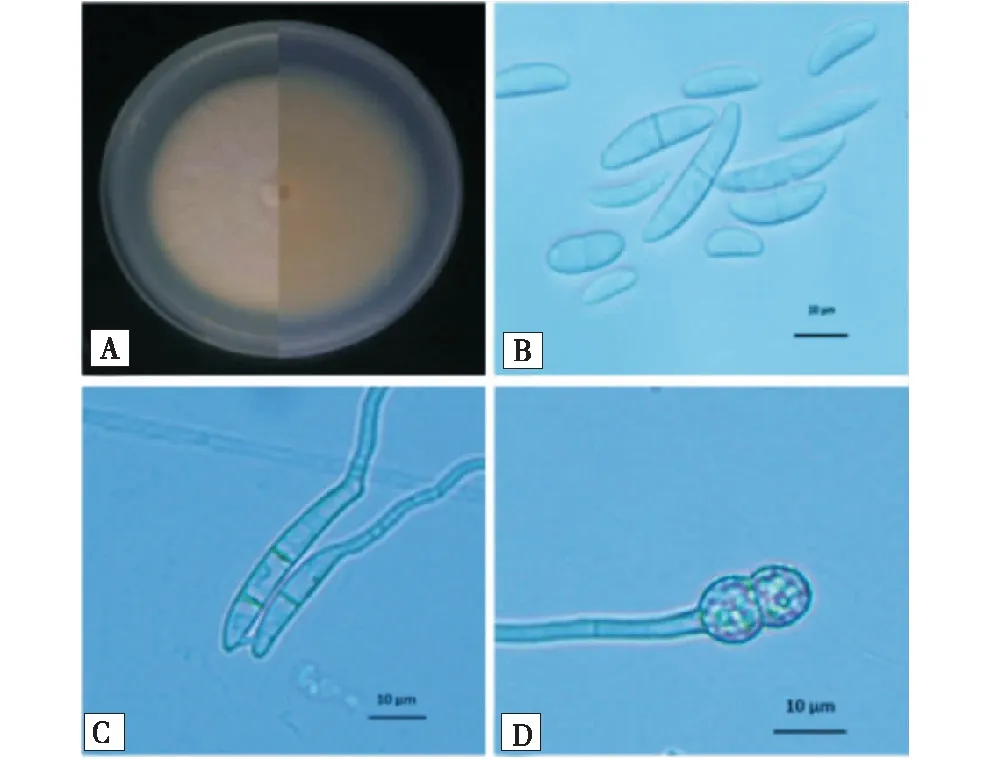
A:菌落性状;B:分生孢子;C:分生孢子梗;D:厚垣孢子.
2.3 病原菌系统发育分析
在基于TEF-1α序列构建的系统发育树中(图4),病原菌68R5b与数据库中尖孢镰孢菌(登录号为DQ837693、AF008481、MT630354、KT239473、FJ985374等)序列相似度达99%以上,聚在同一支;病原菌67R5c与数据库中茄镰孢菌(登录号为MN652888、MN152326、MN652893、MN650108等)序列相似度达99%以上,聚在同一支.结合形态学鉴定和分子鉴定结果,将菌株68R5b鉴定为尖孢镰孢菌(F.oxysporum),菌株67R5c鉴定为茄镰孢菌(F.solani).
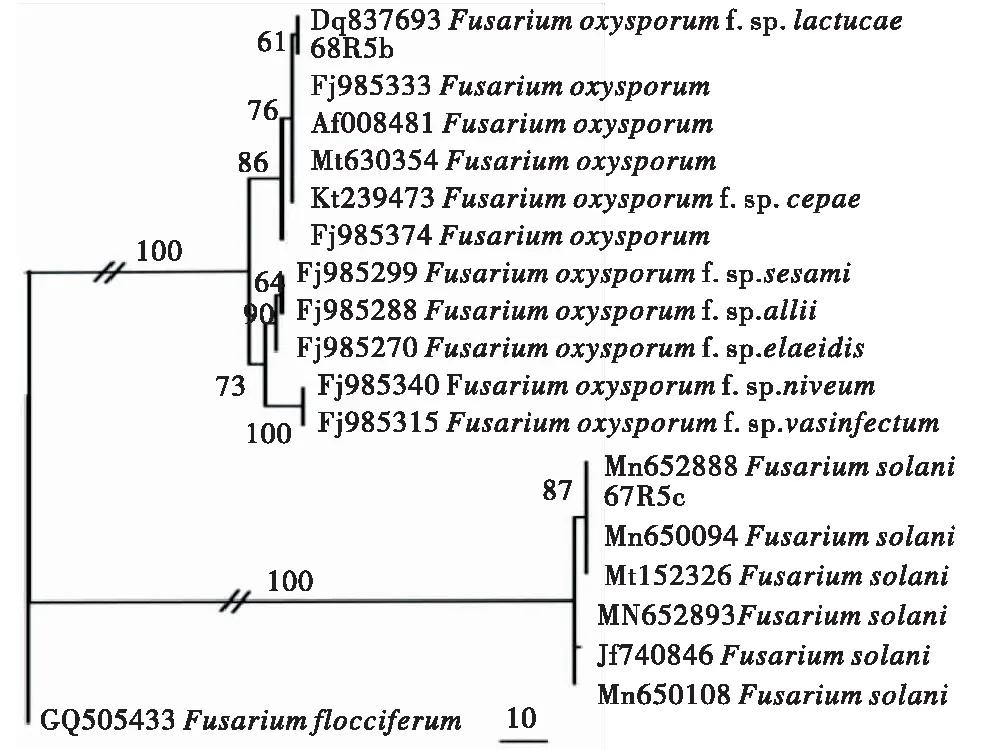
本试验中供试菌株以粗体字表示,//表示分支进行了缩短,标尺指示10步变化.
2.4 病原菌的生物学特性
2.4.1 培养温度对病原菌生长和产孢的影响 由表1可知,2种病原菌在40 ℃高温和5 ℃低温下几乎不生长.尖孢镰孢菌生长适宜温度范围为25~30 ℃,最适生长温度为25 ℃,菌落直径达49.67 mm.茄镰孢菌最适生长温度为30 ℃,菌落直径为59.00 mm,显著高于其他温度处理.在25 ℃时,尖孢镰孢菌产孢最多,为13.92×106个/mL.在30 ℃时,茄镰孢菌产孢最多,达到4.23×106个/mL,均显著高于其他处理.40 ℃高温条件下2种病原菌均不产孢,且低温抑制病原菌产孢.

表1 培养温度对供试病原菌生长和产孢的影响
2.4.2 光照条件对病原菌生长和产孢的影响 由表2可知,不同光照条件对尖孢镰孢菌的生长无显著影响,全光照条件下菌落直径最大,为42.67 mm,且产孢量最大,为4.91×106个/mL,显著高于全黑暗和光暗交替.全黑暗条件下有利于茄镰孢菌生长和产孢,菌落直径为42.67 mm,产孢量为3.73×106个/mL,而全光照和光暗交替则不利于菌丝生长和产孢.

表2 光照条件对供试病原菌生长和产孢的影响
2.4.3 碳源对病原菌生长和产孢量的影响 2种病原菌在供试的6种碳源培养基上均生长良好,而在对照培养基上菌丝非常稀疏或几乎不生长(表3).尖孢镰孢菌丝生长和产孢的最适碳源分别是淀粉和蔗糖,菌落直径为62.50 mm,产孢量为12.7×106个/mL,均显著高于其他碳源培养基.茄镰孢菌生长的最适碳源是淀粉,菌落直径为52.83 mm,其次为乳糖、甘露醇、麦芽糖和葡萄糖;产孢的最适碳源是葡萄糖和蔗糖,产孢量在2.51×106~2.71×106个/mL之间,与其他4种碳源培养基的产孢量差异显著.
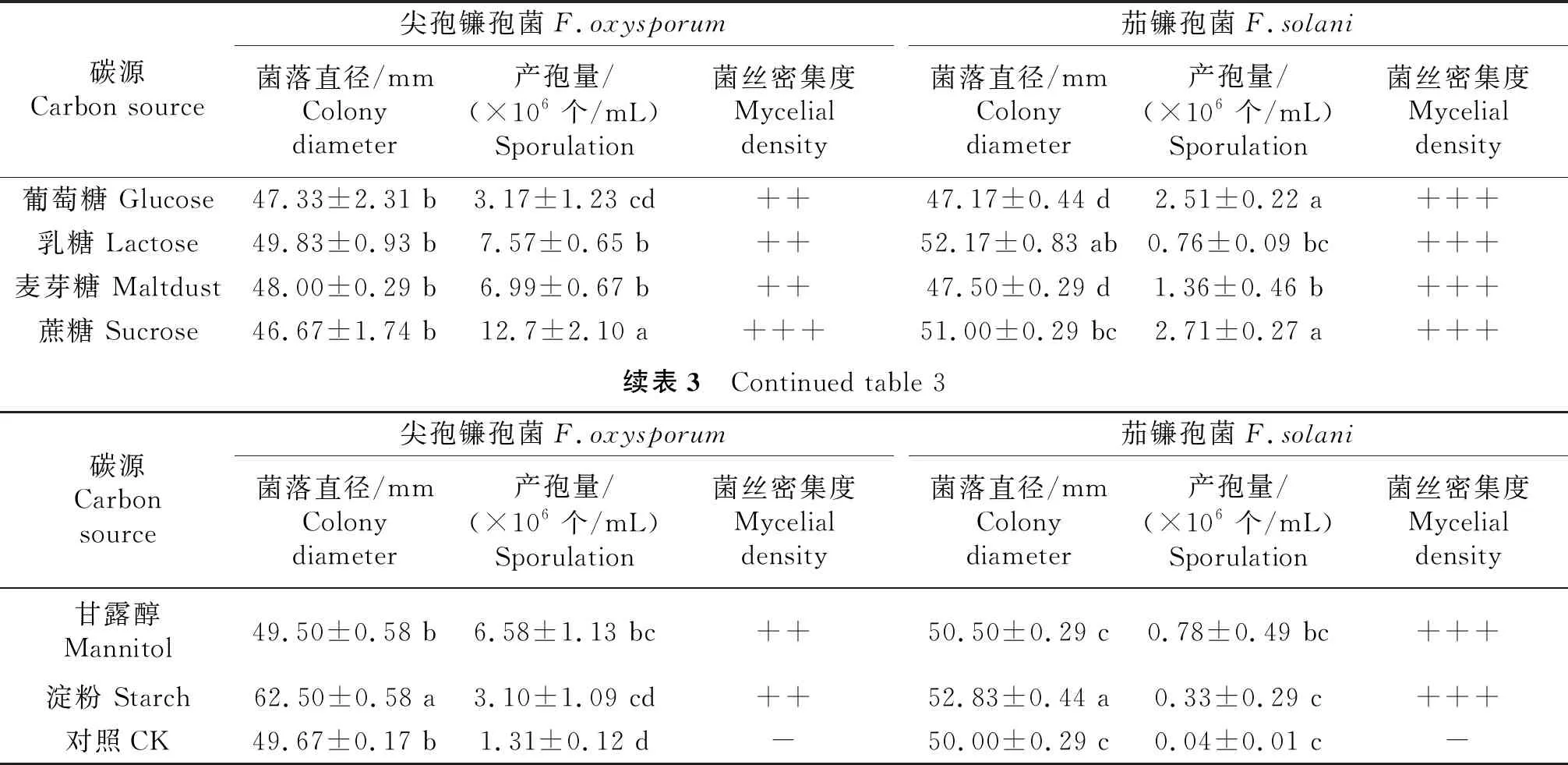
表3 碳源对供试病原菌生长和产孢的影响
2.4.4 氮源对病原菌生长和产孢量的影响 由表4可以看出,与对照相比,2种病原菌在供试的6种氮源培养基上均生长良好.尖孢镰孢菌生长的最适氮源为蛋白胨,菌落直径为57.00 mm,硝酸钠次之,与其他4种氮源培养基差异显著;氮源为硝酸钾和蛋白胨时产孢量无显著差异,平均产孢量为6.31×106~6.43×106个/mL,但显著高于其他4种氮源培养的病原菌产孢量.茄镰孢菌生长的最适氮源是蛋白胨,菌落直径为53.83 mm,显著高于其他5种氮源;在硝酸铵、硝酸钠、牛肉膏和蛋白胨为氮源的培养基上,产孢量差异不显著,硝酸铵为氮源时产孢量最大,为3.65×106个/mL.
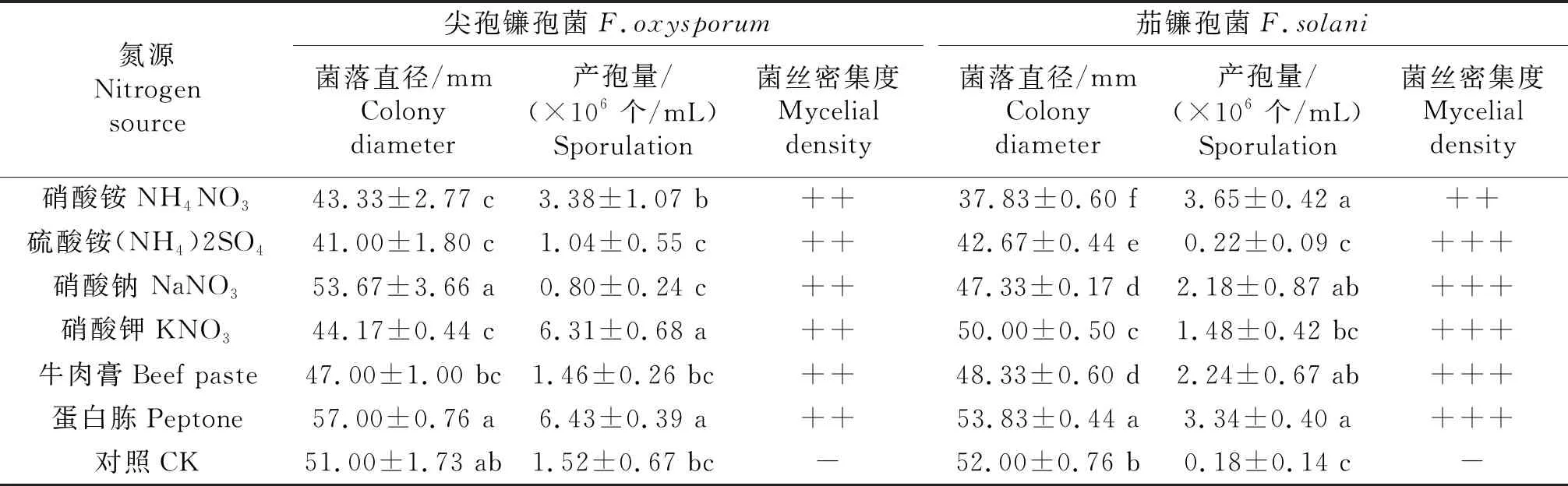
表4 氮源对供试病原菌生长和产孢的影响
3 讨论
镰孢菌根腐类病是一类危害严重的真菌性病害,可侵染辣椒[20]、黄瓜[21]、番茄[22]和胡萝卜[23]等蔬菜作物,其病原形态复杂且种类繁多,变异幅度大,仅以形态特征很难鉴定病原种类.因此,在形态学的基础上结合分子生物学鉴定镰孢菌的方法已被广泛应用.胡兰等[24]研究报道TEF-1α基因序列在镰孢菌种水平上对亲缘关系近的种有高分辨率,可以较好地表现镰孢菌在种一级的关系;而且TEF-1α基因序列的通用引物易于设计、含有丰富的信息量并且还未发现不存在该基因序列的镰孢菌类群[25],本研究采用TEF-1α基因序列结合病原菌形态特征将供试病原菌鉴定为尖孢镰孢菌(Fusariumoxysporum)和茄镰孢菌(F.solani).
本试验结果表明2种镰孢菌对辣椒均有致病性,但辣椒致病力存在差异,其中尖孢镰孢菌致病力强于茄镰孢菌,是引起辣椒根腐病的主要致病菌.方晓翠等[26]报道了新疆加工辣椒根腐病病原为尖孢镰孢菌和茄镰孢菌,尖孢镰孢菌是优势菌的试验结果与本研究一致;张亭亭等[27]发现,尖孢镰孢菌和串珠镰孢菌是引起辽宁省辣椒根腐病的主要致病菌,表明地域环境、寄主品种、生态条件和土壤类型的不同,引起辣椒根腐病致病菌菌群和优势菌存在差异.
生物学特性的研究是病原菌的基础研究,可为抗病育种和生物防治提供理论依据.本研究结果显示,引起辣椒根腐病的尖孢镰孢菌和茄镰孢菌生长和产孢对温度、光照、碳源和氮源需求都有一定的差异,表明这2种病原菌虽可同时存在于发病植株内,但在不同的环境条件下,它们侵染寄主以及在寄主体内的扩展能力可能不同,亦或许是优势病原物种不同所致,对此还需要进一步深入研究.
4 结论
本研究首次报道了发生在甘肃省庆阳市的辣椒根腐病由尖孢镰孢菌(F.oxysporum)和茄镰孢菌(F.solani)引起,致病性测定表明二者均为致病菌.生物学特性研究表明,2种病原菌生长和产孢时对温度、光照条件、碳源和氮源的需求存在差异.
