猪源地衣芽孢杆菌的分离筛选及其特性
2021-11-25董文豪宫晓炜郑福英刘永生张磊张小丽陈启伟马小军
董文豪,宫晓炜,郑福英,刘永生,张磊,张小丽,陈启伟,马小军
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,甘肃 兰州 730070)
抗生素是由微生物或高等动植物在生长代谢过程中所产生,或由人工合成的一类具有抗病原微生物能力的物质[1].抗生素自其发现以来,在养殖业发展中发挥了很大的作用.但随着养殖业的不断发展,近年来抗生素的滥用问题越来越严重,细菌的耐药性也在逐步升级,因此出现了许多多重耐药菌和超级耐药菌[2].由于耐药菌对大部分抗生素均不敏感,在动物机体内可大肆繁殖,严重影响人类及动物的健康.因此急需寻找一种抗生素的替代品,用于临床及生产.微生态制剂作为一种新的饲料添加剂来替代抗生素必将成为一种新趋势[3].
我国对畜产品的安全要求不断提高,2013年12月,农业部发布了饲料添加剂目录(2013),其中允许作为饲料添加剂使用的微生物种类达到34种,相比饲料添加剂目录(2008)增加了18种,表明将微生物作为饲料添加剂已逐渐被认可,其应用在我国也将进一步普遍和广泛[4].近年来,国内外研制出多种益生菌活菌制剂,其基本指导思想是用人或动物正常肠道菌群中的菌株,经过筛选和人工繁殖,通过不同方法制成活菌制剂,然后再以口服投喂方式返回原环境发挥其生理作用[5].健康猪肠道内的微生物比较复杂,益生菌以及条件性致病菌共存.益生菌随着食物进入动物消化道后先到达胃部,通过一个含有胃蛋白酶的酸性环境后到达小肠,经胰蛋白酶、胰脂肪酶等各种消化酶和胆盐的消化作用,最后能在胃肠道中存活下来并达到一定数量才有可能发挥作用[6].因此,益生菌需要能够耐受胃肠道环境,如芽孢杆菌在其生长发育后期可形成一个抗逆性强的芽孢休眠体[7].
动物体内的益生菌主要有芽孢杆菌和乳酸菌两大类,而芽孢杆菌因营养要求低、易培养且具有较高抗逆性而被广泛应用[8].芽孢杆菌为革兰氏阳性菌,广泛存在于自然界,易从动物肠道、粪便、土壤及水体中分离得到[9].芽孢杆菌是好氧菌,在动物肠道中可生物夺氧,为乳酸菌提供赖以生存的厌氧环境,维持肠道微生态平衡[10].芽孢杆菌在生长过程中可产生各种酸类及细菌素等抑菌物质,抑制肠道致病菌的生长,在生长代谢过程中可产生多种水解酶,如蛋白酶、淀粉酶、纤维素酶、脂肪酶等,从而补充肠道内源酶的不足,促进营养物质的消化和吸收,提高饲料利用率及生产性能[11].此外芽孢杆菌还能生成各种氧化酶类,促进各类腐败物质的氧化分解,改善宿主健康和畜舍环境[12].可见,芽孢杆菌微生态制剂在医药和动物养殖生产上有很高的应用价值[13].但由于制备技术不规范、菌株选取不优良、作用效果不明确等问题,其严重影响着微生态制剂的应用和推广发展.另外,益生菌是否具有耐药性,是否存在可转移的抗性基因是一个重要的安全问题[14].欧洲食品安全局要求,在生产一种供人类使用的菌株时,不能存在任何可能对人类造成潜在风险的耐药性获得基因[15].尽管耐药性细菌在食品生态系统中的传播已成为全球关注的问题,但只涉及了部分致病菌和乳酸菌,而有关芽孢杆菌属的耐药性研究较少,信息有限[16].
地衣芽孢杆菌作为益生菌已在世界范围内被广泛开发和应用多年,是益生菌中公认的安全菌株,具有开发潜力的菌种之一.地衣芽孢杆菌作为一种益生菌,在植物病害防治、饲料添加剂、医药开发、微生态制剂、环境污染治理等方面具有广泛的应用.另外,地衣芽孢杆菌还可产生多种抗菌物质,对一些致病菌具有抑制能力,其微生态制剂在医药和动物养殖生产上有很高的应用价值[17].而近年来对地衣芽孢杆菌的研究多在产品开发上,对其抑菌机理及抑菌成分的研究较少.因此本研究计划从猪胃肠道及猪粪便中分离地衣芽孢杆菌,筛选出耐酸、耐胆盐、抗逆性好,且具有产各种酶类功能的优势菌株,进行生物学功能及其体外益生性能的研究,并检测其是否具有抗药性及耐药基因,探究该菌对病原菌的抑制能力,为后期微生态制剂的研发提供基础.
1 材料与方法
1.1 试验材料
1.1.1 样品 2020年8~12月分别在兰州、刘家峡、甘南三地屠宰场采集猪粪便,猪小肠及猪胃内容物,无菌塑封袋包装后低温运到实验室.
1.1.2 试剂及培养基 牛胆盐、刚果红染液、碘液均购于北京Solarbio公司、革兰氏染色试剂盒购于Sigma公司、TaqDNA聚合酶、DNA Marker购于诺唯赞公司;葡萄糖胰蛋白胨培养基、普通营养肉汤培养基、LB培养基等均购买于环凯微生物;淀粉培养基,羧甲基纤维素钠培养基(CMC-Na)、干酪素培养基均购于北京Solarbio公司;鲜血琼脂平板购于环凯微生物;药敏纸片购于杭州滨和微生物公司.
1.1.3 菌株 标准致病菌株主要用于检测分离菌的抑菌能力,金黄色葡萄球菌ATCC6538、大肠杆菌ATCC25922、肠炎沙门氏菌(CVCC3374)均由兰州兽医研究所草食动物细菌病实验室提供.
1.1.4 引物设计与合成 本试验所用引物均由西安擎科生物公司合成,引物序列见表1.

表1 引物序列
1.2 试验方法
1.2.1 芽孢杆菌的分离与形态学观察 取样品80 ℃水浴加热15 min,杀灭其他非芽孢菌.待样品冷却划线接种于葡萄糖胰蛋白胨琼脂平板,37 ℃培养24 h.挑单个菌落划线接种于新的平板,纯化培养,观察菌落的生长情况,包括菌落形状、大小、颜色、光泽、隆起情况、透明度、边缘整齐度等.并在鲜血琼脂平板上划线,观察菌株是否有溶血性.并挑单个菌落进行革兰氏染色,用显微镜油镜观察细菌类型及细菌形态.
1.2.2 芽孢杆菌的鉴定 在平板上选择形态不同的单个菌落,接种于LB液体培养基.用特异性引物对菌液初步进行PCR鉴定,引物见表1.PCR产物进行凝胶电泳,检测目的条带.以菌液为模板,用TaqDNA聚合酶,细菌通用引物进行PCR扩增,引物见表1.对PCR产物进行琼脂糖凝胶电泳检测,有目的条带的样送至擎科生物进行测序,测序结果通过BLAST与GenBank数据库中的序列进行比对分析.
1.2.3 耐酸和耐胆盐试验 对分离鉴定出的地衣芽孢杆菌进行耐酸、耐胆盐试验的筛选.
1.2.3.1 耐酸试验 取1 mL过夜培养的菌液,分别加入到9 mL pH为2.0、3.0、4.0的LB培养基中,以未经过酸处理的菌液作为对照,37 ℃恒温静置培养2 h,梯度稀释后涂平板, 37 ℃培养24 h,计数并计算存活率,筛选耐酸能力强的菌株
存活率=经酸处理平板菌落计数÷未经酸处理菌液平板菌落计数
1.2.3.2 耐胆盐试验 选1.2.3.1中耐酸能力强的菌株, 取1 mL过夜培养的菌液分别加入到9 mL的胆盐浓度为0.1%、0.2%、0.3%、0.4%、0.5%的LB液体培养基中,37 ℃静置培养12 h,梯度稀释后平板涂布,培养24 h进行平板计数,同上试验方法计算菌株存活率.
1.2.4 生化试验 复苏菌株,平板划线于鲜血琼脂平板,培养24 h后挑单个菌落稀释于麦氏比浊管中,插入芽孢杆菌生化卡,用VITEK 2微生物鉴定系统鉴定.
1.2.5 药敏试验及耐药基因检测 复苏菌株,同1.2.4处理菌液,插入药敏卡,用VITEK2微生物鉴定系统鉴定.分析结果,用药敏纸片法进一步对耐药的结果进行验证.用特异性引物鉴定菌株是否携带耐药基因,引物见表1.
1.2.6 产水解酶试验
1.2.6.1 产淀粉酶试验 挑单个菌落点种于淀粉培养基,每个平板点3个重复,一个用水做对照,37 ℃培养24 h,用碘液染5 min,测量菌落及透明圈直径.
1.2.6.2 产纤维素酶试验 挑单个菌落点种于羧甲基纤维素钠培养基平板, 37 ℃培养24 h,用0.2%刚果红染液染30 min,用0.1 mol NaCl洗5 min,测量菌落及透明圈直径.
1.2.6.3 产蛋白酶试验 同上挑单个菌落点种干酪素培养基,37 ℃培养24 h,测量菌落及透明圈直径[18].
1.2.7 体外抑菌试验 以金黄色葡萄球菌,大肠杆菌,沙门氏菌作为指示菌,用牛津杯法筛选6株地衣芽孢杆菌中对常见致病菌有抑制能力的菌株.配制LB琼脂,待培养基冷却,加入100 μL指示菌,摇匀后倒平板,在牛津杯中加入地衣芽孢杆菌400 μL,37 ℃培养24 h,测量抑菌圈直径,筛选有抑菌能力的菌株[19].
1.2.8 耐高温试验 分别取5 mL过夜培养的菌液,置于70、75、80、85、90、95、100 ℃水浴中处理10 min,处理完毕待样品冷却后,取100 μL进行平板涂布,将未进行高温水浴处理的菌液作为对照,培养24 h后平板计数,计算菌株存活率.
1.2.9 对小鼠影响试验 选择30~40 g(6~8周龄)昆明小鼠进行试验.将14只小鼠随机分成2组,为对照组和试验组,每组7只.每组每只小鼠分别灌服200 μL无菌LB液体培养基和200 μL的OD为0.8的地衣芽孢杆菌WBL009菌液.连续灌胃21 d,观察并记录小鼠活动量、增质量、有无腹泻等.饲喂结束后,将各组小鼠摘眼球采血法采血并处死,解剖小鼠取脾脏和胸腺,称质量并记录,计算胸腺指数、脾脏指数、肝脏指数和肾脏指数.解剖观察各组小鼠内脏器官是否有肉眼可见的病理变化[20].
器官指数=器官质量/体质量
2 结果与分析
2.1 菌株的分离鉴定
2.1.1 芽孢杆菌的形态学特征及鉴定结果 本试验共分离出64株芽孢杆菌,其中地衣芽孢杆菌26株,枯草芽孢杆菌9株,解淀粉芽孢杆菌8株、甲基营养型芽孢杆菌6株、贝莱斯芽孢杆菌5株、沙福芽孢杆菌4株、短小芽孢杆菌3株、高地芽孢杆菌2株、苏云金芽孢杆菌1株等,具体结果见表2.
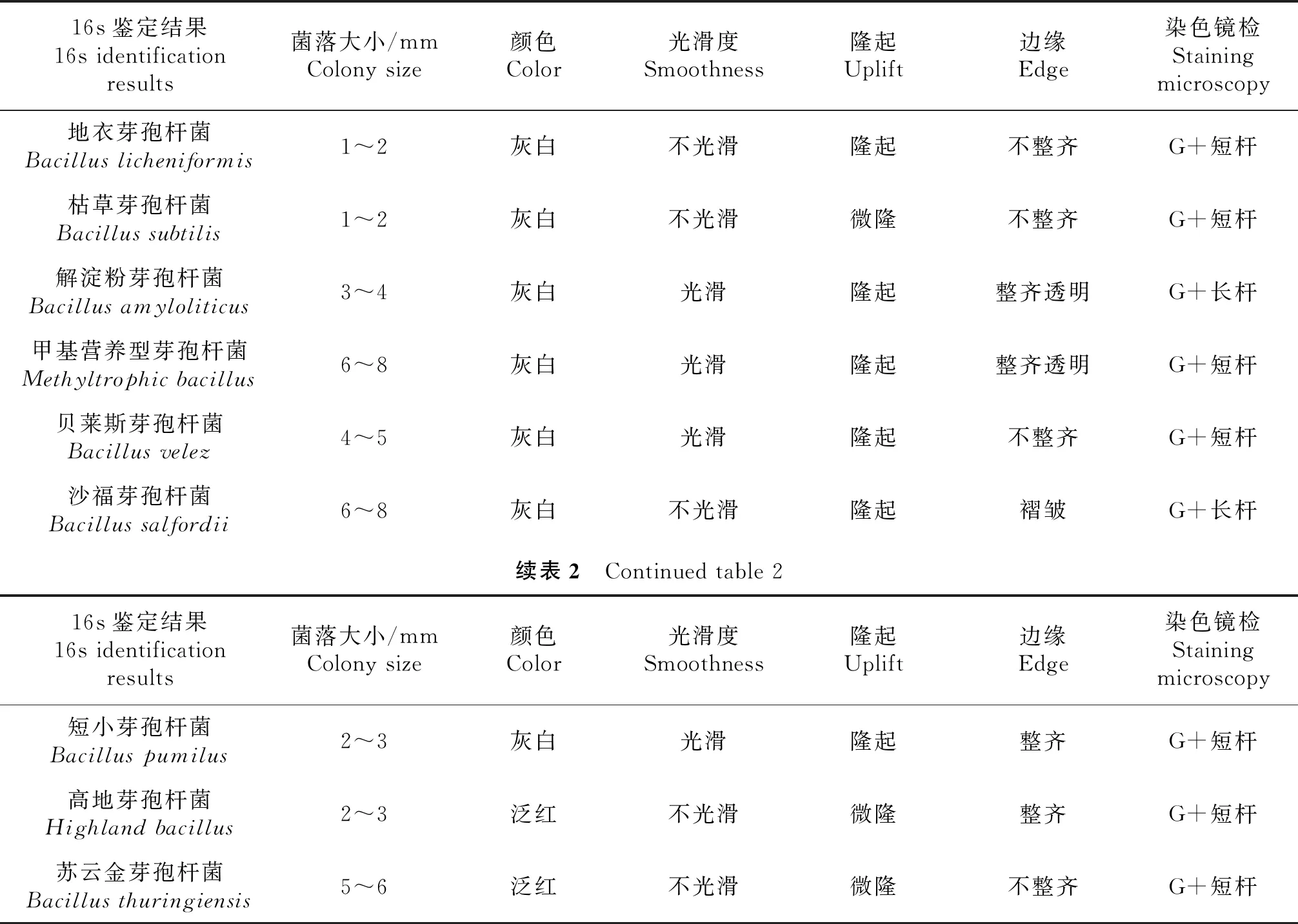
表2 芽孢杆菌形态特征及鉴定结果
2.1.2 培养及形态学特征 地衣芽孢杆菌在葡萄糖胰蛋白胨培养基上生长良好,培养24 h形成2~3 mm大小的白色菌落,边缘不整齐,表面不光滑,有褶皱.在LB液体培养基中生长良好,培养24 h在培养基表面形成一层白色薄膜.在鲜血琼脂平板上生长良好,无溶血现象.
2.1.3 特异性引物PCR鉴定 用地衣芽孢杆菌特异性引物PCR鉴定结果显示,有大小约 1 287 bp的目的条带,初步判断该菌株为地衣芽孢杆菌.
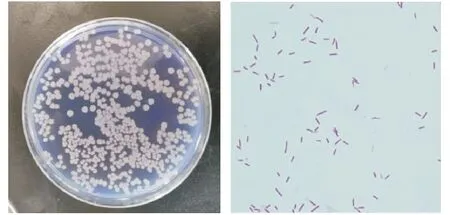
图1 地衣芽孢杆菌菌落及革兰氏染色镜检1000×
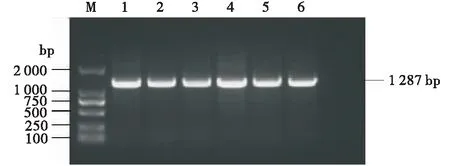
M:DL2000 Marker;1~6:WBL001、WBL002、WBL005、WBL009、WBL010、WBL014 ;-:阴性对照.
2.1.4 16s rDNA序列分析与系统发育树构建 将PCR产物进行琼脂糖凝胶电泳,条带大小均在1 500 bp左右,测序后在NCBI网站比对核苷酸序列,分析结果.比较并分析同源性较高的序列,构建分离出的地衣芽孢杆菌的系统发育树.
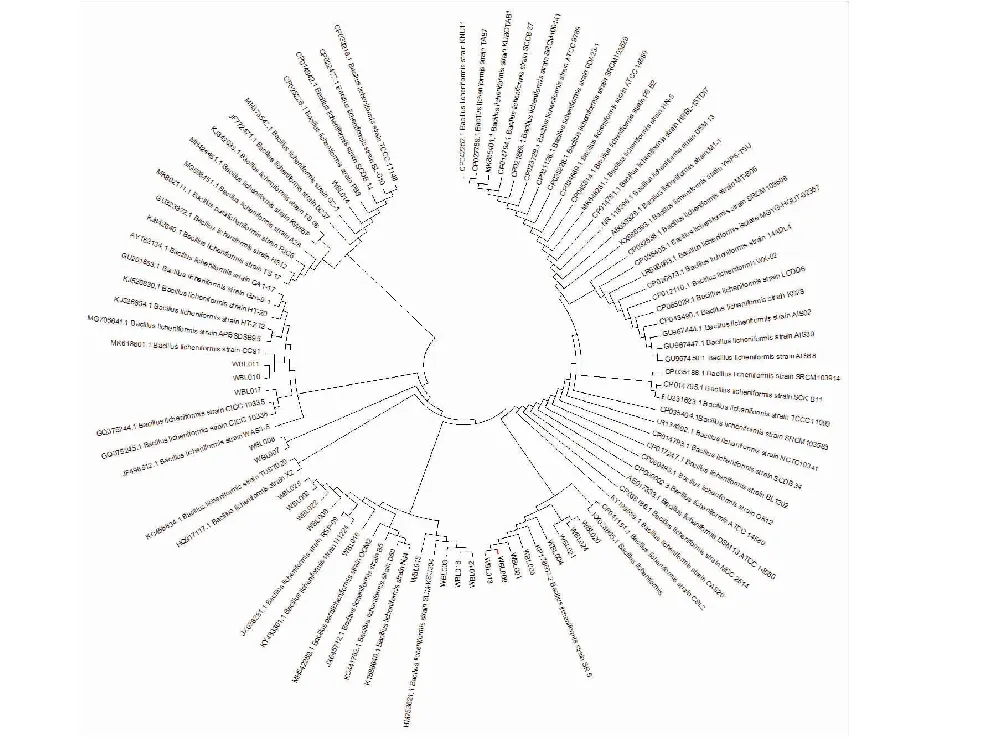
图3 地衣芽孢杆菌系统进化分析
2.2 耐酸、耐胆盐试验
2.2.1 耐酸试验 通过将26株地衣芽孢杆菌在pH 2.0、2.5、3.0处理2 h后,计算存活率,发现仅有6株仍能存活.此6株菌的耐酸能力差异较大.菌株WBL009在pH 2.0处理2 h后,仍能存活,存活率为35.8%,耐酸能力较强.
2.2.2 耐胆盐试验 计算6株耐酸能力强的菌株在不同浓度胆盐处理后的存活率,6株菌株的耐胆盐能力不同.其中菌株WBL009耐胆盐能力最强,在0.3%胆盐培养基中处理12 h的存活率为51.6%.
2.3 生化试验
根据VITEK2系统的生化试验结果显示,93%的鉴定概率为地衣芽孢杆菌.
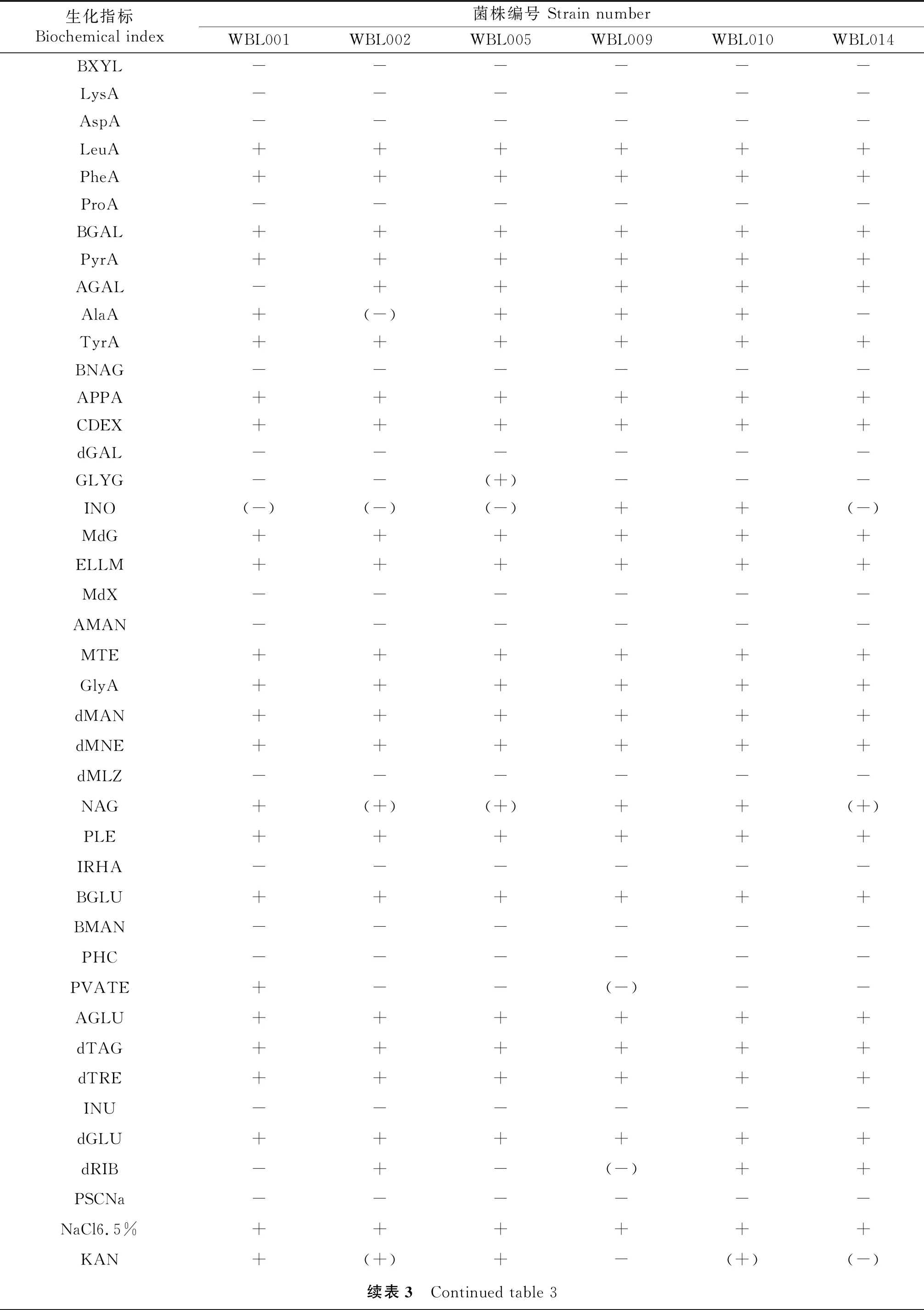
表3 生化试验结果
缩写与中文名称Abbreviations and Chinese and English names:
AGAL:α-半乳糖苷酶 α-galactosidase ;AGLU:α-葡萄糖苷酶 α-glucosidase;AMAN:α-甘露糖苷酶 α-mannosidase;APPA:丙氨酸-苯丙氨酸-脯氨酸芳胺酶 Alanine-phenylalanine-proline arylaminase;APS:过硫酸铵 Ammonium persulfate;AspA:L-天冬氨酸芳胺酶 L-aspartic acid arylaminase;BalaA:丙氨酸芳胺酶 Alanine arylamine enzyme;BGAL:β-半乳糖苷酶 β-galactosidase ;BGLU:β-葡萄糖苷酶 β-glucosidase;BMAN:β-甘露糖苷酶 β-mannosidase;BNAG:N-乙酰-β-D-葡萄糖氨酶 N-acetyl-β-D-glucosaminase;BXYL:β-木糖苷酶 β- xylosidase;CDEX:环糊精 cyclodextrin;Cleocin:氯林霉素 Clidamycin Hydrochloride;dGAL:D-半乳糖 D-galactose;dGLU:D-葡萄糖 D-glucose;dMAN:D-甘露醇 D-mannitol;dMLZ:D-松三糖 D-three sugar pine;dMNE:D-甘露糖 D-mannose;dRIB:D-核糖 D-ribose;dTAG:D-塔格糖 D-tager sugar;dTRE:D-海藻糖 D-trehalose;ESC:七叶灵水解 D-mannitol;GlyA:氨基酸芳胺酶 L-aspartic acid arylaminase;GLYG:糖元 Glycogen;INO:肌醇 Inositol;INU:菊粉 Inulin;IRHA:L-鼠李糖 L-rhamnose;KAN:卡那霉素耐受 Kanamycin tolerance;LeuA:亮氨酸芳胺酶 Leucine arylaminase;LysA:L-赖氨酸芳胺酶 L-lysine arylaminase;MdG:甲基葡萄糖甙酸化 Methylglucoside acidification;MdX:甲基-D-木糖苷 Methyl-D-xyloside;MTE:麦芽三糖 L-lysine arylaminase;NaCI 6.5%:6.5%氯化钠生长 6.5% NaCl growth;NAG:N-乙酰-D-葡萄糖氨 N-acetyl-D-glucosamine;OLD:竹桃霉素耐受 Tolerance to dodomycin;PHC:磷酰基维生素 Phosphoacyl vitamins;PheA:苯丙氨酸芳胺酶 Phenylalanine arylaminase;PLE:古老糖 Old sugar;POLYB_R:多粘菌素B耐受 D-three sugar pine;ProA:脯氨酸芳胺酶 Proline arylaminase;PSCNa:腐胺同化 Putrescine assimilation;PVATE:丙酮酸盐 Pyruvic acid salt;PyrA:吡咯烷基芳胺酶 Pyrrolidylarylaminase;TTZ:多粘菌素B耐药 D-mannose;TyrA:酪氨酸芳胺酶 Tyrosine arylaminase.
2.4 药敏试验及耐药基因检测
药敏试验结果显示,6株地衣芽孢杆菌对大多数抗生素均敏感,但均对氯林霉素耐药.结果见表4.
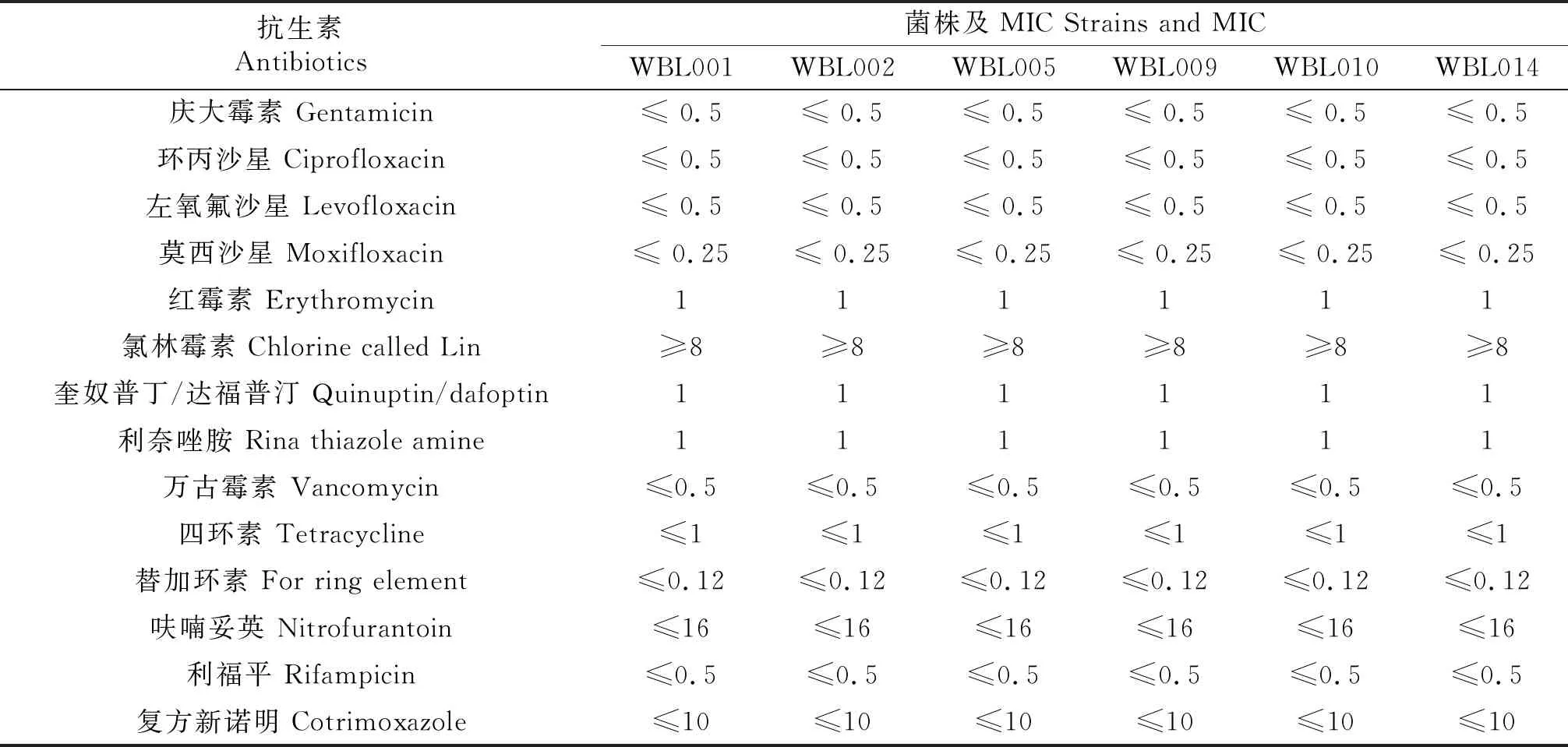
表4 药敏试验结果
通过特异性引物对地衣芽孢杆菌潜在耐药基因进行检测,引物见表1.对PCR产物进行电泳检测,其中ermC基因有目的条带,speG和ereAB无条带.说明介导6株地衣芽孢杆菌氯林霉素耐药的原因是携带了ermC耐药基因.
2.5 产水解酶试验
根据产酶试验结果显示,6株地衣芽孢杆菌产酶能力不同,其中菌株WBL009能产生淀粉酶和纤维素酶,产蛋白酶结果不明显.

M:WBL2000 Marker;1~6:WBL001、WBL002、WBL005、WBL009、WBL010、WBL014 ;-:阴性对照.
2.6 体外抑菌试验
由地衣芽孢杆菌对金黄色葡萄球菌、肠炎沙门氏菌及大肠杆菌的体外抑制试验结果显示,仅有菌株WBL009对金黄色葡萄球菌有抑制作用,抑菌环直径为10.75 mm,其他菌株均无明显抑菌效果.
2.7 耐高温试验
将菌株WBL009培养12 h的菌液经不同温度处理10 min后,稀释涂布计数,在不同温度下的存活率见表5.
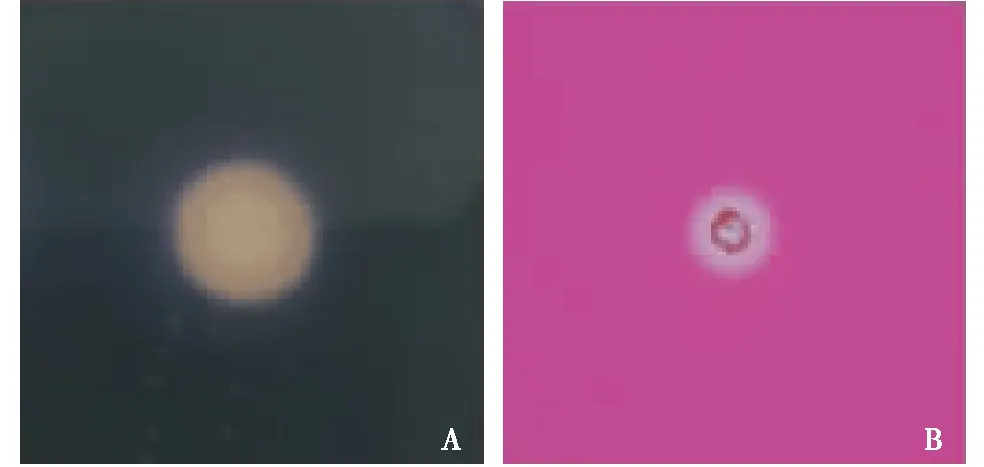
A:菌株WBL009产淀粉酶试验;B:菌株WBL009产纤维素酶试验.
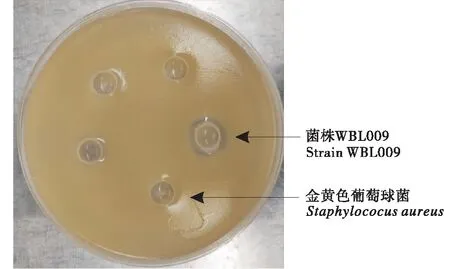
图6 菌株WBL009体外抑菌试验

表5 菌株WBL009的耐高温存活率
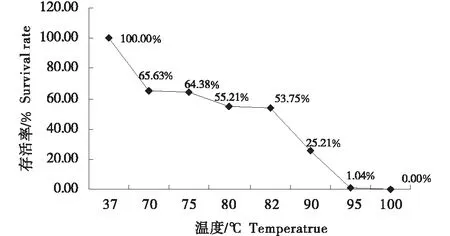
图7 耐高温存活率曲线
2.8 对小鼠影响试验
通过用菌株WBL009连续21 d饲喂小鼠,对照组和试验组小鼠均无不良反应,精神正常,无腹泻情况和中毒症状.解剖后肉眼观察小鼠内脏器官正常,分析器官指数,发现该菌对小鼠胸腺(P<0.01)和脾脏(P<0.05)的发育有促进作用,且对小鼠体质量增长有显著提高作用(P<0.01).
3 讨论
研究表明,在动物饲料中添加适当比例的微生态制剂,可产生大量寡肽、谷氨酸等多种营养物质,且能产生蛋白酶、脂肪酶、纤维素酶和淀粉酶等多种水解酶,具有调整肠道微生态平衡,提高动物生长性能,降低料肉比,提高动物机体免疫力,减少疾病的发生等功效[21].

A:小鼠胸腺指数;B:小鼠肝脏指数;C:小鼠脾脏指数;D:小鼠肾脏指数;E:小鼠灌胃21d体质量增长.
因为要考虑微生态制剂的工业生产加工及其在动物胃内及肠道内的耐受能力,需筛选出能耐受低pH,耐受胆盐及高温条件的菌株.本试验中筛选的地衣芽孢杆菌WBL009在pH值为2.5时的人工胃液中处理2 h 后存活率为35.8%,在胆盐浓度为0.3%处理12 h后存活率为51.6%,说明其具有较强的耐酸耐胆盐能力.药敏试验结果显示,地衣芽孢杆菌对克林霉素有一定的耐受性,而对于绝大多数的药物是敏感的,耐药基因筛查发现,ermC是导致地衣芽孢杆菌对克林霉素耐药的主要原因.在使用益生菌时,应避免与其敏感的抗生素同时使用,这也是保证益生菌发挥作用的关键一步.根据Jeong等[16]的研究报道,证实ermC是地衣芽孢杆菌和副地衣芽孢杆菌对红霉素和克林霉素交叉耐药的主要原因,ereAB主要发挥对红霉素的抗性作用,speG则主要发挥对克林霉素的抗性作用.表明芽孢杆菌对克林霉素的耐药性是一种固有的特性,这种特性可以通过缺失耐药基因的结构基因或启动子而丧失,因此在机体内发生耐药基因水平转移的概率较低,作为益生菌相对安全.
金黄色葡萄球菌作为引起机体各类感染的最常见病原菌之一,特别是耐甲氧西林金黄色葡萄球菌(MRSA)又是超级耐药菌,在世界范围内引起巨大危害.益生菌在肠道内通过减少病原菌的肠道定植、限制炎症反应和加强肠道屏障来预防性地抑制病原菌感染[23].近年来相关的报道主要为凝结芽孢杆菌和枯草芽孢杆菌,本研究筛选的地衣芽孢杆菌WBL009对金黄色葡萄球菌有抑制作用,可作为益生菌控制耐药菌,为后期试验提供研究基础.
通过用菌株WBL009连续21 d饲喂小鼠,分析体质量和免疫器官变化发现,该菌对小鼠体质量增长有显著提高作用,且对免疫器官的发育有促进作用.免疫器官的生长发育和成熟依赖于抗原的刺激;芽孢杆菌的菌体成分如胞壁糖、肽聚糖、多肽和蛋白质等,可以作为抗原刺激肠道或以免疫佐剂的形式作用于动物免疫器官,直接促进免疫器官的生长发育[22].
综上所述,本研究中筛选出的1株具有较强抗逆性、有产水解酶能力,且对金黄色葡萄球菌有抑制作用的地衣芽孢杆菌WBL009具有良好的体外益生性能.后期将对该菌株的抗菌物质成分、该菌在动物体内的益生性能、对动物机体的免疫调节能力等进行下一步研究,为其作为益生菌的候选菌株应用于微生态制剂的生产提供依据和材料.
