青藤碱对蛛网膜下腔出血后炎症反应及早期脑损伤的影响
2021-11-24傅传经高觉民吴鹤鸣
傅传经,高觉民,李 翔,吴鹤鸣
(1.江苏省中医院神经外科,江苏 南京 210029;2.南京医科大学附属南京医院/南京市第一医院神经外科,江苏 南京 210006)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)多是由于颅内血管壁破裂,血液直接流入蛛网膜下腔引起一系列症状的疾病,具有较高的致残率和致死率,而动脉瘤破裂是其最常见的病因[1]。SAH后早期脑损伤是指SAH后72 h内的继发性损伤,以继发性细胞凋亡、炎症反应为主要特征,其病理生理机制十分复杂;炎症反应是早期脑损伤发生、发展的重要环节,也是SAH患者出现神经功能障碍的最重要原因之一[2-3]。因此,减轻SAH后的炎症反应,从而减少继发性细胞凋亡是预防早期脑损伤的重点,同时也是近年来研究的热点。以往关于SAH后炎症反应及早期脑损伤的研究多集中于化学合成药物,而中药是我国传统医学的重要组成部分,随着中药分离纯化技术的发展,中药单体近年来逐渐成为了神经保护剂相关研究的热点。青藤碱(sinomenine,SIN)是从中药青风藤中提取的生物碱,可有效抑制多种炎症因子的活性,从而减轻各种原因导致的组织器官炎性损伤[4],还可明显减轻创伤性脑损伤后神经细胞凋亡,但目前国内外尚无SIN对SAH后炎症反应及早期脑损伤的影响及相关机制的研究。本研究拟建立大鼠SAH模型,探讨SIN对SAH后炎症反应及早期脑损伤的影响,为临床SAH的治疗提供依据。
1 材料与方法
1.1 药物与试剂
青藤碱注射液(湖南正清制药集团股份有限公司,国药准字:Z43020279,规格:50 mg/2 mL)、β-actin一抗(Bioworld生物技术公司,批号:AP0060)、戊巴比妥钠(北京普博斯生物科技有限公司,批号:20181222)、4%多聚甲醛固定液(上海歌凡生物科技有限公司,批号:G1101)、SDS-PAGE凝胶配制试剂盒(上海碧云天生物有限公司,批号:P0012AC)、蛋白质提取试剂盒(南京翼飞雪生物科技有限公司,批号:YWB001)、山羊二抗(Bioworld生物技术公司,批号:BS12478)
1.2 实验动物分组及SAH模型建立
选用SPF级成年雄性SD大鼠36只,体质量280~310 g,由南京中医药大学动物实验中心提供[使用许可证号:SYXK(苏)2018-0049],采用随机数字表法将大鼠分为Sham组、SAH组和SAH+SIN组,每组12只。所有大鼠均在实验前7 d放入实验环境中饲养以适应实验环境,在光照和黑暗各12 h环境下自由进食和饮水。所有大鼠均使用2%戊巴比妥钠50 mg/kg腹腔注射麻醉后仰卧于操作台,经大鼠股动脉抽取自体血0.3 mL。SAH组和SAH+SIN组大鼠止血后,将大鼠俯卧固定于操作台,头颈部备皮并碘伏消毒、铺巾。在大鼠左右耳根连线中点摸到枕外隆凸,以其下大约0.5 cm处为穿刺点,沿中线在颈部皮肤作1个长约1.5 cm的纵行切口,钝性分离皮下组织,找到枕骨大孔后经环枕膜穿刺,回抽见脑脊液后将自体血以0.1 mL/min注入枕大池,同时注意观察大鼠生命体征变化,注射完毕后以止血纱封闭穿刺口,并逐层缝合切口。注血时使大鼠保持头低位30 min,间隔48 h再次注血,所有实验大鼠均于造模后返回原笼子中。Sham组大鼠仅切开头皮;SAH组大鼠枕大池注血造模;SAH+SIN组大鼠造模30 min后给予腹腔注射SIN 50 mg/kg。大鼠造模后24 h,用2%戊巴比妥钠麻醉并仰卧位固定,打开胸腔及心包,迅速剪开右心耳,并经左心室灌注4 ℃生理盐水,待肝发白后迅速断头取脑,若脑基底池蛛网膜下腔布满血液表示造模成功。
1.3 神经功能评分
造模后24 h,采用改良Garcia评分评价所有大鼠的神经功能,包括自主运动、体态对称性、前肢伸展、网屏实验、身体触觉和胡须触觉反射等项目,每项评分0~3分,得分范围0~18分,得分越低表明神经功能障碍越严重。
1.4 标本制备
大鼠(每组6只)断头取伤灶周围脑组织并置于试管中,按照蛋白提取试剂盒(上海碧云天生物有限公司,P0027)说明书提取总蛋白,加入含蛋白酶抑制剂的RIPA裂解液并匀浆,于4 ℃以12 000 r/min的速度离心15 min,取上清液为总蛋白,加入5×Lodding buffer并加热5 min使蛋白变性,随后于-70 ℃低温保存。用于TUNEL染色的大鼠(每组6只)麻醉后心脏灌注PBS和4%多聚甲醛,取脑组织制作冰冻切片。
1.5 脑水肿检测
神经功能评分测定完成后,将大鼠(每组6只)断头处死取脑组织,滤纸吸干后用电子天平称量湿重,然后置于100 ℃烘箱中烘烤72 h至脑组织的重量不再变化(2次称重误差<0.2 mg),记为干重,然后计算脑组织水含量,脑组织水含量=[(湿重-干重)]/湿重×100%。
1.6 Western blot检测蛋白表达
用10%的聚丙烯酰胺凝胶电泳(SDS-PAGE),恒压110 V电泳至蛋白完全分离后,250 mA目标蛋白转至PDFA膜上,用5%脱脂牛奶封闭1 h,然后加入β-actin(1∶2 000)、NLRP3(1∶1 000)、IL-1β(1∶1 000)及TNF-α(1∶1 000)一抗4 ℃孵育过夜,用TBST漂洗3次,再用辣根过氧化物酶标记的二抗孵育2 h,TBST漂洗3次,以ECL发光液(Millipore)显影后用自动曝光仪(Fuji Hyperfilm,日本)曝光。用UN-SCAN-IT软件(Silk Scientific Inc,美国)分析灰度值。
1.7 TUNEL染色检测细胞凋亡
取冰冻切片,复温后冷丙酮固定10 min,PBS清洗3次,每次5 min,山羊血清封闭1 h,加入NeuN一抗(1∶100)4 ℃孵育过夜,PBS洗涤3次,每次5 min;加入二抗(1∶200),室温孵育1 h,PBS漂洗3次,每次5 min;切片晾干后加入DAB显色液;光镜下确定染色满意后,蒸馏水冲洗,Harris苏木素染色3 min,用浓度大于1%的酒精浸润,再用蒸馏水冲洗,浸入氨水中,蒸馏水再次冲洗,晾干后中性树胶封片。显微镜下观察阳性细胞。
1.8 统计学分析
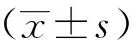
2 结果
2.1 大鼠神经功能评分与脑水肿
与Sham组相比,SAH组及SAH+SIN组神经功能评分明显降低,脑组织水含量明显增加(P<0.05);与SAH组相比,SAH+SIN组神经功能评分明显升高,脑组织水含量明显降低(P<0.05),见图1。

a:大鼠神经功能评分;b:大鼠脑组织水含量 *:与Sham组相比,P<0.05;△:与Sham组相比,P<0.001;#:与SAH组相比,P<0.05
2.2 大鼠神经细胞凋亡
与Sham组相比,SAH组及SAH+SIN组凋亡神经细胞明显增加(P<0.05);与SAH组相比,SAH+SIN组凋亡神经细胞明显减少(P<0.05),见图2。
黑色箭头:阳性细胞;*:与Sham组相比,P<0.01;△:与Sham组相比,P<0.001;#:与SAH组相比,P<0.05
2.3 大鼠NLRP3、IL-1β及TNF-α表达
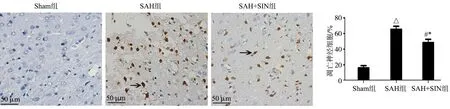
与Sham组相比,SAH组及SAH+SIN组NLRP3、IL-1β、TNF-α表达明显升高(P<0.05);与SAH组相比,SAH+SIN组NLRP3、IL-1β及TNF-α表达明显降低(P<0.05),见图3。
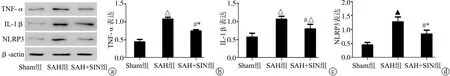
a:Western blot检测蛋白表达;b:TNF-α蛋白相对表达量;c:IL-1β蛋白相对表达量;d:NLRP3蛋白相对表达量 *:与Sham组相比,P<0.05;△:与Sham组相比,P<0.01;▲:与Sham组相比,P<0.001;#:与SAH组相比,P<0.05
3 讨论
SAH后早期脑损伤主要是由于血液短时间内大量进入蛛网膜下腔导致颅内压急剧升高,脑灌注压随之降低,从而引起脑细胞急性缺血缺氧;同时,红细胞分解释放出血红蛋白、含铁血黄素等大量生物活性物质,激活了SAH后神经细胞凋亡的过程[5]。大量研究证明,SAH后早期脑损伤是SAH预后不良的重要因素,也是SAH致残、致死的主要原因[6-7]。本研究结果显示,与Sham组相比,SAH组大鼠脑组织水含量较高,表明脑水肿明显,SAH后大鼠脑细胞处于缺血、缺氧状态,且颅内压增高;SAH组大鼠神经功能评分明显降低,表明SAH后大鼠发生了神经功能缺失;SAH组大鼠凋亡神经细胞明显增加,表明SAH导致了明显的早期脑损伤。因此,SAH后对早期脑损伤进行干预,在预防SAH后神经功能障碍方面有重大意义,但目前临床尚无公认的有效处理措施。
SAH后红细胞降解产物也可诱导多种炎症因子分泌,并激活下游级联放大反应介导神经元凋亡,进而导致早期脑损伤[8]。因此,神经炎症与SAH后早期脑损伤的发生、发展密切相关。炎性小体NLRP3及其下游IL-1β、IL-18等因子的激活可导致更多炎症细胞的聚集,产生级联放大效应,导致血管细胞损伤及细胞凋亡。而SAH后小胶质细胞被大量激活,血管内皮细胞黏附因子的表达增加,释放IL-1β、TNF-α等炎症因子,导致早期脑损伤[9-10]。TNF-α是多种神经元及神经周围细胞受刺激时分泌的一种促炎因子,可在突触水平诱导神经细胞结构变化,并可通过突触神经元细胞膜上的TNF受体调节神经元功能,诱导神经元凋亡[11]。因此,本研究选择检测NLRP3、IL-1β和TNF-α等炎症反应指标,结果显示,SAH组NLRP3、IL-1β及TNF-α表达较Sham组明显增加,表明炎症反应被激活。因此,抑制SAH后的早期神经炎症反应是减轻早期脑损伤的重要途径,同时也是改善SAH预后的重要手段。
SIN是从传统中草药青风藤根茎中提取的生物碱单体,其自身含有的酚羟基可产生较强的抗炎、抗氧化等作用[12-13]。SIN可清除氧自由基,减轻脂质过氧化,从而缓解各种原因导致的器官损伤[14];此外,其在脑缺血性及出血性卒中和神经退行性疾病等中枢神经系统疾病中可产生神经保护作用。有研究证明,SIN可以减轻阿尔茨海默病中淀粉样蛋白聚集导致的活性氧(reactive oxygen species,ROS)、活性氮(reactive nit rogen species,RNS)相关的炎症反应,从而发挥神经保护作用[15]。而在脑梗死模型中,SIN预处理或者缺血后干预均可缩小梗死面积,改善预后[16-17]。本研究结果显示,SAH+SIN组大鼠SAH后的脑组织水含量明显低于SAH组,神经功能评分明显高于SAH组,表明SIN可明显减轻SAH导致的脑水肿,从而改善颅内压,同时还可减轻SAH后的运动功能障碍,促进神经功能恢复。
动物实验已证明,SIN可减轻创伤性脑损伤后二次损伤导致的神经细胞凋亡,且对中枢神经系统的缺血再灌注损伤具有保护作用[18-19]。本课题组前期的研究结果表明,SIN可有效减轻创伤性脑损伤后线粒体凋亡,具有明显的神经保护作用[20]。有研究发现,SIN可有效抑制NADPH氧化酶从而减轻脂多糖诱导的神经细胞凋亡,还可抑制脑出血后小胶质细胞活化,降低TNF-α、IL-1β和IL-6的水平及NF-κB的活性,减少ROS的产生,从而发挥神经保护作用[21-22]。本研究结果显示,与SAH组相比,SAH+SIN组NLRP3、IL-1β及TNF-α表达均明显降低,且神经细胞凋亡明显减少,表明SIN可有效减轻SAH后的炎症反应,从而缓解早期脑损伤,具有神经保护作用,其可能通过阻断NLRP3的激活途径发挥作用。
综上所述,SIN可明显减轻SAH后的炎症反应,从而减轻早期脑损伤,具有一定的神经保护作用,但具体作用机制还需进一步研究。
