利用径向生长修复算法检测玉米根系表型
2021-11-24邵昱宁邓一明
卢 伟,邵昱宁,王 玲,罗 慧,周 济,邓一明
利用径向生长修复算法检测玉米根系表型
卢 伟1,邵昱宁1,王 玲1,罗 慧1,周 济2,邓一明3
(1. 南京农业大学人工智能学院,南京 210031;2. 剑桥作物研究所/国立农业植物学研究所,英国剑桥 CB3 0LE;3. 密歇根州立大学工学院,美国密歇根州东兰辛 48824)
针对根系图像中的断根易导致根系表型信息难以精确获取的问题,该研究提出一种根系径向生长修复算法,并基于此进行不同抗性玉米种子根系表型对比研究。首先,采用自适应对比度增强、直方图灰度查找、椒盐去噪等对采集的根系图像进行预处理,从复杂背景中分离出根系图像;再通过YOLO-V3检测模型进行根系图像中主根根尖识别;最后,自根尖开始进行径向生长,通过分叉点主根提取策略、端点自适应修复策略实现主根图像修复,并提取主根和侧根表型信息。将普通、抗旱、抗涝、抗盐4种不同抗性的玉米种子种植于槽型扁平容器中培养14 d后取出,冲洗得到完整根系并进行图像采集。采用径向生长修复算法进行根系修复后提取根系长度和直径与根系图像修复前相比,根系长度和直径的提取精度分别由83.6%和84.4%提高至97.4%和94.8%,径向生长修复算法提取精度优于区域生长算法,适用于不同胁迫环境下玉米根系表型参数提取。在干旱环境和盐腌环境下,径向生长修复算法精度提升更明显。结果表明,该研究所提出的根系径向生长修复算法可有效提高根系图像表型信息精度,为根系表型快速提取提供参考。
图像处理;算法;根系表型;环境胁迫;径向生长;自适应修复
0 引 言
根系是作物吸收水分、矿物质的重要组织,其主根、侧根等表型信息与作物抗逆性能密切相关,可直接反应作物的抗逆能力[1-5],因此研究根系表型与基因型之间的关系对种质创新具有重要意义。目前,根系表型检测主要分为有损检测和无损检测[6]。作为根系表型研究的传统方法,有损检测主要有直接挖掘法、保护挖掘法等,挖掘法需要挖掘、清洗等多个步骤,可对根系进行完整检测,但费工费时。因此很多学者进行根系无损检测的研究。现有的根系表型无损检测方法主要有X射线扫描(X-Ray CT)[7]、电阻抗成像(Electrical Impedance Tomography,EIT)[8]、掩埋式微型相机法[9]、红外热成像[10]、透明培养基[11]等方法。Maenhout等[7]通过X-Ray CT实现对土壤下根系的可视化检测和半自动分割,但X-Ray CT设备昂贵、检测速度慢且X射线会对根系发育造成一定影响,导致该方法较难普及;Santos等[8]利用EIT进行根系检测,但分辨率低且易受土壤电导率不均匀性影响,需要进一步改进;Fitters等[9]提出使用掩埋式微型相机直接在土壤下采集甜菜根根系信息,但难以得到完整根系表型信息;Chu等[10]利用红外热成像检测玉米根系,虽然可以穿透土壤浅表获取根系图像,但仍然难以获取完整图像信息且易受土壤中杂质影响。以上学者采用不同的传感设备进行根系表型检测,但是都存在明显缺点。此外,Shi等[11]从培养基的角度改进根系表型检测,虽然透明基质可以完整迅速地采集到根系信息,但透明基质中作物根系的发育与在土壤中有一定差异。因此,有损检测仍然是现今农业育种行业进行土壤根系表型精确测量的主要方法。
但由于受到根系表面污染、褐化、密集侧根和背景噪声的影响,冲洗后的根系图像仍然会产生断点,影响主根和侧根的表型信息的精确测量。目前,图像修复算法分为传统修复算法和基于深度学习的修复算法。基于深度学习的修复算法主要有生成对抗网络(Generative Adversarial Networks,GAN)[12]、深度神经网络(Deep Neural Network,DNN)[13]等。GAN需要大量样本训练模型且训练周期较长,如Sarkar等[13]通过手绘大量根系完整图像和断裂图像作为DNN的训练集,但训练集理想化难以适用复杂环境下根系图像修复。基于深度学习的修复算法需要大量数据训练,不适合复杂环境下的根系图像修复。传统图像修复算法包括PatchMatch算法[14]、Criminisi算法[15]等。PatchMatch算法易陷入局部最优解,导致修复失败;Criminisi算法迭代流程较长,不利于快速修复。
综上,为进一步提高根系表型参数自动化检测的精度,本研究基于区域生长思想提出了一种玉米根系表型检测的径向生长修复算法,通过使用较小数据集训练即可实现根系图像快速修复,并提取出玉米根系主要的表型参数。利用该算法对不同抗性玉米种子根系表型进行提取,以期为根系表型参数的精准提取提供参考和借鉴。
1 材料与方法
1.1 槽型植物培养装置
根系具有丰富的空间特征,圆柱形培养装置中根系冲洗后拍照需要手工处理根系,增加了图像采集的工作量,为便于获取平面化的根系图像,减少根系约束带来的根系损伤,本研究采用12.0 cm×6.0 cm×2.5 cm槽型扁平结构的培养装置,底部预留5个直径2 mm的排水孔,填充10 cm高度的有机土(pH值为 6.7~6.9,有机质含量为475 mg/kg,氮(N)、磷(P)、钾(K)含量均为6.75 mg/kg,微量元素含量为1.7g/kg)。
1.2 种子预处理
选用2019年收获的颗粒饱满、大小一致的玉米种子,先将玉米种子浸于70%浓度的乙醇溶液中30 s,再浸于35~40 ℃的温水中2 h,待种子露白后平摊在准备好的浅盘湿纱布上,再在玉米种子上覆盖几层湿纱布,以保证种子发芽所需水分,6 h后将处理好的玉米种子种植于槽形扁平培养装置中进行培养。
1.3 试验方法
土培试验于2020年5月在南京农业大学浦口校区进行,试验品种分别为裕丰303(普通对照种)、郑单958(抗旱种)、蠡玉16(抗涝种)、郑单958(抗盐种)。将玉米种子分为3组进行试验,抗旱组8株、抗涝组8株和抗盐组8株,试验的具体设置情况为:干旱环境中设置裕丰303(MA1)和郑单958(MB1),涝渍环境中设置裕丰303(MA2)和蠡玉16(MC2),盐腌环境中设置裕丰303(MA3)和郑单958(MD3)。将3组玉米种子放置于光照充足的环境下,每隔24 h浇灌100 ml的自来水进行催芽,昼、夜温度分别为(23±1)、(17±1)℃,相对湿度为60%左右,当玉米胚芽长度超过种子长度时视为幼苗成形(约72 h)。3种胁迫的处理方法如下:
干旱环境[16-18]:第1、3、5天浇灌1/2浓度的Hoagland营养液,后期停止灌溉使其充分受旱;
涝渍环境[19]:每天浇灌1/2浓度的Hoagland营养液,仅预留1个的排水孔,其他排水孔封堵;
盐腌环境[20]:第1、3、5、7、9、11、13天用200 mmol/L的氯化钠(NaCl)溶液配50%浓度Hoagland营养液进行浇灌。
第14天从土壤取出试验组所有玉米植株,避免损伤根系,用自来水冲洗根系残留土壤,置于纯色背景板上铺平,利用标尺测量根系的主根长度、主根直径,清点主根、侧根数量并记录,然后使用USB 高清摄像头进行图像采集。
1.4 试验平台
试验硬件平台配置为Windows64位系统,16 GB内存,Intel i5-9400F 2.90 GHz处理器,RTX 2070 SUPER 8 G显卡,使用深度学习框架Tensorflow1.15.0结合CUDA8.0和CUDNN5.0,代码运行环境Python 3.6。
2 根系表型提取算法
2.1 基于YOLO-V3的根尖识别
目标识别是神经网络的重要应用,被广泛应用于物体检测、无人驾驶等领域,深度神经网络在性能上可识别特征多、形态学复杂的物体,具有广泛的应用前景。目前常用的目标检测网络有YOLO-V3网络、单步检测算法(Single Shot Detection,SSD)、快速区域卷积网络(Fast Region Convolutional Neural Network,Fast R-CNN)。其中,Fast R-CNN将目标检测分为特征提取和目标分类2个阶段,YOLO-V3网络则是基于先验框直接进行检测,在检测速度上Fast R-CNN慢于YOLO-V3[21];SSD虽为单阶段目标检测,但全类平均精度(mean Average Precision,mAP)低于YOLO-V3网络[22]。因此,综合考虑检测速度和准确率2个因素以及计算资源消耗,本研究选用YOLO-V3网络进行根尖识别。
将待识别图像输入YOLO-V3网络,首先通过卷积神经网络进行特征提取形成特征图,再进行全卷积特征识别。YOLO-V3将待识别的图像分割为×个区域,当物体的中心落在其中一个区域中时,区域所对应的YOLO-V3网络负责区域内物体检测,计算目标区域的置信度并进行多标签分类。YOLO-V3采用9种不同大小的锚点对图像进行分割,从而能够获得3种不同尺寸的特征图,根据Redmon J[21]的研究结果,3种特征图的边长分别为13、26、52个像素单位,不同尺寸的特征图可以检测不同尺寸的目标。通过特征图计算损失函数并完成整个网络的更新。
本研究采用所种植的玉米根系图片和文献[23]中的部分根系图片制作玉米根系数据集,将玉米根系置于纯色背景板上铺平,用相机采集本研究种植玉米的根系图像共计56幅,使用文献[23]数据集中的图像共计244幅,每幅图片主根3~6根,图像分辨率为416×416,在使用YOLO-V3网络训练数据前,使用LabelImg软件对采集的图像进行标注,标注类别分别为主根和侧根,保证每根主根尽量在一个矩形框里。标注完成将会生成含有类别和位置信息的.xml文件,标注完成后将300幅图像按7∶2∶1的比例划分为训练集(210幅)、测试集(60幅)和验证集(30幅)。
YOLO-V3网络训练采用COCO数据集作为初始训练集,初始学习率设置为0.001,学习率衰减方法为随机梯度下降和Adam优化。每批次训练数量设置为16,最大训练次数设置为500次,单步训练时间约为2 s,每训练10 min保存模型参数。训练300次后模型逐渐收敛。使用玉米根系数据集进行检测,YOLO-V3网络根系和根尖图像的识别精确率、召回率、1分数分别为85.50%、89.20%、87.31%,检测速度34帧/s,满足快速检测的需求。
2.2 根系图像修复
2.2.1根系图像预处理
由于试验环境的限制,采集图像背景中常带有反光和水渍,根系图像中泥土等污染物以及根系局部褐化、发黑等都会影响后续算法的效果,因此需要对图像进行预处理方法。
首先,对根系灰度图采用自适应对比度增强算法调整图像的全局对比度,减少反光和泥土杂质干扰;其次,采用查表(Look Up Table,LUT)直方图算法分离根系主体和深色背景,提取带有少量噪声的根系图像;然后,通过椒盐去噪、腐蚀和膨胀等算法去除噪声;最后,采用骨架算法获取根系的细化图像,提取根系的形态特征。
2.2.2根系断点判定
对预处理后的根系图像进行断点判定后输出断点坐标信息。断点的数学判定[24]如图1所示,在骨架化后玉米根系图像中截取分辨率为3×3的像素矩阵,矩阵中的1代表玉米根系像素点,0代表背景像素点,将该像素矩阵与核矩阵进行卷积得到特征矩阵,特征矩阵中心的值即为特征值,通过判断特征矩阵中各点的特征值来判断是否为断点,通过分析8种断点像素矩阵的特征得出当特征值为且仅为17、18、20、24、48、80、144、272这8种情况时,该点为断点,否则为非断点。
2.2.3主根直径的计算
作物根系在局部可视作斜率固定、值为1的矩形(图 2),由根的骨架点出发,沿轴、轴方向前进,当到达根系边缘,得到该方向上像素单位长度的值,代入式(1)计算出主根直径像素单位宽度width。
注:为根的骨架点到根系边缘沿轴方向的长度,像素;为根的骨架点沿轴方向的长度,像素;width为主根直径,像素。
Note:is the length of the root skeleton point to the root edge along the-axis, pixels;is the length of the root skeleton point to the root edge along the-axis, pixels; width is the diameter of the main root, pixels.
图2 玉米主根直径计算示意图
Fig.2 Calculation diagram of maize main root diameter
2.2.4径向生长修复
传统图像分割算法有区域生长算法、均值迭代分割算法、最大类间方差分割算法等,适用于分割物体像素点较为聚集的图像。根系图像由于存在断根、侧根等情况,造成主根像素点较为分散,传统图像分割算法的分割效果并不理想。
本研究提出一种径向生长修复算法,获取根系图像中的根尖范围,而后在根尖范围中进行根系的断点判定获得初始生长点,再通过生长规则识别主根和侧根,当遇到根系断点时通过修复规则进行主根修复,修复成功后沿着主根方向更新生长点继续识别和修复主根,当修复失败时终止修复算法,返回全部根系表型信息。其中,生长规则、终止条件和修复规则的具体步骤如下:
1)生长规则:每一个根的像素点均有绝对坐标(x,y)和相对坐标(rx,ry),相对坐标(rx,ry)为像素点(x+1,y+1)相对于像素点(x,y)的坐标。当根系生长进行到(x,y)点时,通过(rx,ry)生成此点对应的相关矩阵mat(图3),相关矩阵mat由待计算矩阵mat确定,将2个深色像素标为0并将其延长方向上的点记作4,再从4递减依次填入3、2、1即可确定相关矩阵mat。将以此像素点为中心生成的3×3待计算矩阵mat与相关矩阵mat相乘得到新矩阵,寻找新矩阵中最大值并计算出新的生长点绝对坐标(x+1,y+1)和相对坐标(rx+1,ry+1),更新待计算矩阵mat并对新的生长点继续执行生长规则,循环执行直至满足终止条件,将所有生长点存储到列表中。
2)终止条件:当(x,y)生长到断点时,以个像素为半径搜索区域内是否存在端点,如果存在端点即用3次样条插值拟合修复曲线;如不存在端点则终止算法。
3)修复规则:计算(x,y), (x-1,y-1),…, (x-N,y-N)等像素点的相对坐标的累加和(rx,ry),将相对坐标累加和(rx,ry)和当前生长点(x,y)相加得修复点(x,y),以(x,y)为新生长点返回步骤2)(图4)。
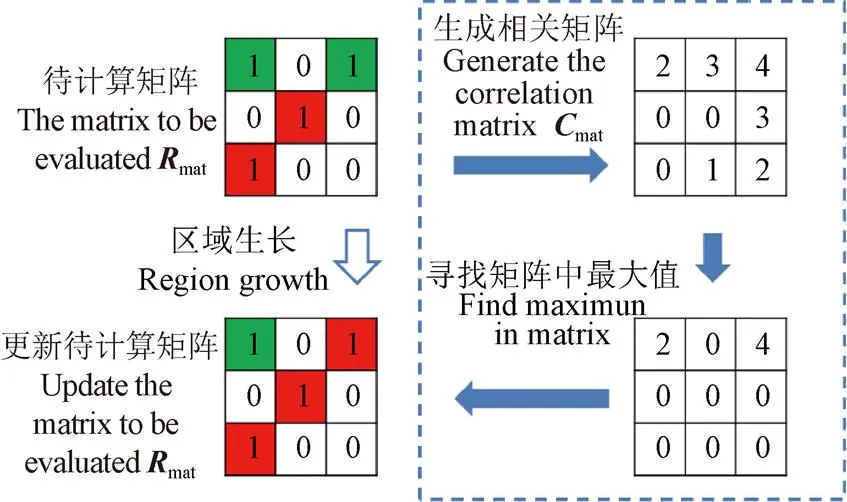
注:深色背景为已判定为主根的像素点,浅色背景为已判定为侧根的像素点,下同。
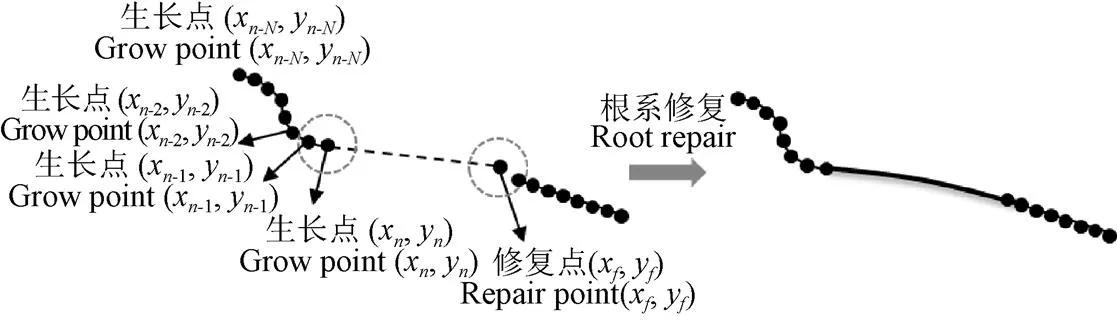
注:图4a中带有黑色圆形点的实线代表主根,虚直线代表相对坐标累加和(rxs, rys)的向量延长,点画圈为搜索范围,搜索半径为n个像素。图4b中的粗实线代表修复后的根系。
2.3 径向生长修复算法流程
径向生长修复算法流程如图5所示。首先,通过YOLO-V3网络对输入根系图像进行根尖识别,获取玉米根系的根尖区域;其次,对根尖区域内进行根系断点判定,获取初始生长点0,将0点绝对坐标与相对坐标输入算法进行迭代;当遇到根系分叉点P时,自动去除无效的根系分叉点并计算最优分叉点,将P1点代入算法继续迭代;当遇到根系断点P1时,搜寻端点领域内存在的其他根系断点并用3次样条差值修复主根,将修复点代入算法继续迭代,如果未搜寻到其他根系断点则终止算法,输出根系表型信息。
2.4 根系表型参数评价模型
根据本研究所提算法对根系图像进行处理获取表型参数,建立表型参数评价模型来计算预测参数和实际参数的量化差异,以此评价表型参数测量精度,表型参数评价模型如式(2)所示:
3 结果与分析
3.1 基于径向生长修复算法的玉米根系图像修复
通过YOLO-V3网络识别根系的主体位置并裁切图像(图6a);利用YOLO-V3网络识别主根根尖的位置,确定主根提取起始点(图6b);利用自适应对比度增强算法对图像进行信息增强(图6c);通过查找表直方图算法分离出根系和背景,通过椒盐去噪有效去除预处理过程中出现的各类噪声(图6d);利用骨架算法获取根系骨架(图6e);通过提取出的根系形态学信息,由径向生长修复算法对根系骨架进行处理,有效分离主根和侧根,并在根系的断点处进行自适应修复(图6f)。基于近邻生长的区域生长算法提取结果的对比如图6g。
3.2 玉米根系表型参数提取
选取本研究种植的玉米主根共145根,分别采集其主根长、主根直径和侧根数量,3种胁迫环境根系表型参数下的实测值、区域生长算法和径向生长修复算法测量值及其精度对比结果如表1所示。
在干旱环境下,采用区域生长算法时,由于断根侧根的干扰,主根长、主根直径测量结果精度较低,普通植株(MA1)分别为75.9%和73.4%,抗旱植株(MB1)分别为81.9%和82.4%;采用本研究径向生长修复算法,主根长、主根直径测量精度明显提高,普通植株(MA1)分别为97.1%和97.5%,抗旱植株(MB1)分别为98.3%和97.6%;径向生长修复算法与区域生长算法相比,在主根长、主根直径测量的精度上普通植株(MA1)提高15.2和15.1个百分点,抗旱植株(MB1)提高16.4和15.2个百分点。
在洪涝环境下,采用区域生长算法时,普通植株(MA2)分别为84.3%和94.0%,抗涝植株(MC2)分别为92.7%和85.2%;采用本研究径向生长修复算法,主根长、主根直径测量精度提升较小,普通植株(MA2)分别为99.3%和96.4%,抗涝植株(MC2)分别为97.1%和91.4%;径向生长修复算法与区域生长算法相比,在主根长、主根直径测量的精度上普通植株(MA2)提高15.0和2.4个百分点,抗涝植株(MC2)提高4.4和6.2个百分点。
在盐腌环境下,采用区域生长算法时,普通植株(MA3)分别为90.0%和88.2%,抗盐植株(MD3)分别为77.2%和83.1%;采用本研究径向生长修复算法,主根长、主根直径测量精度明显提高,普通植株(MA3)分别为97.4%和92.1%,抗盐植株(MD3)分别为95.2%和93.5%;径向生长修复算法与区域生长算法相比,在主根长、主根直径测量的精度上普通植株(MA3)提高7.4和3.9个百分点,抗盐植株(MD3)提高12.1和10.4个百分点。
由此可见,在干旱环境和盐腌环境下,径向生长修复算法比区域生长算法提取表型参数的精度提升较为明显,而涝渍环境下的提升较为有限。区域生长算法对主根长、主根直径测量的精度分别为83.6%和84.4%,径向生长修复算法对主根长、主根直径测量的精度分别为97.4%和94.8%,径向生长修复算法与区域生长算法相比,在主根长、主根直径测量的精度上提高13.8和10.4个百分点。结果表明,径向生长修复算法在玉米根系表型参数的提取精度更高,方法具有有效性。
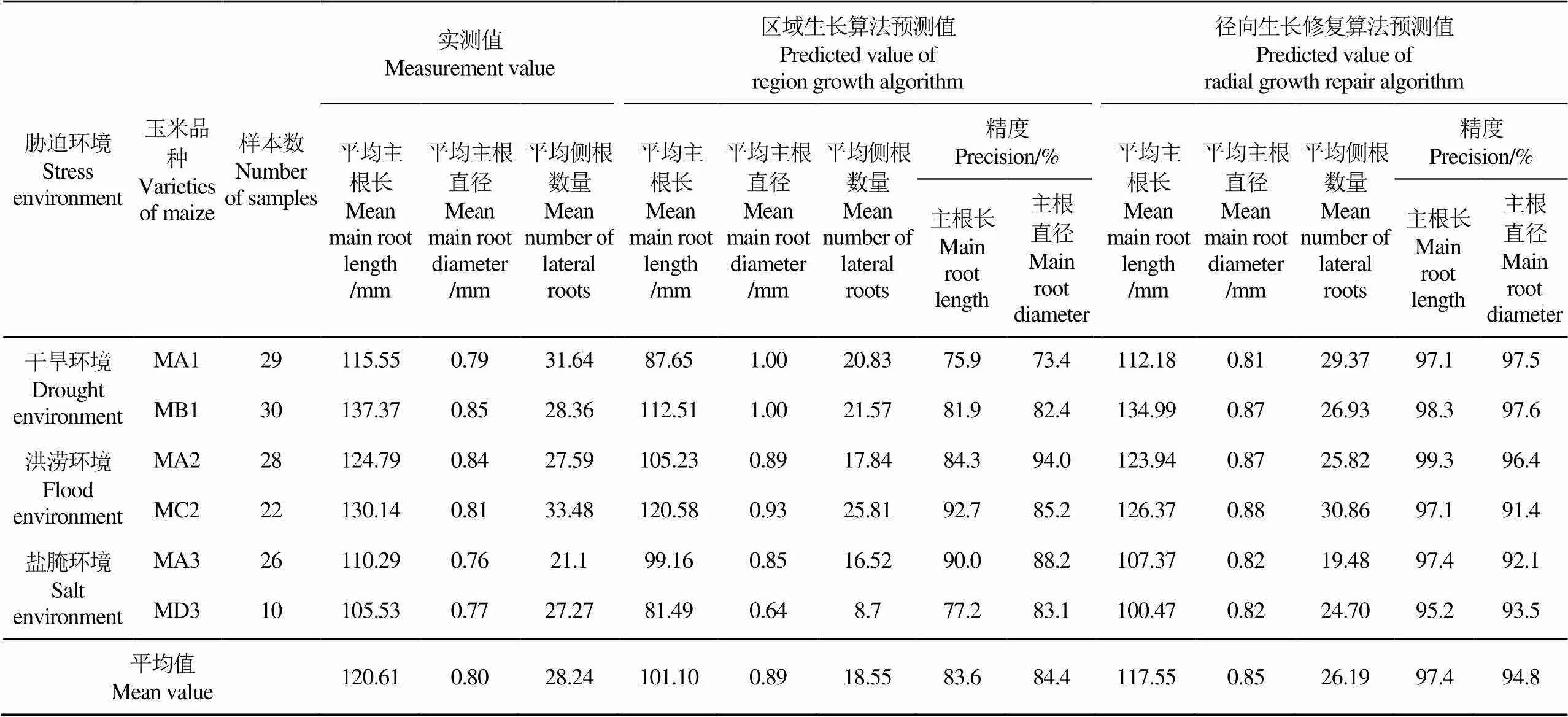
表1 玉米根系表型参数的实测值、区域生长算法和径向生长修复算法提取结果对比
4 结 论
针对玉米根系图像中的断根易导致根系表型信息难以精确提取的问题,提出一种根系径向生长修复算法,通过YOLO-V3检测模型定位根系和主根的区域,并通过断点判定算法提取根尖,以根尖为初始生长点,通过径向生长修复算法进行主根图像修复并提取主根和侧根表型信息。结果表明:
1)区域生长算法对主根长、主根直径测量的精度分别为83.6%和84.4%,径向生长修复算法对主根长、主根直径测量的精度分别为97.4%和94.8%,径向生长修复算法与区域生长算法相比,在主根长、主根直径测量的精度上分别提高13.8和10.4个百分点,径向生长修复算法在玉米根系表型参数的提取精度更高,证明了本文方法的有效性。
2)基于本研究算法,分别对普通、抗旱、抗涝和抗盐的玉米品种进行早期根系表型信息提取。结果表明,在干旱环境和盐腌环境下,径向生长修复算法比区域生长算法的提取精度提升较为明显,干旱环境下,普通植株(MA1)的主根长、主根直径提取精度提高15.2和15.1个百分点,抗旱植株(MB1)提高16.4和15.2个百分点;盐腌环境下,普通植株(MA3)提高7.4和3.9个百分点,抗盐植株(MD3)提高12.1和10.4个百分点;而涝渍环境下的提升较为有限,洪涝环境下,普通植株(MA2)的主根长、主根直径提取精度提高15.0和2.4个百分点,抗涝植株(MC2)提高4.4和6.2个百分点。研究结果可为根系表型自动化检测提供参考。
[1] 张翠梅,师尚礼,吴芳. 干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响[J]. 中国农业科学,2018,51(5):868-882.
Zhang Cuimei, Shi Shangli, Wu Fang. Effects of drought stress on root and physiological responses of different drought-tolerant alfalfa varieties[J]. Scientia Agricultura Sinica, 2018, 51(5): 868-882. (in Chinese with English abstract)
[2] 丁红,张智猛,戴良香. 不同抗旱性花生品种的根系形态发育及其对干旱胁迫的响应[J]. 生态学报,2013,33(17):5169-5176.
Ding Hong, Zhang Zhimeng, Dai Liangxiang. Responses of root morphology of peanut varieties differing in drought tolerance to water-deficient stress[J]. Acta EcologicaSinica, 2013, 33(17): 5169-5176. (in Chinese with English abstract)
[3] Zhao J, Xue Q W, Jessup K E, et al. Shoot and root traits in drought tolerant maize (L.) hybrids[J]. Journal of Integrative Agriculture, 2018, 17(5): 1093-1105.
[4] 李跃,万里强,李向林. 水分胁迫对不同紫花苜蓿品种幼苗生长特性和根系ABA含量的影响[J]. 中国农业大学学报,2017,22(10):75-83.
Li Yue, Wan Liqiang, Li Xianglin. Effects of water stress on the growth characteristics and root ABA content of alfalfa[J]. Journal of China Agricultural University, 2017, 22(10): 75-83. (in Chinese with English abstract)
[5] Pires M V, de Castro E M, de Freitas B S M, et al. Yield-related phenotypic traits of drought resistant maize genotypes[J]. Environmental and Experimental Botany, 2020, 171: 103962.
[6] Wang T, Rostamza M, Song Z H, et al. SegRoot: A high throughput segmentation method for root image analysis[J]. Computers and Electronics in Agriculture, 2019, 162: 845-854.
[7] Maenhout P, Sleutel S, Xu H, et al. Semi-automated segmentation and visualization of complex undisturbed root systems with X-rayCT[J]. Soil and Tillage Research, 2019, 192: 59-65.
[8] Santos D S, Faia P M, Garcia F A P, et al. Oil/water stratified flow in a horizontal pipe: Simulated and experimental studies using EIT[J]. Journal of Petroleum Science and Engineering, 2019, 174: 1179-1193.
[9] Fitters T F J, Mooney S J, Sparkes D L. Sugar beet root growth under different watering regimes: A minirhizotron study[J]. Environmental and Experimental Botany, 2018, 155: 79-86.
[10] Chu X, Wang W, Yoon S C, et al. Detection of aflatoxin B1(AFB1) in individual maize kernels using short wave infrared (SWIR) hyperspectral imaging[J]. Biosystems Engineering, 2017, 157: 13-23.
[11] Shi R L, Junker A, Seiler C, et al. Phenotyping roots in darkness: Disturbance-free root imaging with near infrared illumination[J]. Functional Plant Biology, 2018, 45(4): 400-411.
[12] Yang C, Lu X, Lin Z, et al. High-resolution image inpainting using multi-scale neural patch synthesis[C]//IEEE Conference on Computer Vision and Pattern Recognition, Honolulu: IEEE, 2017.
[13] Sarkar A, Iyengar R. Enforcing Linearity in DNN SuccoursRobustness and Adversarial Image Generation[M]. Cham: Springer, 2020.
[14] Yasrab R, Atkinson J A, Wells D M, et al. RootNav 2. 0: Deep learning for automatic navigation of complex plant root architectures[J]. Giga Science, 2019, 8: 1-16.
[15] Barnes C, Shechtman E, Finkelstein A, et al. PatchMatch: A randomized correspondence algorithm for structural image editing[J]. ACM Transactions on Graphics, 2009, 28(3): 1-11.
[16] Hund A, Trachsel S, Stamp P, et al. Growth of axile and lateral roots of maize: I development of a phenotying platform[J]. Plant and Soil, 2009, 325: 335-349.
[17] Eapen D, Martínez-Guadarrama J, Hernández-Bruno O, et al. Synergy between root hydrotropic response and root biomass in maize (L. ) enhances drought avoidance[J]. Plant Science, 2017, 265: 87-99.
[18] Wu Y Y, He J, Ji Y M, et al. Enhanced classification models for iris dataset[J]. Procedia Computer Science, 2019, 162: 946-954.
[19] Ghorchiani M, Etesami H, Alikhani H A, et al. Improvement of growth and yield of maize under water stress by co-inoculating an arbuscular mycorrhizal fungus and a plant growth promoting rhizobacterium together with phosphate fertilizers[J]. Agriculture, Ecosystems & Environment, 2018, 258: 59-70.
[20] Richter J A, Erban A, Kopka J, et al. Metabolic contribution to salt stress in two maize hybrids with contrasting resistance[J]. Plant Science, 2015, 233: 107-115.
[21] Redmon J, Farhadi A. YOLOv3: An incremental improvement[EB/OL]. [2018-04-08], https://arxiv.org/pdf/ 1804. 02767. pdf.
[22] Tian Y N, Yang G D, Wang Z, et al. Apple detection during different growth stages in orchards using the improved YOLO-V3 model[J]. Computers and Electronics in Agriculture, 2019, 157: 417-426.
[23] Tracy S R, Nagel K A, Postma J A, et al. Crop improvement from phenotyping roots: Highlights reveal expanding opportunities[J]. Trends in Plant Science, 2020, 25(1): 105-118.
[24] Lu W, Li Y, Deng Y M. Root phenotypic detection of different vigorous maize seeds based on Progressive Corrosion Joining algorithm of image[J]. Plant Methods, 2019, 15(1): 1-13.
Radial growth repair algorithm for maize root phenotype detection
Lu Wei1, Shao Yuning1, Wang Ling1, Luo Hui1, Zhou Ji2, Deng Yiming3
(1.,,210031,; 2.,CB3 0LE,; 3.,,48824,)
This study aims to improve the detection precision of plant root phenotyping in the images, particularly with broken roots. An algorithm of radial growing repair was proposed to apply to the evaluation of maize seed’s resistance to damage. A soil culture experiment was also conducted on the Pukou campus of Nanjing Agricultural University in China every month. After that, four varieties of corn seeds were selected: Yufeng 303 (ordinary control group), Zhengdan 958 (drought resistance group), Liyu 16 (water resistance group), and Zhengdan 958 (salt resistance group). Four kinds of resistant corn seeds were planted in trough-shaped and flat containers for 14d, including ordinary, drought-resistant, water-resistant, and salt-resistant corn seeds. Subsequently, the root system was taken out to rinse the residual soil with tap water, and then placed on a solid-color background plate to level out. Prior to image acquisition, the root length and diameter were measured by a ruler, and the number of main and lateral roots was counted to record. The specific procedure of image processing was as follows. Firstly, a series of operations was used to preprocess the collected images for the extraction of root systems from complex backgrounds, such as adaptive contrast enhancement, histogram grayscale searching, and pepper-salt denoising. As such, the discrimination of root images was improved to remove the noise during image acquisition, such as reflections and water stains. Secondly, the tips of main roots in maize images were detected by training the YOLO-V3 neural network. Finally, the radial growth repair algorithm was presented, including the direction discrimination of main roots in bifurcation points, and adaptive repair in end points. These strategies greatly contributed to extracting phenotypic parameters from main and lateral roots. Maize root datasets were also selected to evaluate the practicality and accuracy of radial growth repair. The results demonstrated that the phenotypic accuracy of repaired main roots lengths and diameter increased from 83.6% and 84.4% to 97.4% and 94.8%, respectively, compared with that processed by region growth algorithm. The phenotypic parameters extracted by radial growth repair algorithm was more precise than that extracted by region growth algorithm, which indicated that radial growth repair algorithm was suitable for extraction of maize root system parameters in different stress environments. The accuracy of radial growth was improved more obviously in the salty environments and drought environments. The results in this study demonstrated that the proposed radial growth repair algorithm could improve the accuracy of root image phenotype detection and could be efficient for maize resistance evaluation, which provided reference for the rapid extraction of root system phenotype.
image processing; algorithm; root system phenotype; environmental stress; radial growth; adaptive repairing
卢伟,邵昱宁,王玲,等.利用径向生长修复算法检测玉米根系表型 [J]. 农业工程学报,2021,37(18):195-202.doi:10.11975/j.issn.1002-6819.2021.18.023 http://www.tcsae.org
Lu Wei, Shao Yuning, Wang Ling, et al. Radial growth repair algorithm for maize root phenotype detection[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(18): 195-202. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.18.023 http://www.tcsae.org
2020-09-10
2021-09-03
国家自然科学基金项目(32071896,31960487);江苏省自然科学基金面上项目(BK20181315);江苏省农业科技自主创新项目(CX(20)3068);国际合作能力提增计划项目(2021-PY-11);苏州市科技创新项目(SNG2020039)
卢伟,博士,副教授,研究方向为智能机器人与无损检测技术。Email:njaurobot@njau.edu.cn
10.11975/j.issn.1002-6819.2021.18.023
S513
A
1002-6819(2021)-18-0195-08
