桃胶中Cu、Zn、Mn、Cd、Co、Pb六种微量元素的测定
2021-11-24杨葵华
杨葵华,罗 欢
(绵阳师范学院化学与化学工程学院,四川绵阳 621000)
0 引言
我国桃胶主要出产于华北、西北、华中、西南、华东等地.桃胶中主要成分是多糖、蛋白质等,其多糖由半乳糖、鼠李糖、葡萄糖醛酸等成分组成.不同产地、所报道的桃胶单糖种类及其含量有很大差异.国外研究报道桃胶中还含有少量的4-氧-甲基-葡萄糖醛酸和糖形成的γ-内脂.目前,国内除了对原桃胶药用的研究外,针对桃胶的研究主要集中于桃胶中多糖的提取、分离及工业桃胶的制备等方面,对桃胶中微量元素含量的测定甚少,本文选择了桃胶中的6种微量元素进行测量,这利于桃胶的食用价值和药用价值的研究.本文将选取的桃胶经过湿法消解后,采用火焰原子分光光度法测定桃胶中的Zn、Mn、Co、Pb、Cu、Cd六种常见的微量元素的含量.这六种微量元素对人体的健康起着不可忽略的作用.
1 实验原理
1.1 样品预处理原理
样品试样的分解方法主要有两个大类,分别是湿法分解法和干法分解法.湿法消解是目前做元素分析的最直接、最有效、最经济的一种样品前处理手段.湿法消解的方法有很多种.桃胶的有机物含相对较高,所以消解时应选择氧化性较强的酸体系.选择合适的酸体系对加快破坏有机物是非常重要的,同时有必要进行准确的温度控制,才能达到理想的消解效果.
1.2 原子吸收法原理
原子吸收光谱仪从原子化系统可分为火焰原子化和无火焰原子化两类[16].根据实验条件,本实验采用的是火焰原子化型的原子吸收光谱仪进行实验操作.
吸光度和被检测元素含量成正比例关系[15].公式为:
A=KC
(1)
其中K为吸收系数,C代表的是元素试样的浓度
1.2.1 标准曲线法 标准曲线法是一种定量方法,具有测定比较简洁、快速的优点.具体的操作方法是:用标准物质配制出一系列具有浓度梯度的标准溶液,在标准条件相同时,测定出各个标准样品的吸光度值Ai,以各标准样的吸光度值Ai为横坐标,以被测元素含量浓度Ci为纵坐标,得到一条标准曲线.在同样条件下,测定出样品的吸光度值Ax,由标准曲线得到的线性关系结合测得样品的吸光度值Ax求得其含量Cx.
1.2.2 标准加入法 标准加入法是测试检验仪器准确度领域中被广泛使用的一种方法.加标回收率的测定是实验室常用的确定准确度的方法之一,是实验室内经常用以自控的一种质量控制技术,也是检验过程中主要的质控方法.加标回收率可以反映出检验方法是否适用,检验仪器是否正常,以及检验人员的操作水平是否存在问题,确保分析结果的准确性和可靠性[17].
加标回收率的计算公式如下[18]:
(2)
2 实验部分
2.1 仪器
KJ-B型无油气体压缩机(辽宁鞍山力邦压缩机有限公司),TAS-990型原子吸收分光光度计(北京普析通用仪器有限责任公司),镉、锰、钴、铅、铜、锌空心阴极灯型号KY-1(北京有色金属研究总院),乙炔(绵阳市九安气体有限公司),电子分析天平 AUY120(上海标仪仪器有限公司),干净干燥的移液管,烧杯,比色管,容量瓶,玻璃棒等.
2.2 试剂
铜粉、ZnO、镉粉、锰粉、硝酸铅、Co3O4(G.R.,含量99.9 %以上,成都科龙试剂厂),HNO3、HCLO4(优级纯,成都科龙试剂厂)实验用水为超纯水,实验用的桃胶于商店购买.
2.3 样品预处理
用超纯水将样品清洗干净,去除样品表面附着的对测定有影响的污物.然后放在干净的小磁盘中,放置于烘箱中,调节温度为80~85 ℃,在此条件下烘干12 h至恒重.最后使用粉碎机将样品粉碎完全,过筛后,将样品保存试剂瓶内,放入干燥器备用.
2.4 样品消解处理
准确用分析天平称取4.001 5 g桃胶样品于干燥干净的小烧杯中,加入20 mL 混合酸{HNO3-HCLO4(3∶1)},将表面皿盖在烧杯上,静置15 h,在通风厨中,放在电热板上进行低温加热消解5 h,若溶液不够了则补加一些混合酸,直到溶液变得澄清透明,白烟大致消失.停止加热,冷却至室温后将溶液转入50 mL容量瓶中,定容至刻度,备用,等待测定.
2.4.1 锌、锰、镉的系列浓度梯度标准溶液的配制: 因为Zn、Mn、Cd元素采用空气-乙炔火烧法在原子吸收光谱仪上能够被检测出的检出限为:0.05~1.60 μg·mL-1.所以在实验配制Zn、Mn、Cd的标准溶液的浓度梯度选择为:0.064 μg·mL-1,0.128 μg·mL-1,0.32 μg·mL-1,0.64 μg·mL-1,0.96 μg·mL-1.
2.4.2 铜、铅、钴的系列浓度梯度标准溶液的配制: 因为Cu、Pb、Co元素采用空气-乙炔火烧法在原子吸收光谱仪上能够被检测出的检出限为:0.25~4.00 μg·mL-1.所以在实验配制Cu、Pb、Co的标准溶液的浓度梯度选择为:0.32 μg·mL-1,0.80 μg·mL-1,1.60 μg·mL-1,2.40 μg·mL-1,4.00 μg·mL-1.
2.5 仪器的工作条件
测定钴、镉、锰、铅、铜、锌时,空气压力调至0.2 MPa,其他测定条件见表1.

表1 各元素测定条件表
2.6 系列标准曲线
按照实验具体步骤准确测得样品吸光度,用吸光度作纵坐标,浓度为横坐标作图,即可得到其标准曲线图见图1,标准曲线的回归方程和相关的系数见表2.由图1可知,6种元素的浓度与其吸光度均具有良好的线性关系.

图1 所测元素的标准曲线图
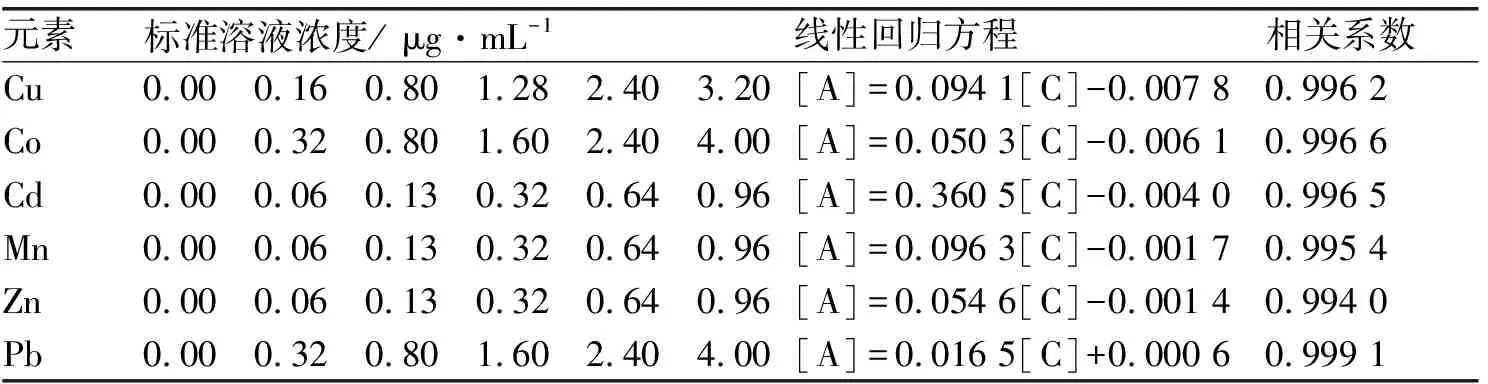
表2 线性回归方程及相关系数表
2.7 样品测定
测定结果说明桃胶含有较丰富的铜、钴、镉、锰、锌、铅元素,其值见表 3,
各元素含量比较见图2.
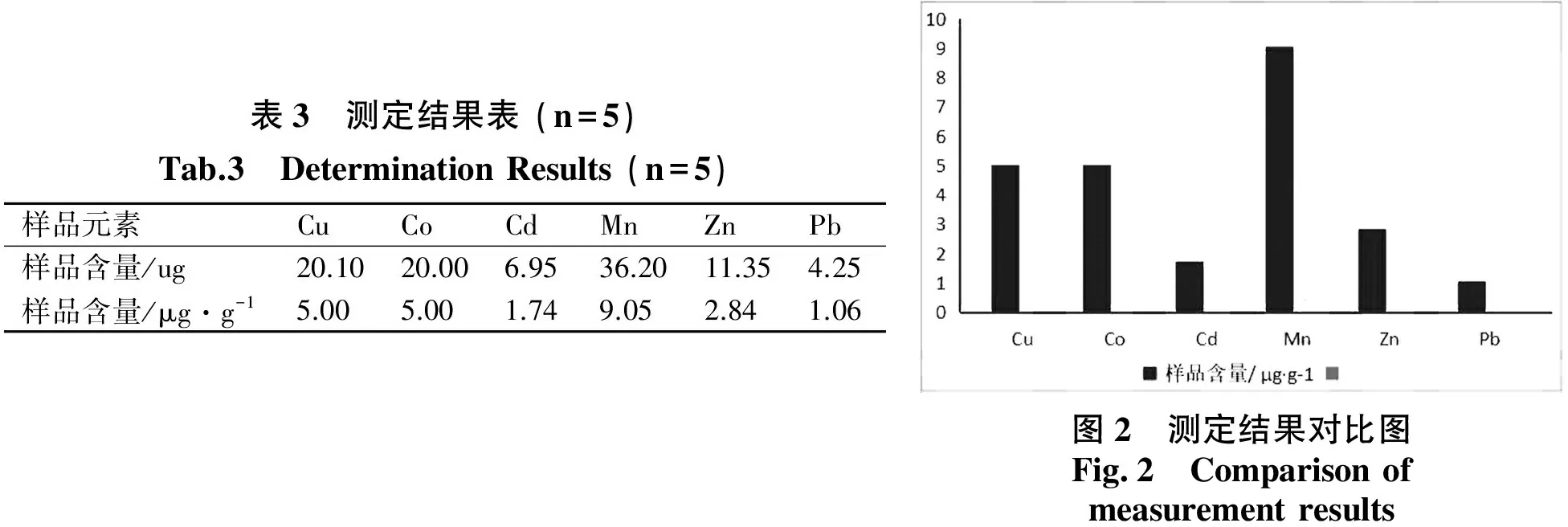
图2 测定结果对比图Fig.2 Comparisonofmeasurementresults
3 结果与讨论
3.1 样品处理消化液的选择
通常盐酸适合在80 ℃以下的消解体系,硝酸适合在80-120 ℃的消解体系,硫酸适合在340 ℃左右的消解体系,盐酸-硝酸的混酸适合在95-110 ℃的消解体系,硝酸-高氯酸的混酸适合在140-200 ℃的消解体系,硝酸-硫酸的混酸适合120-200 ℃的消解体系,硝酸-双氧水适合95-130 ℃的消解体系.因桃胶中有机物含量相对较高,所以选择氧化性强的消解试剂.本实验对HNO3-HCLO4(1∶1)、HNO3-HCL(3∶1)[21]2种比例的混酸消解体系进行了比较,结果表明,HNO3-HCLO4(1∶1)体系消解效果较差,赶烟时间长,而HNO3-HCLO4(3∶1)的消解能力强,过量试剂易于除去,空白低.所以选择HNO3-HCLO4(3∶1)对样品进行消解(注文章中酸液为体积比).
3.2 消化液用量的选择
试验采用了 用5 mL~40 mL不同量的混酸溶液进行样品消解实验.结果表明:实验条件下,当消化液用量低于5 mL,部分残渣溶解不完全.但当消化液用量加入到40 mL的HNO3-HCLO4(3∶1)消化液时,基体效应明显增加,赶烟时间也明显增加.最终实验选用了20 mLHNO3-HCLO4(3∶1)消化液消解样品[21].
3.3 回收率与精密度
本文中采用标准加入法,做了结果加标回收实验,测定结果见表4.
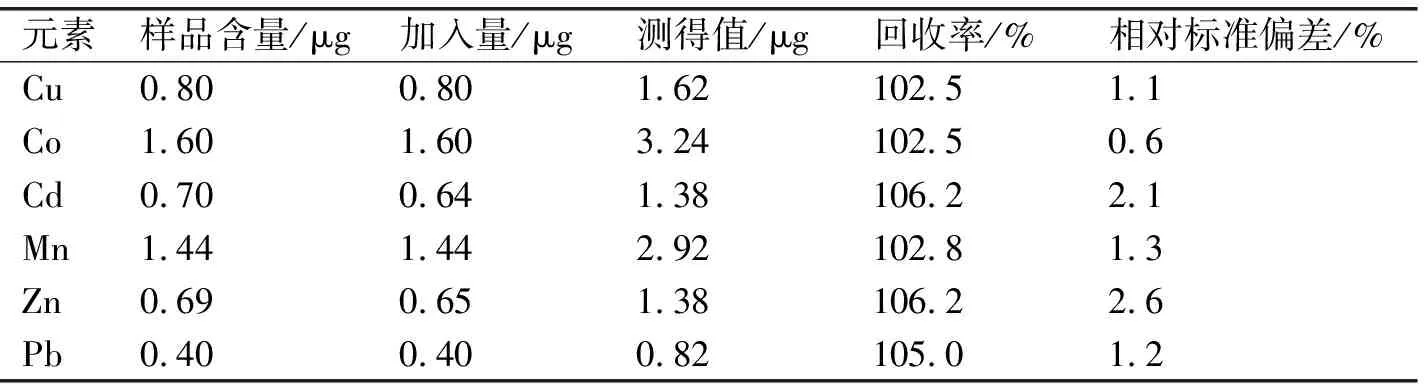
表4 结果加标回收率及精密度表(n=5)
回收率计算公式:加标回收率=(加标样品测定值-样品测定值)÷加标量×100%
从表4可以说明本论文中所采取的测定方法准确可靠.
4 结论
本文采用了火焰原子分光光度法测定桃胶中六种常见微量元素的含量.测定结果可知桃胶中含有丰富的微量元素,其结果:Cu为5.00 μg·g-1,Co为5.00 μg·g-1,Cd为1.74 μg·g-1,Mn为9.05 μg·g-1,Zn为2.84 μg·g-1,Pb为1.06 μg·g-1.结果加标的平均回收率在102.5%~106.2%之间,RSD值在0.6%~2.6%之间,表明本论文中的测定方法准确可靠.桃胶中含有较为丰富的对人体有利的微量元素如Mn、Cu、Co、Zn.通过实验测定也得出了此次所测的商品桃胶内也含有对人身体有害的微量元素Cd、Pb,不过含量较低.此次实验的结果也为进一步探究开发中草药的药理、药效与微量元素的关系提供了可靠的基础数据桃胶中锰的含量相对较高,铜、钴含量相近,锌、镉、铅的含量较少.
