非小细胞肺癌组织中肥胖基因FTO的表达水平及其对肿瘤细胞血管生成的影响*
2021-11-24潘华琴陈燕华应海玲顾艺难
潘华琴 陈燕华 应海玲 顾艺难
(1.泰州市人民医院,江苏 泰州 225300;2.南通大学医学院,江苏 南通 226019)
非小细胞肺癌(non-small cell lung cancer, NSCLC)是全球癌症死亡的主要原因之一[1-2]。我国肺癌的发生率逐年升高,尽管进行了数十年的努力以治疗这种恶性疾病,但是肺癌的预后仍然不利,晚期NSCLC尤为显著[3],因此需不断探索其发生发展机制,研究新的有效的诊断和治疗方法[4]。过去十年的研究中,人们对肺癌基因组和信号通路的深入分析进一步将NSCLC定义为一种具有遗传和细胞异质性的独特疾病[5]。人们利用通过微创技术获得的较小样本,病开发分子检测用来鉴定可用于临床诊断的遗传变异,但是工作仍然繁重[6]。因此,分子和细胞机制的探究仍然是明晰肺癌生长和发展规律的重要手段。脂肪和肥胖相关蛋白(FTO)或称为依赖酮戊二酸的双加氧酶,是一种在人类中由FTO基因编码的酶[7]。已在包括哺乳动物在内的大多数真核生物中发现mRNA可被N6-甲基腺苷(m6A)广泛修饰[8-9]。FTO基因在胎儿和成人组织中丰富表达,而且有效地使含有RNA的m6A去甲基化[10-11]。通过使目标mRNA脱甲基,FTO参与了多种生理和病理过程,包括肥胖[12]、糖尿病[13]、组织分化和癌症[14]。例如,FTO作为N6-甲基腺苷RNA脱甲基酶在急性髓细胞白血病中起着致癌作用[15]。但FTO在人类NSCLC中的作用仍然未知。研究显示,人NSCLC组织中FTO的mRNA的水平上调[16-17]。而且敲低FTO与肝内胆管细胞癌的血管生成和肿瘤微血管密度相关[18]。本研究观察了NSCLC患者肺癌组织与邻近癌旁组织中FTO的表达以及敲低FTO对NSCLC细胞血管生成的影响,现报告如下。
1 材料与方法
1.1 一般资料 纳入2019年1~12月在我院治疗的45例NSCLC患者。其中包括31例男性和14例女性,平均年龄59.8岁,TNM分期:Ⅰ期患者15例,Ⅱ~Ⅲ 期21例,Ⅳ期9例。肿瘤在组织学上分为22例腺癌和23例鳞状细胞癌。肺癌的诊断是根据世界卫生组织的形态学标准确定的。本研究经我院的医学伦理委员会审核通过,并经过患者和家属的知情同意。收集手术中留存的癌组织以及癌旁组织标本,保存于-80℃。
1.2 实时定量PCR(RT-qPCR) 使用TRIzol(美国Thermo公司)从NSCLC组织或细胞中提取总RNA。用一步RT-PCR试剂盒(日本TaKaRa公司)对1 μg的总RNA进行合成第一链cDNA。在ABI-7500 RT-PCR系统上使用GE Green Ⅱ(日本TaKaRa公司)进行qPCR检测。Tubulin基因被用作内参因。本研究中使用的引物如下:FTO forward: 5′-ACTTGGCTC CCTTATCTGACC-3′ FTO reverse: 5′-TGTGCAG TGTGAGAAAGGCTT-3′;Tubulin forward: 5′-CC AACCTGATGGGCATTGAGT-3′;Tubulin reverse: 5′-CGGCATGTAGAAGAAGGGTG-3′。
1.3 蛋白免疫印迹 在RIPA裂解缓冲液(上海碧云天公司)中裂解肺组织,NSCLC组织和培养的细胞。40 mg蛋白质进行SDS-PAGE分离,并将蛋白质转移到PVDF膜(美国Millipore)上,在TBST黄油中洗涤膜,在5%无脂牛奶中封闭1 h。然后将膜与特异性一抗在4℃孵育过夜。在该研究中使用了以下一级抗体:抗FTO抗体(美国Cell Signaling Technology公司,14386)和抗Tubulin抗体(美国Cell Signaling Technology公司,5335)。然后洗涤转印膜,与辣根过氧化物酶(HRP)偶联的二抗山羊抗兔IgG H&L(美国Abcam公司,ab6721)或兔抗山羊IgG H&L(美国Abcam公司,ab6741)孵育。信号由化学发光底物(美国Thermo Scientific公司,34080)检测,并使用Blue Devil放射自显影胶片进行显影。
1.4 细胞培养 从美国ATCC购买获得人肺癌细胞株A549、LC-AI、NCIeH1882、NCIeH466、HCIeH522和人小气道上皮细胞(人气道上皮细胞HSAEC)。将细胞培养在含有10%胎牛血清(Gibco)、100 U/mL青霉素和100 mg/mL链霉素的高糖DMEM(Gibco)中。所有细胞在37℃,含5% CO2的湿化气氛下培养。
1.5 慢病毒包装 制备携带短发夹RNA(short hairpin RNA, shRNA)的慢病毒,用以敲除FTO。对照sh-NC、sh-FTO的逆转录病毒颗粒购于美国Sigma公司。shRNA序列为:shFTO-1#: 5′-GCAGCTG AAATATCCTAAACT-3′, shFTO-2#: 5′-GCTGA AATAGCCGCTGCTTGT-3′。并将shRNA和肺癌细胞一起孵育 24 h。
1.6 体外细胞增殖测定 按照制造商说明书,使用CCK-8细胞增殖测定试剂盒(美国R&D SYSTEMS公司)检测细胞增殖。
1.7 荷瘤实验 实验体内肿瘤移植实验参考之前的研究[19]。在收获后的30 min内,在4至6 w龄的雄性小鼠的左右两侧皮下注射相同数量的sh-NC或sh-FTO的A549细胞。在实验结束时(4 w)测量肿瘤重量,每五天定量肿瘤体积。
1.8 小管形成实验 在37℃的条件下,将50 μL的荧光素(购于美国BD Biosciences,公司)溶解基质在孔中孵育0.5 h。将各组A549细胞(2×104/孔)接种于96孔板中,使用溶解基质。观察管状结构,并在显微镜下(德国 莱卡)拍摄。
1.9 统计学分析 采用GraphPad Prism 6软件进行统计学分析,如果没有另外的信息,所有值均表示为至少三个独立实验的mean±SEM。使用t检验或单向方差分析确定各组之间的统计差异,P<0.05为差异有统计学意义。
2 结果
2.1 FTO在人非小细胞肺癌组织中的表达 检测FTO在人肺癌组织中的表达。与癌旁组(10.23±2.06)相比,NSCLC组(14.61±1.71)中FTO的mRNA水平上调,差异有统计学意义(P<0.05),(图1A、1B)。此外,蛋白免疫印迹分析得出癌旁非癌组织和肺癌组织的相对表达量分别为(1.00±0.12)和(2.02±0.19),与癌旁组比,NSCLC组中FTO的蛋白水平上调(P<0.01),见图1C、1D。
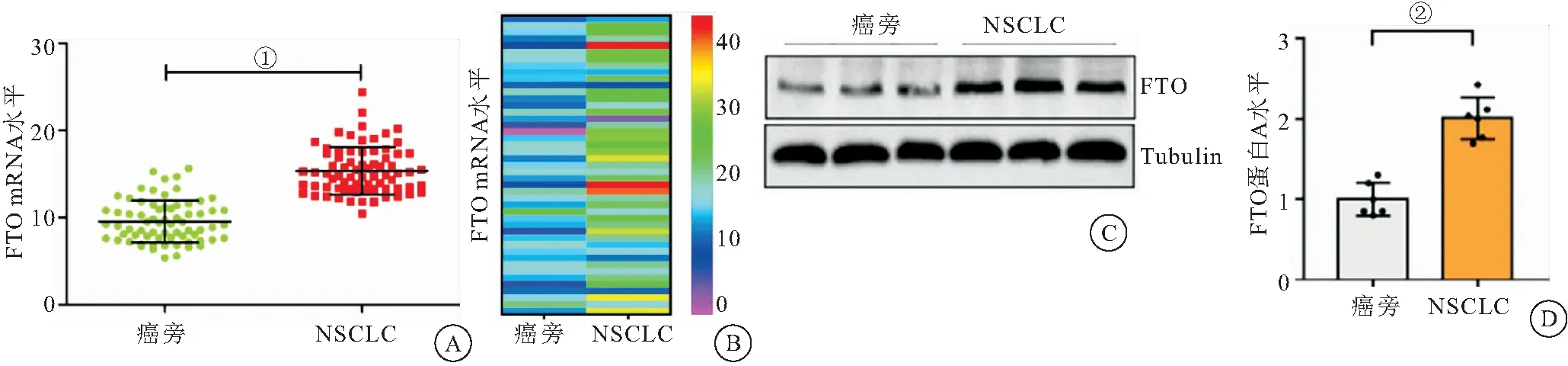
图1 FTO在非小细胞肺癌组织中的mRNA和蛋白的表达
2.2 FTO在肺癌细胞中的表达 检测正常人肺上皮细胞(HSAEC)和肺癌细胞系(NCIeH1992、NCIeH446、NCIeH566、A549、LCAI)中FTO的mRNA水平分别为(1.00±0.03)、(2.43±0.04)、(3.17±0.08)、(1.45±0.05)、(2.03±0.05)、(3.52±0.12)。结果显示,与HSAEC相比,肺癌细胞中FTO的mRNA和蛋白水平均升高,差异均有统计学意义(P<0.05),见图2。

图2 FTO在肺癌细胞中的mRNA和蛋白的表达
2.3 敲低FTO在体外抑制肺癌细胞的生长 为了研究FTO在人肺癌中的功能,我们用慢病毒介导的shRNA敲低肺癌细胞A549和LC-AI后的FTO表达,其中A549细胞的sh-NC组、sh-FTO#1组、sh-FTO#2组的相对表达分别为(1.00±0.08)、(0.19±0.03)、(0.12±0.06);sh-FTO#1组和sh-FTO#2组的表达均低于sh-NC(均P<0.01);LC-AI细胞的sh-NC组、sh-FTO#1组、和sh-FTO#2组的相对表达分别为(1.00±0.02)、(0.07±0.02)、(0.06±0.01);sh-FTO#1组和sh-FTO#2组的均低于sh-NC(均P<0.01),见图3A。分析了敲低FTO对细胞增殖的影响。其中LC-AI细胞的sh-NC组、sh-FTO#1组、sh-FTO#2组中的相对CCK8值分别为(9.83±1.02)、(4.20±0.38)、(4.51±0.30),sh-FTO#1组和sh-FTO#2组的相对CCK8值均低于sh-NC组(均P<0.01);A549细胞的sh-NC组、sh-FTO#1组、sh-FTO#2组中的相对CCK8值分别为(8.72±3.20)、(4.31±0.18)、(4.73±0.22),sh-FTO#1组和sh-FTO#2组的相对CCK8值均低于sh-NC组(均P<0.01),见图3B、3C。结果表明,敲低FTO抑制了人肺癌细胞的体外增殖,差异有统计学意义(P<0.05)。

图3 敲低FTO对肺癌细胞增殖的影响
2.4 敲低FTO抑制体内肺癌肿瘤生长 另外,将具有FTO稳定敲低的A549细胞进行小鼠体内癌细胞生长测定的体内异种移植实验。我们最终分析了从裸鼠分离出的肿瘤的肿瘤重量。结果显示,sh-FTO#1组、sh-FTO#2组的肿瘤体积均低于sh-NC组(均P<0.01)。sh-NC组、sh-FTO#1组、sh-FTO#2组的肿瘤质量分别为(1.05±0.34)g、(0.51±0.19)g、(0.70±0.22)g,sh-FTO#1组和sh-FTO#2组的肿瘤质量均低于sh-NC组,差异有统计学意义(P<0.01)。表明FTO敲除抑制了A549细胞的体内生长,见图4。
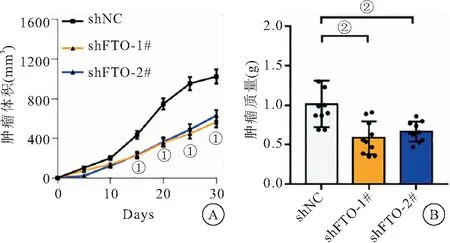
图4 FTO对裸鼠体内肺癌肿瘤生长的影响
2.5 FTO在体外抑制NSCLC的小管生成 探讨了敲低FTO是否抑制NSCLC的小管生成。sh-NC组、sh-FTO#1组、sh-FTO#2组的小管相对长度分别为(1.00±0.01)、(0.47±0.07)、(0.52±0.02),sh-FTO#1组和sh-FTO#2组的小管相对长度均低于shNC组,差异有统计学意义(P<0.05),见5。
3 讨论
本研究观察到FTO在NSCLC组织和多个肺癌细胞系中的表达明显升高,在体外对FTO进行敲低后观察到NSCLC细胞的增殖率降低,且对NSCLC细胞的血管生成能力和迁移率有明显抑制作用。本研究表明FTO是极为有潜力的血管生成相关的基因。
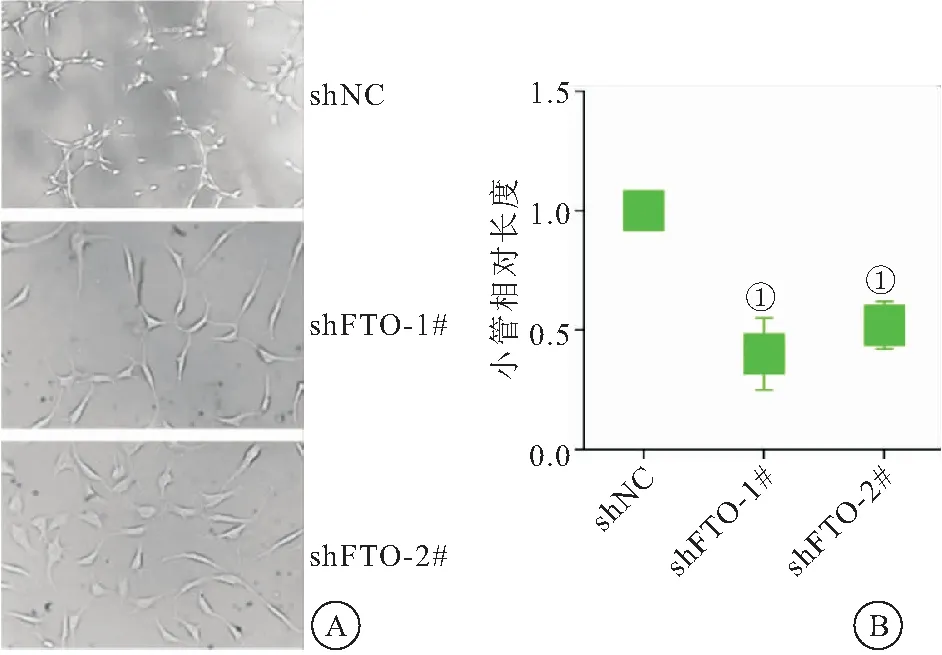
图5 FTO对体外A549细胞的小管形成影响结果
近年来的FTO的基因多态性研究显示FTO的SNP(包括rs9939609、rs17817449、rs8050136、rs1477196、rs6499640、rs16953002、rs11075995、rs1121980)和超重/肥胖及多种类型的癌症(包括乳腺癌、前列腺癌、肾癌、子宫内膜癌、胰腺癌、淋巴瘤和白血病)的风险增加密切相关[20-21]。而且,FTO内含子中的SNP都与乳腺癌风险显著相关[22]。值得注意的是,FTO内含子之外的SNP也可能与癌症风险相关FTO内含子与黑色素瘤风险显著相关[21]。最近研究表明,FTO在多种癌症中过度表达也发挥致癌作用[23-24],如白血病,脑肿瘤,乳腺癌,胃癌和宫颈鳞状细胞癌[22,25-28]。Li等在体内动物模型研究证明了FTO在癌症中的关键致癌作用,其中FTO在某些急性髓性白血病(AML)的亚型中高表达,强制表达FTO明显促进人AML细胞的存活和增殖,并抑制人类AML细胞的分化和凋亡,而强制表达FTO显著促进小鼠的白血病发生[29]。然而到目前为止鲜见FTO在NSCLC中的研究报道,本研究观察了45例NSCLC患者的癌组织和临近非癌组织中FTO的表达。结果表明,在NSCLC中FTO无论在mRNA水平还是蛋白水平,均比临近的非癌组织中高表达。另外,本研究利用五种肺癌细胞系A549、LC-AI、NCIeH1882、NCIeH466、HCIeH522,观察其与正常人小气道上皮细胞(人气道上皮细胞HSAEC)FTO mRNA和蛋白的表达变化,结果显示FTO在肺癌细胞中的表达高于HSAEC。由于FTO表达与肿瘤的关系,研究一致显示FTO高表达与肿瘤发展相关[23]。因此本实验结果的非小细胞肺癌中FTO高表达可能与非小细胞肺癌的发展同样有关。
有研究显示,敲低FTO可以显著增强人急性髓细胞性白血病AML细胞对全反式维甲酸的反应,并促进ATRA诱导的AML细胞分化[30]。R-2HG处理还使人AML细胞对体外标准化疗药物(如ATRA,阿扎胞苷,地西他滨和柔红霉素)的敏感性增强[30]。与FTO在耐药性中的作用相一致,FTO的过度表达是胃癌和子宫内膜癌等癌症预后不良的标志[27-28]。本研究使用shRNA在两个肺癌细胞系中敲低FTO,观察到FTO敲低可以明显抑制肿瘤细胞的增殖能力,并抑制肿瘤细胞在体内的生长。表明在非小细胞肺癌中FTO可能是一个潜在的治疗靶点。
人们在多种癌症类型中都观察到了血管生长和新的血管形成[31-32]。该过程取决于调节血管生成的因子并可能影响癌症侵袭性[33]。而且当内源性FTO的表达减少时,肿瘤细胞的增殖、侵袭被抑制[30]。Cui等[34]发现在小鼠中用FTO抑制剂靶向胶质母细胞瘤干细胞样细胞可以显著抑制体内由GSC引发的肿瘤发展。也有报道显示FTO表达的减少显著抑制人胃癌细胞系的细胞增殖,迁移和侵袭,当强制表达FTO时观察到相反的现象[35]。甚至FTO已被报道可参与促进肿瘤中的血管新生[17],但是在其他肿瘤中的报道较少。而多数研究证实FTO可以抑制肺癌细胞的体外侵袭现象[36]。我们推测FTO可能会影响非小细胞肺癌的血管生成能力。本研究体外敲低FTO后,A549细胞的小管形成的长度降低了近50%,证实敲低FTO可抑制非小细胞肺癌细胞的血管生成能力。表明FTO的表达模式可能影响肿瘤的血管生长,仍需更多的体内实验进行证实。
4 结论
FTO在NSCLC组织中的表达高于癌旁组织。低表达FTO通过抑制增殖和血管新生影响NSCLC的发生和发展。
