基于SDF-1α/CXCR4通路探讨补肾活血汤对骨质疏松大鼠骨折愈合的促进作用*
2021-11-23王雨辰
鄂 远,王雨辰
(常州市武进中医医院,江苏 常州 213139)
随着人口的不断老龄化,骨质疏松症(osteoporosis,OP)已成为我国重要的公共卫生问题[1]。流行病学调查[2]显示,在50岁以上的人群中,尤其是女性,OP的患病率急剧上升,约40%会发生骨质疏松性骨折(osteoporosis fracture,OPF)。相比于普通骨折,OPF愈合较难,是导致老年患者致残和死亡的主要原因之一[3]。中医在防治OPF中有其独特优势,补肾活血汤为补肾、活血的中医经验方,而肾主骨,因此被应用于骨折等骨伤科疾病的治疗[4]。骨折愈合包括间充质干细胞(mesenchymal stem cells,MSCs)趋化归巢、增殖和分化的炎症阶段,骨痂形成的修复阶段,以及破骨细胞吸收和成骨细胞新骨骨质形成的塑形阶段[5]。其中,MSCs的趋化归巢、增殖和分化是骨折正常愈合的前提。基质细胞衍生因子-1α(Stromal cell-derived factor-1α,SDF-1α)/CXC趋化因子受体4(C-X-C motif chemokine receptor 4,CXCR4)通路的激活为MSCs趋化、增殖和分化所必需,SDF-1α可引导MSCs向骨折处迁移并分化为成骨细胞,最终实现骨形成和骨愈合[6]。研究发现[7-8],骨质疏松症老年大鼠骨髓MSCs(bone MSCs,BMSCs)的成骨分化和迁移能力明显减弱,可能与骨形成明显减少有关,上调CXCR4水平可以改善BMSCs的迁移,可能有利于促进OPF愈合。本研究推测,补肾活血汤促进OPF愈合的作用可能与活化SDF-1α/CXCR4通路有关,并通过构建OPF大鼠模型对此进行探究,以期为临床应用提供理论基础。
1 材料与方法
1.1 实验动物 6个月龄SPF级健康雌性SD大鼠40只,体质量310~330 g,由江苏省中医药研究院采购,动物使用许可证号:SYXK(苏)2016-0018。饲养环境:温度(22±2)℃,湿度(65±5)%,光照/黑暗12 h交替,自由饮食,取材时将大鼠麻醉处死。本研究经医院动物伦理委员会批准并在3R原则下开展实验。
1.2 药物与试剂 补肾活血汤,方药组成:菟丝子、熟地黄、补骨脂各18 g,杜仲、枸杞子、肉苁蓉、当归、独活、没药、山萸肉各6 g,红花3 g,所有中药材购于本院中药房。将上述中药材在水中浸泡30 min,加入400 mL无菌水煎煮,最终浓缩至含生药量1 g/mL备用。CXCR4拮抗剂AMD3100(纯度≥98%,批号:A5602,Sigma公司);大鼠骨桥素(Osteopontin,OPN)ELISA试剂盒(批号:D731102)、碱性磷酸酶(Alkaline phosphatase,ALP)ELISA试剂盒(批号:D731033)及骨钙素(Osteocalcin,OCN)ELISA试剂盒(批号:D731045)均购自生工生物公司;兔源SDF-1α单抗试剂盒(批号:ab155090)、兔源CXCR4单抗试剂盒(批号:ab124824)、兔源OCN单抗试剂盒(批号:ab93876)、抗兔HRP-DAB免疫组化染色试剂盒(批号:ab64264)均购自Abcam公司。
1.3 主要仪器 uCT50显微CT(SCANCO Medical AG公司);台式高速冷冻离心机(美国Thermo);QX-W550型生物力学测试机(上海企想仪器);SMZ745光学显微镜(日本尼康)。
1.4 造模与分组 40只SD大鼠随机分为对照组、模型组、补肾活血汤组和补肾活血汤+CXCR4拮抗剂组,每组10只。大鼠麻醉固定后,备皮开腹,除对照组大鼠剪除卵巢附近脂肪组织外,其余各组大鼠剪除卵巢。正常饲养8周后,造模大鼠骨密度明显低于对照组则骨质疏松模型制备成功[9]。之后除对照组外,截断其余3组大鼠的右侧股骨,并插入克氏针,即成功建立骨折模型[9],对照组大鼠不进行手术。术后X光检查,股骨处有明显骨折线则OPF模型制备成功。
1.5 实验给药 补肾活血汤组大鼠每天灌胃给予10 g/kg补肾活血汤[9];补肾活血汤+CXCR4拮抗剂组大鼠每天灌胃给予10 g/kg补肾活血汤的同时,骨折处皮下注射40 mmoL/kg AMD3100[10]治疗,对照组和模型组大鼠分别灌胃和注射等体积生理盐水,连续给药4周。
1.6 观察指标
1.6.1 血清骨因子OPN、ALP、OCN 末次治疗24 h后麻醉处死各组大鼠。分离腹腔取腹主动脉血,并4 ℃3 000 r/min离心15 min取血清,用于血清因子检测。将血清与大鼠OPN、ALP、OCN试剂盒试剂混匀后,按说明书检测各因子水平。同时分离留取各组大鼠右侧股骨,剔除肌肉、脂肪等多余组织,用于后续检测。
1.6.2 骨微结构指标 将大鼠麻醉后置于照射平台上,采用X射线对股骨骨折处摄片,以评估骨折愈合情况。将“1.6.1”中股骨放在扫描专用圆筒中,设置扫描仪扫描参数为:55 kVp X射线、145 μA电流,以相同的方向进行扫描,每个平面采集1 000个图像。通过SCANCO评估程序一键分析骨折处新生骨组织的结构参数,包括骨密度(BMD)、骨体积分数(BV/TV)、骨小梁数量(TB.N)等,以评价新生骨质的微观结构。
1.6.3 生物力学指标 采用力学测试机对各股骨进行三点弯曲试验以评估其生物力学性能。将股骨样品以相同方向放置在相距20 mm的两个杆上,以1.0 mm/min的恒定速度将移动的十字头力传递至中轴,并读取仪器上骨刚性、骨最大载荷及弹性载荷等指标。
1.6.4 骨组织形态学观察 股骨组织经4%多聚甲醛固定、EDTA溶液脱钙、常规脱水等处理后,制备石蜡块,从骨折处开始对股骨进行切片(4 μm/片),经苏木素染色、盐酸分化、PBS脱色、伊红复染色后,在光学显微镜下观察。
1.6.5 股骨组织SDF-1α、CXCR4、OCN蛋白 股骨石蜡切片经脱蜡、水化、抗原修复、一抗SDF-1α(1 ∶500)、CXCR4(1∶200)、OCN(1∶200)孵育10 h、抗小鼠IgG-Biotin(1∶500)二抗孵育1 h、链霉亲和素-HRP缀合物孵育30 min、DAB显色、苏木素染液复染后,在显微镜下拍照。每张切片至少对6个视野进行免疫组化评分。
1.7 统计学方法 用Graphpad Prism 8或SPSS 25.00行统计分析,计量资料以“均数±标准差”()表示,多组比较使用单因素方差分析,两两比较用SNK-q或Bonferroni-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠骨折愈合情况 对照组大鼠股骨骨折处未见骨折线。治疗4周后,模型组、补肾活血汤+CXCR4拮抗剂组大鼠股骨骨折处可见明显骨折线和少量骨痂;补肾活血汤组大鼠股骨骨折处可见模糊骨折线和大量骨痂。(见图1)
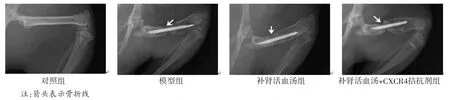
图1 各组大鼠股骨X 射线图像
2.2 各组大鼠骨微结构及生物力学指标比较 与对照组比较,模型组大鼠骨体积分数、骨密度、骨小梁数量、骨刚性、骨最大载荷及骨弹性载荷均明显降低(P<0.05);与模型组比较,补肾活血汤组大鼠骨体积分数、骨密度、骨小梁数量、骨刚性、骨最大载荷及骨弹性载荷均明显升高(P<0.05);与补肾活血汤组比较,补肾活血汤+CXCR4拮抗剂组大鼠骨体积分数、骨密度、骨小梁数量、骨刚性、骨最大载荷及骨弹性载荷均明显降低(P<0.05)。(见表1)
表1 各组大鼠骨微结构及生物力学指标比较()
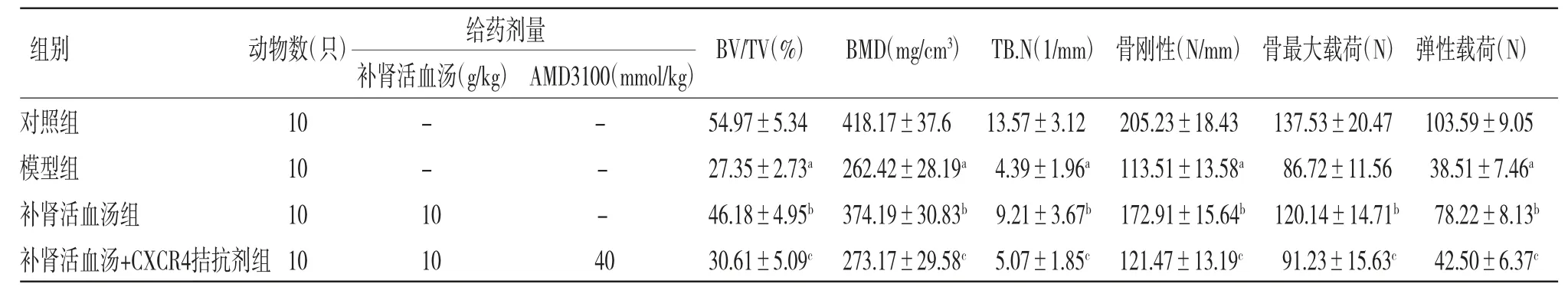
表1 各组大鼠骨微结构及生物力学指标比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与补肾活血汤组比较,cP<0.05
2.3 各组大鼠骨折处骨组织形态比较 对照组大鼠骨组织排列较为规则,骨小梁间隙较大且数量较多;模型组、补肾活血汤+CXCR4拮抗剂组大鼠骨折处有少量成骨细胞和新生骨组织;补肾活血汤组大鼠骨折处有较多成骨细胞和新生骨组织。(见图2)
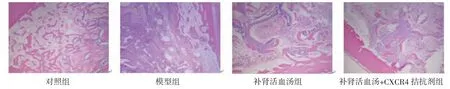
图2 各组大鼠骨折处骨组织形态比较(HE,×40)
2.4 各组大鼠血清OPN、ALP、OCN水平比较 与对照组比较,模型组大鼠血清OPN、ALP、OCN水平均降低(P<0.05);与模型组比较,补肾活血汤组大鼠血清OPN、ALP、OCN水平均升高(P<0.05);与补肾活血汤组比较,补肾活血汤+CXCR4拮抗剂组大鼠血清OPN、ALP、OCN水平均降低(P<0.05)。(见表2)
表2 各组大鼠血清OPN、ALP、OCN 水平比较()

表2 各组大鼠血清OPN、ALP、OCN 水平比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与补肾活血汤组比较,cP<0.05
2.5 各组大鼠骨折处SDF-1α、CXCR4、OCN蛋白表达水平比较 与对照组比较,模型组大鼠骨折处SDF-1α、CXCR4、OCN蛋白相对表达量明显减少(P<0.05);与模型组比较,补肾活血汤组大鼠骨折处SDF-1α、CXCR4、OCN蛋白相对表达量明显增加(P<0.05);与补肾活血汤组比较,补肾活血汤+CXCR4拮抗剂组大鼠骨折处SDF-1α、CXCR4、OCN蛋白相对表达量减少(P<0.05)。(见图3、表3)
表3 各组大鼠骨折处SDF-1α、CXCR4、OCN 蛋白相对表量达比较()

表3 各组大鼠骨折处SDF-1α、CXCR4、OCN 蛋白相对表量达比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与补肾活血汤组比较,cP<0.05
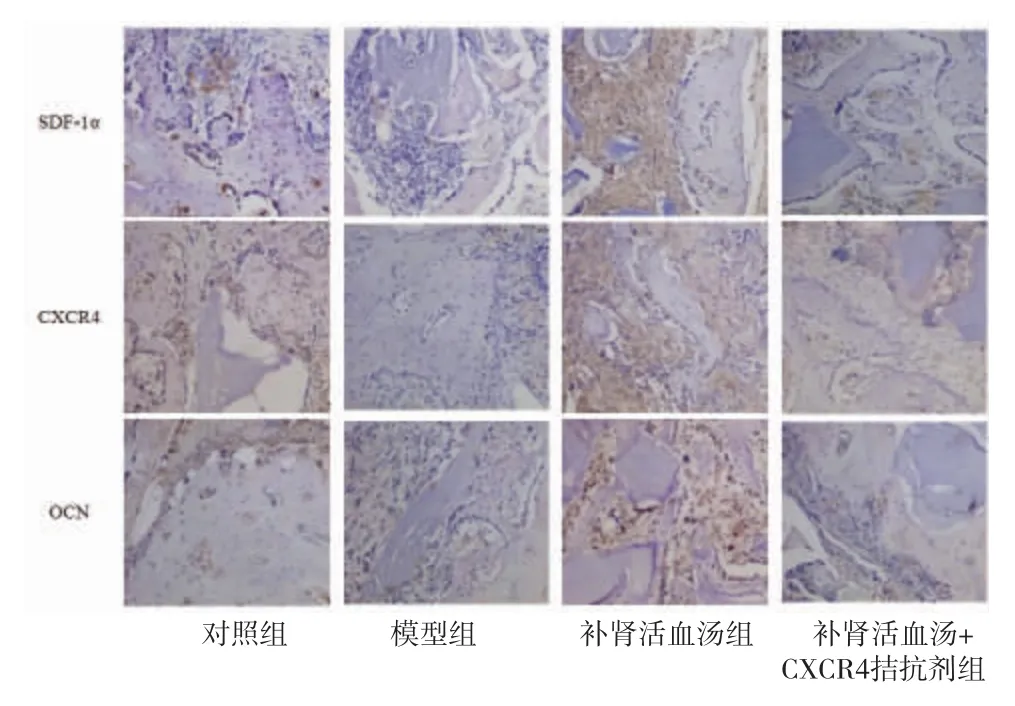
图3 各组大鼠骨折处SDF-1α、CXCR4、OCN 蛋白表达情况(免疫组化,×200)
3 讨论
OPF患者由于存在骨量减少和骨微结构破坏等基础病变导致其骨折愈合难度较高。目前对于OP的治疗主要采用抗骨吸收药物和促骨形成药物,然而存在一定的副作用。中医学并无“骨质疏松”的名称,其临床特征和病理机制与“骨痿”“骨枯”等较为接近,肾精亏虚、骨失滋养为其发病的原因,应从补肾强骨治疗[11]。中医认为骨折愈合的过程涉及瘀去、生新和骨合,对骨折的治疗应从活血逐瘀、接筋续骨、滋肾补血等多方面结合进行[12]。补肾活血汤最早记录于《伤科大成》,具有益肾补精、强骨益髓、活血逐痛等功效,为临床治疗骨折的常用方剂,可同时满足骨质疏松和骨折的治疗思路。临床研究显示[13],补肾活血汤可增加OPF患者术后骨密度,提高其骨矿物质含量,促进骨折愈合。体内和体外研究显示[9,14],补肾活血汤可激活Runt转录因子(Runt-related transcription factor2,Runx2)及转录因子Osterix的表达,促进骨髓MSCs成骨分化及OPF大鼠骨折愈合。本研究观察到,经补肾活血汤治疗的OPF大鼠骨折线模糊,出现大量骨痂,与既往研究一致。并且补肾活血汤可明显提高骨体积分数、骨密度、骨小梁数量,改善骨微结构,增加骨组织的生物应力,促进骨组织新生,增加血清中成骨因子水平,表明补肾活血汤可促进成骨形成,加速OPF大鼠骨折愈合过程。
炎症细胞、MSCs等细胞募集、迁移和归巢至骨折部位对于炎症过程、新血管及软骨形成、成骨和骨愈合至关重要,趋化因子等为上述细胞迁移过程中的主要调节剂[15]。SDF-1α为趋化因子CXC亚家族的一员,由骨髓基质细胞分泌,在血管生成和细胞归巢中起主要作用,CXCR4广泛分布在MSCs和骨髓基质细胞的表面,为SDF-1α的受体[16]。缺血性组织损伤处SDF-1α表达迅速上调,可招募循环中携带CXCR4的MSCs,并将其招募至损伤部位,进而协助组织修复[17]。另有研究指出,糖尿病骨折大鼠骨折部位SDF-1α和CXCR4表达降低,与骨折愈合不良有关[18]。SDF-1α/CXCR4通路可能在骨骼再生中起关键作用。本研究发现,模型组大鼠骨折处SDF-1α、CXCR4、OCN蛋白相对表达量低于对照组,可能是其骨折愈合不良的原因。SDF-1α和成骨基因在牵引成骨区的表达显著增高,SDF-1α/CXCR4信号拮抗剂则可显著抑制牵引成骨中的骨矿化和新骨形成[10],而过表达CXCR4可提高OP大鼠骨密度,增加骨形成[19]。熊云谱等[20]发现补肾活血汤含药血清可促进骨髓MSCs的迁移,并可上调CXCR4蛋白表达。本研究中,补肾活血汤治疗后OPF大鼠骨折处SDF-1α、CXCR4、OCN蛋白相对表达量明显升高,表明补肾活血汤可促进骨组织SDF-1α/CXCR4通路活化,而SDF-1α和CXCR4相互作用可诱导MSCs等向骨折处迁移并分化为成骨细胞,促进骨形成,加速骨折愈合[21]。另外,采用SDF-1α/CXCR4通路拮抗剂AMD3100干预后,补肾活血汤对OPF大鼠骨折愈合的改善作用被AMD3100逆转,进一步表明补肾活血汤可能通过激活SDF-1α/CXCR4通路,诱导MSCs向骨折处迁移,促进骨形成,加速骨折愈合。
综上所述,补肾活血汤可能通过激活SDF-1α/CXCR4通路,诱导BMSCs向骨折处迁移,促进骨形成,加速OPF大鼠骨折愈合。然而中药多同时作用于多靶点,补肾活血汤对OPF愈合的促进作用可能涉及其他机制,有待进一步研究。
