分子标志物预测甲状腺乳头状癌淋巴结转移的价值△
2021-11-23刘春浩赵豪李小毅
刘春浩,赵豪,李小毅
中国医学科学院北京协和医学院北京协和医院基本外科,北京 100730
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)约占所有甲状腺恶性肿瘤的85%,近年来,其发病率迅速提高。通过规范的治疗,PTC患者的预后较为满意。在整个生命周期中,大多数患者面临的主要问题是复发和再次手术。PTC中颈部淋巴结转移率为20%~90%,以颈部中央区居多。淋巴结转移是PTC患者制订治疗方案和提示预后的重要依据,也是患者复发率高、生存率低的重要危险因素。超声检查是较为常用且重要的颈部淋巴结评估手段,但是其颈部淋巴结转移阳性预测值较低,容易漏诊隐匿性淋巴结转移。研究探讨预测淋巴结转移的因素,发现一些对淋巴结转移有预测价值的临床特征,如男性、年龄、多灶、肿瘤大小等,但是它们对于淋巴结转移的预测价值仍不够理想。因此,需要探索一种更有效的方法来帮助预测淋巴结转移。目前研究显示,某些基因的改变与淋巴结转移相关,例如鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog,BRAF)基 因 、端 粒酶 逆 转 录 酶(telomerase reverse transcriptase,TERT)和长链非编码RNA(long noncoding RNA,lncRNA)等。本文对PTC与淋巴结转移相关的分子标志物进行综述,以期对PTC淋巴结转移的预测、诊断提供帮助。
1 BRAFV600E 基因突变与PTC淋巴结转移
近年来,人们积极寻求预后分子标志物来改善PTC的风险分层,其中BRAF突变受到了最广泛的关注。BRAF是PTC的一个主要致癌突变,PTC中BRAF基因突变率为29%~83%,在BRAF突变高发的地区韩国,PTC患者BRAF基因突变率在80%以上。研究表明,BRAF基因突变与PTC侵袭性临床病理特征相关,且与PTC的复发明显相关,其被认为是PTC预后的分子标志物。本文探讨BRAF基因突变与PTC淋巴结转移相关的机制及其预测价值。
BRAF基因突变主要通过激活促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路促进甲状腺癌进展,相关信号分子激活大鼠肉瘤癌基因(rat sarcoma oncogene,RAS)蛋白,与快速纤维肉瘤(rapidly accelerated fibrosarcoma,RAF)蛋白激酶相互作用,其中B型RAF激酶即BRAF在RAF家族中含量最多、效力最强,激活的BRAF磷酸化并激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MEK)1/2,MEK1/2依次磷酸化并激活两个直接下游的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2,ERK1/2随后磷酸化下游蛋白,最终导致细胞核中涉及细胞增殖的各种基因表达改变,BRAF基因突变会促进这一信号通路的活性,从而促进肿瘤的发生和发展。(图1)
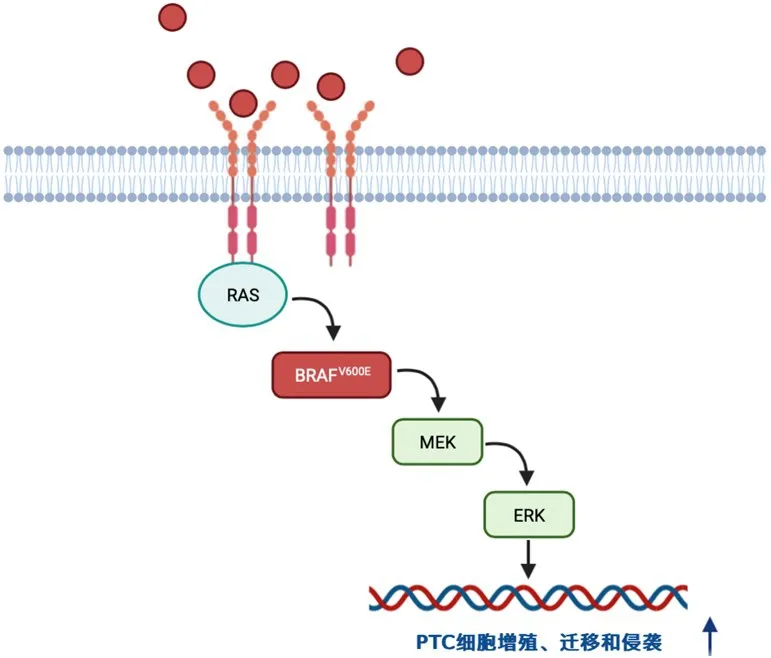
图1 BRAFV600E 基因突变介导PTC 细胞恶性行为的作用机制
韩国的一项回顾性研究中共纳入3107例PTC患者,结果显示,BRAF基因突变率为81.4%,淋巴结转移率为42.4%,BRAF基因突变组和未突变组淋巴结转移率分别为43.9%(1111/2530)和35.9%(207/577),差异有统计学意义(P<0.01);在肿瘤直径为2.0~4.0 cm的PTC患者中,BRAF基因突变率为81.0%(188/232),淋巴结转移组与非转移组BRAF基因突变率分别为85.0%和69.5%,多因素分析提示BRAF基因突变是中央区淋巴结转移的独立预测因子(OR=3.494,P=0.002)。在另一项回顾性研究中共纳入977例甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)患者,结果显示,BRAF基因突变率为40.1%,淋巴结转移率为23.4%,在BRAF基因突变且肿瘤直径>0.5 cm的患者中,单因素(OR=1.76,P=0.05)和多因素(OR=1.96,P=0.03)分析均显示BRAF基因突变与淋巴结转移显著相关。Zhang等的荟萃中,共纳入16 936例PTC患者,分析淋巴结转移与BRAF基因突变的关系,其中BRAF基因突变型患者中46.5%(5281/11 359)发生淋巴结转移,BRAF野生型患者中33.3%(1858/5577)发生淋巴结转移,提示BRAF基因突变是淋巴结转移的风险因素(OR=1.67,P=0.004)。但是,也有相关研究显示BRAF基因突变对于淋巴结转移没有预测价值。虽然上述韩国研究提示在肿瘤直径为2.0~4.0 cm的PTC患者中BRAF基因突变与淋巴结转移相关,但在肿瘤直径为0.5~1.0 cm的PTC患者中,淋巴结转移组与非转移组BRAF基因突变率差异不大(85.5%vs 81.5%,P=0.047),多因素分析亦未显示BRAF基因突变与淋巴结转移相关(OR=1.232,P=0.163);在其他肿瘤直径中,也未发现BRAF基因突变与淋巴结转移相关。而且,Chen等研究也未发现BRAF基因突变与淋巴结分期相关,在373例PTC患者中BRAF基因突变型和野生型患者N分期分别为46.9%和51.3%,N分期分别为53.1%和48.7%,差异均无统计学意义(P>0.05);多因素分析亦未发现BRAF基因突变与淋巴结分期相关(OR=1.797,P=0.109)。
从上述临床研究可以看出,虽然大样本的临床研究提示BRAF基因突变与PTC淋巴结转移相关,BRAF基因突变组有更高的淋巴结转移率,但是BRAF基因突变组和野生组之间的淋巴结转移率差别不大。此外,并无研究发现BRAF基因突变与淋巴结转移存在相关性,因此,其预测PTC淋巴结转移的价值需进一步探讨。
2 RAS基因突变与PTC淋巴结转移
RAS位于BRAF的上游,是一个鸟苷三磷酸(guanosine triphosphate,GTP)结合蛋白家族,通过MAPK和磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)-蛋白激酶B(protein kinase B,PKB,又称AKT)通路调控细胞生长。RAS家族由三个高度相关的成员KRAS、HRAS和NRAS组成,是有核细胞生长、增殖和分化过程的重要调节因子。由BRAF基因突变引起下游效应通路的激活,最终导致异常的细胞增殖、迁移和侵袭,从而促进肿瘤的恶性表现。(图2)
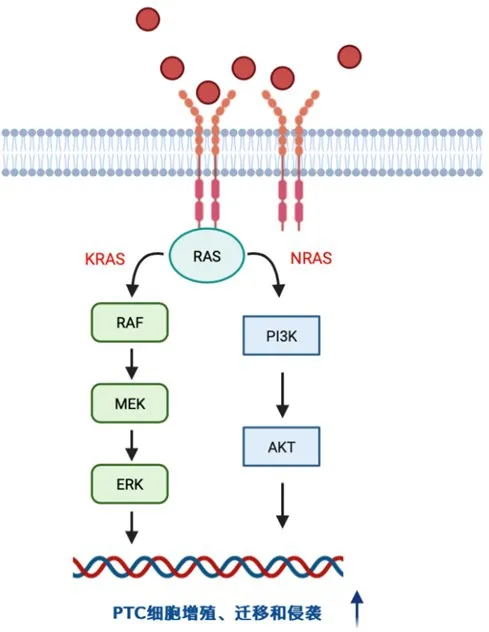
图2 RAS 基因突变介导PTC 细胞恶性行为的作用机制
滤泡型甲状腺乳头状癌(follicular variant of papillary thyroid carcinoma,FVPTC)是一种常见的甲状腺癌类型,占所有PTC的15%~20%,而RAS突变PTC的主要病理类型为FVPTC。Yip等的研究连续检测了1510例甲状腺癌患者基因谱,其中RAS突变患者323例(31%),在RAS突变的PTC患者中87%(270/312)为FVPTC,而经典型甲状腺乳头状癌(classical variant of papillary thyroid carcinoma,CVPTC)仅为3%(9/312)。与两项小样本的研究结果相似,RAS突变PTC中FVPTC分别为74%和96%。Yu等比较了21 796例CVPTC患者和10 740例FVPTC患者的临床病理特征,发现FVPTC患者的淋巴结转移率明显低于CVPTC患者(16%vs 34%,P<0.01)。Giani等的研究同样发现FVPTC患者淋巴结转移率明显低于CVPTC患者(9.1%vs 25.7%,P<0.01)。Yip等的研究数据进一步提示RAS突变的PTC淋巴结转移率低于BRAF突变的PTC(12.8%vs 72.7%),而CVPTC是BRAF突变的常见类型。由此可见,RAS基因突变常见的FVPTC促进肿瘤转移可能主要通过其他方式来实现,如血行转移,而非淋巴结转移,这与临床中RAS突变常见的FVPTC血行转移多见情况类似。因此,RAS基因突变对于FVPTC的淋巴结转移预测价值有限。
3 TERT 启动子突变与PTC淋巴结转移
TERT基因是位于5号染色体上的一个35 kb基因,其通过多种遗传和表观遗传改变来影响端粒酶活性,在肿瘤形成中起着关键性作用。TERT启动子突变可导致E-twenty-six(ETS)转录因子家族新的碱基对结合位点,ETS家族成员中激活的GA结合蛋白转录因子亚基α(GA binding protein transcription factor subunit alpha,GABPA)与GA结合蛋白转录因子亚基β(GA binding protein transcription factor subunit beta,GABPB)在TERT启动子突变位点结合,激活TERT,进而促进PTC细胞的增殖、迁移和侵袭。此外,TERT启动子区域的甲基化也在肿瘤恶性行为方面发挥着重要作用,PTC复发患者的TERT启动子甲基化显著高于肿瘤未复发患者,而且TERT启动子甲基化与淋巴结转移、TNM分期晚有关。这些研究提示TERT启动子区域的突变或甲基化能够促进PTC的恶性行为,导致肿瘤迁移和侵袭增加。(图3)

图3 TERT 启动子区域突变与促进PTC 恶性行为的作用机制
一项173例TERT启动子突变型和1587例TERT启动子野生型患者的荟萃分析结果显示,TERT启动子突变型和野生型患者分别有53.18%和37.30%出现淋巴结转移,TERT启动子突变与淋巴结转移之间存在显著相关性(OR=1.76,P=0.01)。Yang等研究中,TERT启动子突变率为10.6%(1027/9653),与PTC淋巴结转移显著相关(OR=1.64,P<0.05)。这些研究提示TERT启动子突变能够促进PTC的淋巴结转移。但是也有研究未发现TERT启动子突变与PTC淋巴结转移相关,一项共纳入330例TERT启动子野生型和12例TERT启动子突变型PTC患者的研究中未发现TERT启动子突变与淋巴结转移相关,较野生型患者,TERT启动子突变型患者的中央区淋巴结转移率[83.3%(10/12)vs 65.1%(215/330),P=0.190]、侧颈区淋巴结转移率[75.0%(9/12)vs 49.0%(152/330),P=0.078)]、淋巴结转移数目>5个[50.0%(6/12)vs 31.8%(106/330),P=0.190]均无显著增加。虽然如此,但由于研究中突变组较少的病例数量,其结果的可靠程度仍需进一步验证。
从TERT启动子突变的致病机制到PTC患者临床病理数据,均高度提示TERT启动子突变患者的淋巴结转移率发生风险更高,因此对于这类患者,应采取更积极的治疗,包括预防性颈淋巴结清扫术。
4 RNA与PTC淋巴结转移
许多肿瘤基因组突变存在于不编码蛋白质的区域内,这些区域通常转录成lncRNA,lncRNA是一类没有任何编码能力的调节RNA分子,长度超过200个核苷酸,在多种肿瘤中调节肿瘤细胞的增殖、迁移和侵袭。微小RNA(microRNA,miRNA)是一种小的非编码RNA,以序列导向的方式负调控靶mRNA的稳定性和(或)翻译,以减少靶蛋白的表达,多年来已被证明在肿瘤发生发展中发挥着重要作用。环状RNA是有限蛋白质编码潜力的共价闭环结构,不能被RNA外切酶降解,从而维持它们在细胞中广泛稳定表达,其调节紊乱后可能导致肿瘤的发生。目前研究已经发现lncRNA能够通过多种机制促进PTC细胞的恶性行为,如增殖、迁移和侵袭等,通过miRNA介导的机制是其主要的促瘤机制,多种miRNA已被发现在PTC的恶性行为中发挥着调节作用。研究人员发现,lncRNA和miRNA能够通过增强上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)来促进PTC的进展,EMT是介导肿瘤细胞转移的重要机制,这一过程的增强可能导致PTC主要的转移(淋巴结转移)增加。此外,环状RNA作为一组调节因子,与miRNA相互作用,抑制其表达和功能,从而在多种疾病中发挥调节作用。相关研究提示ABHD11-AS1、HOXD-AS1、长基因间非编码RNA 02454(long intergenic non-protein coding RNA 02454,LINC02454)、小核仁 RNA 宿主基因 3(small nucleolar RNA host gene 3,SNHG3)、AGAP2簇反义 RNA 1(AGAP2 cluster antisense RNA1,AGAP2-AS1)、LINC00460、LOC389641、n384546、lncRNA癌症候选易感物9(cancer susceptibility 9,CASC9)高表达患者的阳性淋巴结或总淋巴结转移率高于低表达者,差异均有统计学意义(P<0.05)。一项502例PTC患者的研究中显示,LOC389641高表达组PTC淋巴结转移率明显高于低表达组[56.2%(141/251)vs 32.3%(81/251),P<0.01)]。Chen 等的研究结果显示,LINC00460高表达组淋巴结转移率是低表达组的近10倍[43.3%(11/26)vs 4.8%(1/22),P<0.01]。目前也有少量临床研究发现,其他类型的RNA与PTC淋巴结转移相关。circ_0001666、circ_0002111、circ_0122683和circ_0008274高表达患者的阳性淋巴结或总淋巴结转移率高于低表达者,差异均有统计学意义(P<0.05)。从这些研究可以看出,lncRNA的表达水平高低与PTC淋巴结转移之间存在相关性,尤其是LOC389641和LINC00460等,似乎展现了与淋巴结转移更密切的关系,值得进一步的探索。此外,不少环状RNA的表达也与PTC淋巴结转移之间存在相关性。当然,由于不同研究在患者选择方面可能存在的偏倚、研究病例数的不同及RNA表达水平判断界值的差别,可能会影响研究结果,造成不同研究结果之间的差异,后续研究应注意这些问题。(图4)

图4 lncRNA与PTC 恶性行为之间的关系
5 DNA甲基化与PTC淋巴结转移
DNA甲基化是一种表观遗传修饰,指的是甲基(CH)添加到胞嘧啶-鸟嘌呤二核苷酸(CpG)胞嘧啶的5'位置,基因启动子区域的高甲基化可以失活肿瘤抑制基因,也可以激活致癌基因,DNA甲基化通过调控靶基因表达在肿瘤进展中发挥重要作用。
Guan等在38例PTC患者样本中检测了23个DNA修复基因启动子的甲基化水平,结果发现3个DNA修复基因启动子区发生高甲基化,分别为人MutL 同 源 蛋 白 1(human MutL homologue 1,hMLH1)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、8-氧鸟嘌呤DNA糖基化酶(8-oxoguanine DNA glycosylase,OGG1)。与非甲基化组相比,hMLH1基因甲基化组的PTC淋巴结转移率明显增高[63.0%(5/8)vs 10.0%(3/30),P=0.0049]。但是,也有研究发现基因低甲基化水平与淋巴结转移相关,Park等在120例PTC患者样本中检测3个DNA甲基化标记物水平(cg10705422、cg17707274、cg26849382),来反映3个基因的甲基化水平,即与CasL2相互作用的分子(molecules interacting with CasL2,MICAL2)、基质金属蛋白酶7(matrix metalloproteinases 7,MMP7)、透明相关甲型蛋白1(Diaphanous-related formin 1,DIAPH1),探讨它们与淋巴结转移的关系。结果显示,与高甲基化水平的患者相比,合并3个基因低甲基化水平的PTC患者更易出现淋巴结转移[70.0%(70/103)vs 6.3%(1/17),P<0.01]和疾病复发[23.3%(24/103)vs 0(0/17),P=0.022],提示这3个基因低甲基化水平与PTC淋巴结转移和复发相关。虽然目前研究DNA甲基化与PTC淋巴结转移研究的病例数量较少,但是上述研究仍旧看到了不同的甲基化水平与其对照组之间的淋巴结转移率存在差别,值得进一步探索。
综上所述,PTC中一些常见的重要基因突变,如BRAF基因和TERT启动子突变,与PTC淋巴结转移率存在相关性,但是现有的数据显示它们仍不能准确区分PTC淋巴结转移与未转移患者。部分研究提示,某些lncRNA表达水平不同的患者的淋巴结转移率存在明显差别,值得进一步探索。
