复方板蓝根颗粒标准研究与产品评价*
2021-11-22戚建中符国成陈海刚杨一栋
李 柯,戚建中,符国成,陈海刚,杨一栋,陈 丹
(1.湖南省中医药研究院,湖南 长沙 410013;2.华润三九(郴州)制药有限公司,湖南 郴州 423000;3.湘潭医卫职业技术学院,湖南 湘潭 411102)
复方板蓝根颗粒是由板蓝根和大青叶两种中药材组成的中药成方制剂,功能为清热解毒,凉血。临床用于温病发热、出斑、风热感冒、咽喉肿烂、流行性乙型脑炎、肝炎、腮腺炎等。
本品质量标准收载于《中华人民共和国卫生部药品标准》(中药成方制剂第十二册,WS3-B-2377-97)[1],由于历史的原因,制药工艺粗放,质控技术落后,过程风险控制薄弱,这些因素制约了本品发展。经国家食品药品监督管理局网站查证,全国共有150家生产企业有本品批准文号,真正销售过亿元的厂家不多,各企业产品质量差别较大[2-3]。基于临床需要“好药”,产业需要“大药”的理念,促进其产业的健康发展,笔者前期进行了制备工艺研究,变更了药品处方中已有药用要求的辅料;改变影响药品质量的生产工艺[4]。在工艺变更的基础上,本研究以小试、中试及工艺验证21批产品为样本,以精氨酸、L-脯氨酸、亮氨酸和靛玉红为指标性成分,建立薄层色谱鉴别方法;以尿苷、鸟苷和腺苷为指标性成分,建立高效液相色谱含量测定方法并确定了三者总含量的限度。经方法学验证,所建立的质量标准可以控制本品的质量。
1 材 料
1.1 仪器Waters e2695高效液相色谱仪(美国沃特世公司);XS204电子分析天平[瑞士梅特勒-托利多国际贸易(上海)有限公司];KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药复方板蓝根颗粒[批号:1804001N,1804002N,1804003N,华润三九(郴州)制药有限公司],大青叶(批号:190301,产地:甘肃)购自郴州凯程医药有限公司,板蓝根(批号:20190201,产地:黑龙江)购自安徽省亳州市医药供销有限公司,两味药材经检验均符合2015年版《中华人民共和国药典》第一部药材标准。鸟苷对照品(批号:111977-201501,含量93.6%),尿苷对照品(批号:110887-201803,含量99.5%),腺苷对照品(批号:110879-200202,含量100%),R,S-告依春对照品(批号:111753-201706,含量100%),以上对照品均购自中国食品药品检验研究院;甲醇[赛默飞世尔科技(中国)有限公司,色谱级];其他试剂均为分析级。
2 方法与结果
2.1 鉴别
2.1.1氨基酸的薄层鉴别 取本品2 g,加乙醇10 mL,超声处理30 min,滤过,滤液浓缩至2 mL,作为供试品溶液。取板蓝根对照药材0.5 g,加乙醇20 mL,同法制成对照药材溶液。另取L-脯氨酸、精氨酸、亮氨酸对照品,分别加乙醇制成每1 mL含1 mg溶液,作为对照品溶液。另外,根据处方比例分别称取缺板蓝根、缺大青叶药材制成缺板蓝根、缺大青叶的阴性溶液。照薄层色谱法《中华人民共和国药典》2020年版四部(通则0502)试验,吸取对照药材溶液1 μL,对照品溶液1 μL,供试品溶液与阴性溶液2~5 μL,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19∶5∶5)为展开剂,展开,取出,晾干,喷以茚三酮试液,在105℃加热至斑点显色清晰。供试品和缺大青叶阴性样品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点,缺板蓝根阴性样品无精氨酸对照品斑点,说明精氨酸属于板蓝根专属性成分。(见图1)

图1 复方板蓝根颗粒中氨基酸的薄层色谱图
2.1.2 靛玉红的薄层鉴别[5]取本品30 g,研细,加水50 mL溶解,再加50 mL三氯甲烷,加热回流1 h后,取三氯甲烷层溶液,浓缩至1 mL作为供试品溶液。另取靛玉红对照品,加三氯甲烷制成每1 mL含0.1 mg的溶液作为对照品溶液。按照薄层色谱法《中华人民共和国药典》2020年版四部(通则0502)试验,吸取对照药材溶液5μL,对照品溶液5μL,供试品溶液10~15μL,分别点于同一硅胶G薄层板上,以甲苯-三氯甲烷-丙酮(5∶4∶1)为展开剂,展开取出,晾干,日光下检视。供试品色谱中,在与对照药材、对照品色谱相应的位置上,显相同颜色的斑点。(见图2)

图2 复方板蓝根颗粒中靛玉红的薄层色谱图
2.2 成分的含量测定[6-8]
2.2.1 色谱条件Kromasil 100-5-C18色谱柱(250 mm×4.6 mm,5 μm),以甲醇为流动相A,以水为流动相B,梯度洗脱(0~3 min,2%A;3~16 min,2%→5%A;16~20 min,5%→8%A;20~30 min,8%A;30~35 min,8%→20%A;35~42 min,20%→90%A;42~48 min,90%A;48~50 min,90%→2%A;50~60 min,2%A);检测波长为245 nm,流速为0.8 mL/min;柱温为25℃,进样体积5 μL,理论塔板数按尿苷峰计算应不低于5 000。
2.2.2 对照品溶液的制备 分别取尿苷、鸟苷、(R,S)-告依春、腺苷对照品适量,精密称定,加50%甲醇制成每1 mL含尿苷、鸟苷、(R,S)-告依春各20 μg及腺苷25 μg的溶液,摇匀,即得。
2.2.3 供试品溶液的制备 取本品1.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇10 mL,密塞,称定质量,超声处理(功率500 W,频率40 kHz)10 min使溶解,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。2
.2.4阴性对照溶液 按复方板蓝根颗粒处方和制备工艺制备缺板蓝根的阴性样品、缺大青叶的阴性样品,并按“2.2.3”项下方法分别制成缺板蓝根、缺大青叶的阴性样品溶液。
2.2.5 专属性试验 分别精密吸取混合对照品溶液、供试品溶液与阴性对照溶液各5 μL,注入液相色谱仪,测定,即得。(见图3)
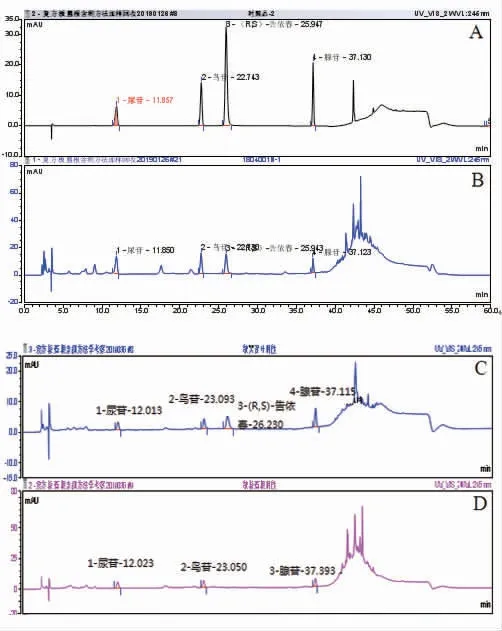
图3 复方板蓝根颗粒HPLC图
2.3 线性关系考察取尿苷、鸟苷、(R,S)-告依春、腺苷对照品贮备液各1 mL,分别稀释2、5、10、20、50倍,制备成一系列不同浓度的对照品溶液。进样5 μL,测定,以浓度(X)为横坐标,峰面积(Y)为纵坐标,进行回归分析,尿苷、鸟苷、(R,S)-告依春、腺苷的回归方程分别为:Y=97.475-0.000、Y=162.308X-0.005、Y=505.581X-0.052、Y=138.411X-0.005。r值均为1.000,结果表明尿苷、鸟苷、(R,S)-告依春、腺苷的浓度分别0.004~0.209、0.002~0.102、0.0008~0.0420、0.001~0.061μg/mL范围内与峰面积呈良好的线性关系。
2.4 精密度试验取同一份均匀供试品溶液(批号:1804001N),按照测定法连续进样6次,记录色谱图,计算各指标峰面积的相对标准偏差,结果尿苷、鸟苷、(R,S)-告依春、腺苷的RSD分别为0.3%、0.2%、0.9%、0.2%,表明本方法仪器精密度良好。
2.5 稳定性试验精密称取已研细的本品(批号:1804001N)1.5 g,按照供试品溶液的制备方法制备,取供试品溶液分别于0、6、16、24、32、38、46、56、64 h分别进样5 μL,记录色谱峰面积,计算相对标准偏差。结果尿苷、鸟苷、(R,S)-告依春、腺苷的RSD值分别为1.7%、1.1%、1.9%、2.1%,表明4个成分在64 h内稳定性良好。
2.6 重复性试验取同批号已研细的本品(批号:1804001N)1.5 g,精密称定,按照供试品溶液的制备方法制备样品,一式6份,按色谱条件进行测定,进样5 μL,记录色谱图,计算含量和相对标准偏差,结果尿苷、鸟苷、(R,S)-告依春、腺苷的含量 分 别 为0.26、0.14、0.06、0.08 mg/g,RSD值 分 别 为2.2%、0.6%、0.9%、2.3%,表明本方法重复性良好。
2.7 加样回收率试验取已知含量的本品(批号:1804001N)0.75 g,一式6份,分别加入同一浓度(相当于100%浓度水平)的尿苷、鸟苷、(R,S)-告依春及腺苷混合对照品溶液后,按照供试品溶液的制备方法制备,平行制备6份供试品。按照测定法测定,计算回收率(%)及其相对标准偏差(RSD)。结果见表1~4。
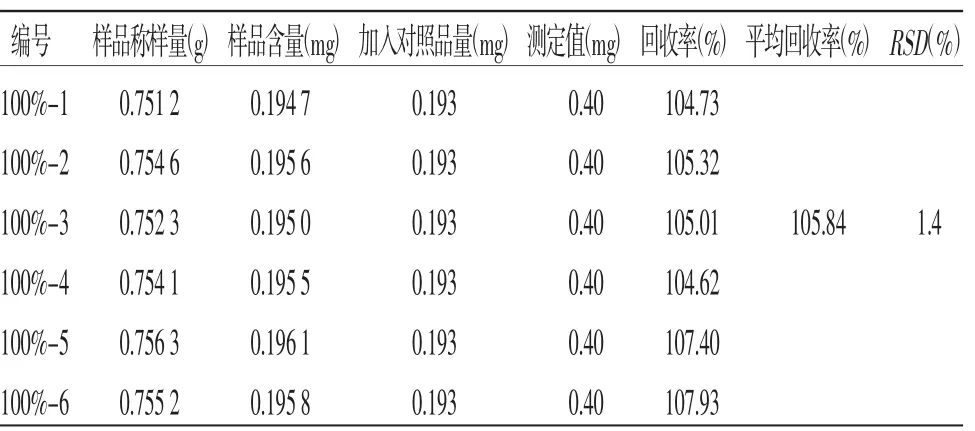
表1 尿苷准确度试验测定结果

表2 鸟苷准确度试验测定结果

表3 (R,S)-告依春准确度试验测定结果
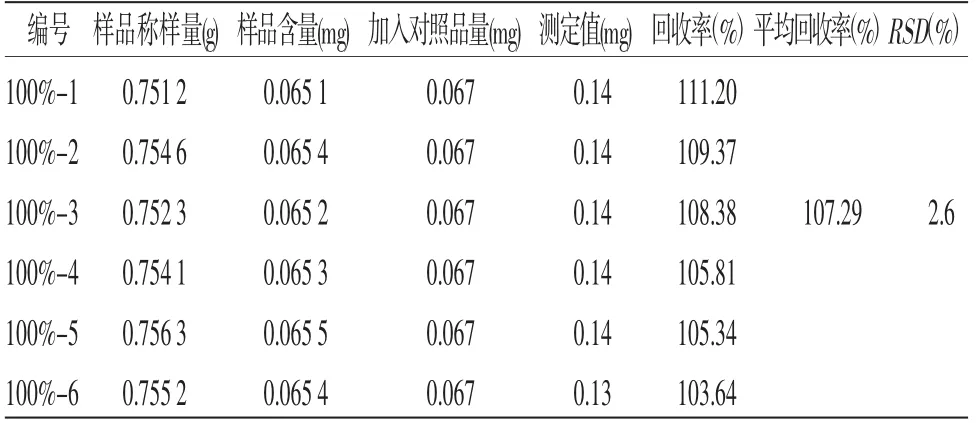
表4 腺苷准确度试验测定结果
2.8 样品含量测定及限度的确定
2.8.1 不同批次样品含量测定及指标成分的选定 按拟定的方法,分别对21批次复方板蓝根颗粒[999R华润三九(郴州)制药有限公司]进行含量测定,结果表明尿苷、鸟苷、腺苷稳定,(R,S)-告依春稳定性不好,不适宜作为含量测定指标。(见表5)

表5 21批次颗粒尿苷+鸟苷+腺苷总含量及(R,S)-告依春含量结果
2.8.2 不同厂家样品含量测定及限度的确定 购买了市场上销量较大的17个厂家共32批次的复方板蓝根颗粒,以尿苷、鸟苷、腺苷总量为测定指标进行测定,结果表明各个厂家尿苷、鸟苷、腺苷总含量差异较大,含有量限度按照平均值(4.40 mg/袋)下浮30%计算,建议规定本品每袋含板蓝根以尿苷、鸟苷、腺苷总量计不得少于3.0 mg。(见表6)

表6 不同厂家复方板蓝根尿苷、鸟苷、腺苷总含量测定结果
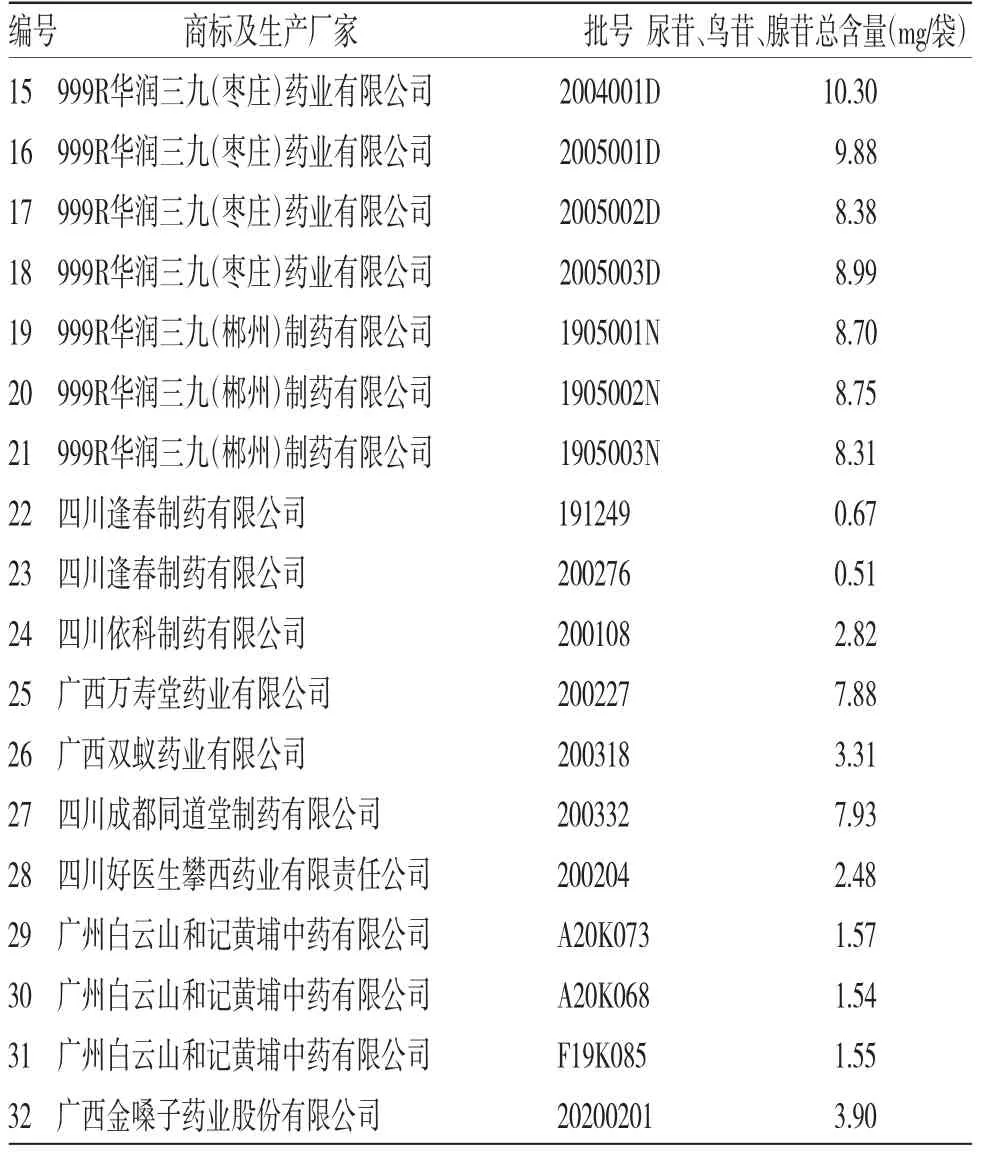
续表6:
3 讨 论
板蓝根药材含量控制成分为(R,S)-告依春,且属于板蓝根特征性成分,但文献报道该成分极不稳定,无论在药材、各类制剂中含量稳定性均极差[9-10],这与工艺验证3批复方板蓝根颗粒稳定性研究结果吻合,且按单位含量计(mg/g)在本品中含量低于万分之二,不适合选择将其作为含量质控成分;另板蓝根颗粒与复方板蓝根颗粒处方组成类似,工艺均为水提醇沉,2019年8月国家药典委员会最新公示的板蓝根颗粒中已取消(R,S)-告依春的测定,鉴于此,暂不考虑将(R,S)-告依春作为本品含量测定的指标性成分,同时鉴于3个成分化学结构相似,均属于核苷类成分,参照板蓝根颗粒最新公示稿标准,以3个成分总量作为本品含量限度控制标准。
对市售32批复方板蓝根颗粒中尿苷、鸟苷、腺苷的总量测定,结果表明差异较大[2-3,11],建议生产企业建立从药材、中间体和成品的质量控制体系,以保证产品的质量。
